文献解读
绘谱导读 | 蛋白质才是脂肪肝的罪魁祸首?肝脏-肠道营养代谢调控领域好文八篇饕餮连读
导读聚焦
随着国内生活水平的提高和超声体检的普及,脂肪肝已经超过乙肝成为第一大慢性肝病,传统认为摄入高糖高脂是促进脂肪肝形成的主要因素。本期导读Cell Metabolism一项研究试图扭转这一看法,发现并证实蛋白质和氨基酸促进脂肪生成的作用更为关键,控制蛋白和氨基酸摄入可改善肝脏脂肪积累和肝损伤;另一篇Cell Metabolism研究表明,营养过剩会增加交感神经和脂肪组织脂解,成为肥胖诱导的胰岛素抵抗以及脂肪组织功能障碍和脂肪肝等代谢性疾病的关键驱动因素;Gut Microbiota一文基于多项研究的肠-肝-脂肪轴的多组学研究证实微生物群和抗病毒反应与全身葡萄糖代谢存在一致性关联。
菌群参与饮食分子代谢方面,本期一篇Cell研究系统绘制了上百种种小分子饮食外源性化合物与肠道微生物组之间的相互作用;Microbiome一文指出肠菌调节柑橘摄入或可干预情绪;Cell Reports Medicine研究发现益生菌及其代谢物亚精胺能够增强细胞的免疫应答,促进机体对乙肝病毒的清除;Med论文发现对多发性硬化症患者补充牛磺熊去氧胆酸(TUDCA)可减少循环免疫细胞,改变肠道细菌;PNAS一文发现肠道微生物修饰的胆汁酸——7-氧脱氧胆酸(7-oxo-DCA)和异脱氧胆酸(isoDCA)通过FXR信号通路影响结直肠癌肿瘤进展的机制。
导读目录
1.Cell Metabolism | 氨基酸是肝脏脂肪生成的主要碳源
2.Gut Microbiota | 肠-肝-脂肪轴的多组学研究肠道微生物群和抗病毒反应与全身葡萄糖代谢的一致联系
3.Microbiome | F. prausnitzii可能调节柑橘摄入量与抑郁之间的关联
4.Med | 胆汁酸代谢物可用于治疗多发性硬化症
5.Cell Metabolism | 营养过剩可通过增加交感神经系统活动导致胰岛素抵抗和代谢紊乱
6.Cell Reports Medicine | 益生菌及其代谢产物亚精胺增强IFN-γ+CD4+细胞免疫抑制乙肝病毒
7.Cell | 饮食外源性物质的微生物转化对肠道菌群组成的影响
8.PNAS | 7-oxo-DCA和isoDCA在结直肠癌症发生中的双重作用
资源领取
本期导读文献原文,请在公众号后台回复“2024年11月绘谱导读”,即可获取资源链接。
【壹】
Cell Metabolism | 氨基酸是肝脏脂肪生成的主要碳源
在肥胖引发的代谢功能失调相关的脂肪性肝病(MASLD)中,新生脂质合成增多是一个典型特征,但其碳源的饮食来源尚不完全清楚。本研究揭示,饮食中的蛋白质是MASLD的主要营养风险因素。代谢流研究证明氨基酸促进肝脏脂肪酸合成的效率远超葡萄糖,而低蛋白饮食则有助于减轻肝脂肪变性及肝损伤,这为MASLD提供了新的营养干预靶点。
1. 首先对NHANES数据集进行了流行病学分析,结果显示,碳水化合物和总脂肪摄入量与MASLD发病率无显著相关性,但高蛋白摄入会使MASLD和MASH的发病风险加倍,这一点在肥胖人群中尤为显著。原代肝细胞的实验显示,氨基酸在线粒体呼吸中的氧化贡献率高于脂肪酸和丙酮酸。接下来,为探讨肝脏脂肪生成过程中氨基酸代谢的作用,从小鼠体内分离出原代肝细胞进行细胞外通量监测。结果显示,在线粒体呼吸过程中,氨基酸氧化贡献率显著超过了脂肪酸和丙酮酸。
2. 随后利用体外标记的代谢流技术,利用U-13C标记的葡萄糖和谷氨酰胺追踪代谢发现,谷氨酰胺在TCA循环和饱和脂肪酸生成中的贡献远高于葡萄糖。
除葡萄糖外,也比较了氨基酸与其他饱和脂肪酸底物:果糖、乳酸和乙酸的脂质生成潜力。结果表明氨基酸整合到脂肪酸中的水平与果糖、乳酸和乙酸相当,都远远超过葡萄糖;小鼠实验进一步证实,饮食氨基酸的脂质生成效率约为葡萄糖的1.25倍。
3. 接下来确定氨基酸代谢重编程在MASLD中的生理意义。抑制谷氨酰胺代谢降低了肝细胞甘油三酯,而GLUD1的过表达减少了肥胖小鼠肝脂积累并改善肝纤维化。低蛋白饮食的干预实验表明,蛋白质限制有效减轻了肥胖小鼠的脂肪肝症状。
4. 最后用低蛋白饲料喂养肥胖小鼠,进行饮食干预实验。结果表明,蛋白质限制减少了肝脏脂质积累,减轻了肝损伤,缓解了肥胖小鼠的脂肪肝症状。
参考文献
Liao Y, Chen Q, Liu L, et al. Amino acid is a major carbon source for hepatic lipogenesis. Cell Metab. 2024.
【贰】
Gut | 肠-肝-脂肪轴的多组学揭示肠道微生物群和抗病毒反应与全身葡萄糖代谢的一致联系
近年来,微生物群的多样性和组成对肥胖、2型糖尿病以及代谢综合征易感性的系统性影响逐渐被认识。然而,大多数调查肠道微生物群和胰岛素敏感性之间联系的研究都使用了单组学方法,专注于特定组织,仅限于个体人类研究。在这项工作中,作者通过应用开创性的综合多组学、多组织、跨队列综合方法,对人类肠道-脂肪-肝脏轴进行了前所未有的整合研究,揭示了肠道微生物群和抗病毒反应与全身葡萄糖代谢的一致联系。
1. 粪便宏基因组检测发现,来自丹毒杆菌科和变形菌门(尤其是肠杆菌科)的若干属和种与胰岛素敏感性存在一致的负相关;来自双歧杆菌属、普雷沃氏菌属以及Blautia和Faecalibacterium属的产短链脂肪酸的物种与胰岛素敏感性呈正相关。KEGG富集分析发现,与胰岛素敏感性有关的微生物基因与硫辛酸和组氨酸代谢密切相关。
2.转录组结果表明,空肠、回肠和结肠T细胞相关的转录组特征与胰岛素敏感性呈正相关。16S rRNA基因测序表明,回肠和结肠变形杆菌门的某些菌属与胰岛素敏感性呈负相关。代谢组结果表明,空肠脱氧胆酸(DCA)与胰岛素敏感性呈负相关。
3. 转录组结果表明,在皮下脂肪组织(SAT)和内脏脂肪组织(VAT)中参与T细胞和Rho GTP酶信号传导的基因与胰岛素敏感性和抵抗有关。
4. 通过整合多组学和多组织数据,将粪便中的变形菌门与空肠和肝脏的脱氧胆酸水平,以及空肠、VAT和肝脏中参与肌动蛋白细胞骨架、胰岛素和T细胞信号通路的转录特征联系起来。空腹血糖始终与干扰素诱导的基因和肠道和VAT中的抗病毒反应有关。对黑腹果蝇的研究验证了这些与人类胰岛素敏感性相关的变化。
参考文献
Castells-Nobau A, et al. Multiomics of the intestine-liver-adipose axis in multiple studies unveils a consistent link of the gut microbiota and the antiviral response with systemic glucose metabolism. Gut. 2024
【叁】
Microbiome | F. prausnitzii可能调节柑橘摄入量与抑郁之间的关联
肠道微生物组在调节饮食对宿主健康的影响中发挥重要作用,但目前尚不清楚哪些特定食物和微生物特征相互作用会影响抑郁症的风险。本文前瞻性地研究了柑橘的长期摄入量与抑郁症和肠道微生物类群丰度的关系,进而研究了这些物种及其代谢潜力与抑郁症的关联。本研究整合了数十年详细的饮食和抑郁信息,以及宏基因组学、代谢组学、元转录组学和宿主基因表达数据,阐明肠道微生物组如何影响饮食-抑郁轴。
1. 来自护士健康研究II(NHS2)32,427名中年女性的饮食和健康数据表明,与较少摄入柑橘类水果的女性相比,柑橘摄入较多的女性通常具有较低的BMI、更频繁的运动习惯以及更高的每日卡路里摄入量。
2. 207名女性的粪便宏基因组学分析发现,柑橘摄入与15种肠道微生物物种的丰度有关,其中11种呈正相关,4种呈负相关。普拉梭菌属(Faecalibacterium prausnitzii)的丰度与抑郁风险降低有关。普拉梭菌属的丰度与SAM循环I途径的丰度有关,而SAM循环I途径与抑郁的负相关。在207名女性的粪便宏基因组分析中,柑橘摄入与15种肠道微生物物种的丰度显著相关,其中11种呈正相关,4种呈负相关。普拉梭菌属(Faecalibacterium prausnitzii)的丰度与抑郁风险降低相关。
3. 进一步分析发现,普拉梭菌属的丰度与SAM循环I代谢途径的丰度密切相关,而该代谢途径与抑郁风险呈负相关。
参考文献
Samuthpongtorn C, et al. prausnitzii potentially modulates the association between citrus intake and depression. Microbiome. 2024.
【肆】
Med | 胆汁酸代谢物可用于预测和治疗多发性硬化症进展
多发性硬化症(MS)是一种中枢神经系统的炎症性脱髓鞘疾病。已有研究表明,MS患者血清胆汁酸水平降低,但其与疾病进展的关系和是否可以用于治疗尚不清楚。本研究发现初级胆汁酸水平的增加与大脑和视网膜萎缩的减缓有关,还证明了对MS患者补充牛磺熊去氧胆酸(TUDCA)是安全的,并且可减少循环免疫细胞,改变肠道细菌。这些发现支持胆汁酸在多发性硬化症中的治疗作用。
1. 已有结果表明,胆汁酸代谢在MS中发生改变,且补充牛磺酸去氧胆酸(TUDCA)可改善多MS小鼠模型的疾病症状。因此首先,研究对MS患者进行非靶代谢组学分析,并结合MRI和OCT扫描构建线性混合效应模型。结果表明,MS患者的初级胆汁酸水平与大脑白质、丘脑、苍白球、平层下灰质和全脑萎缩速度呈反比,而次级胆汁酸的规律则相反。
2. 随后进行临床试验,共纳入54名MS患者,被随机分为安慰剂组和TUDCA治疗组。安全性评估显示,TUDCA组共报告了11次不良反应事件,大多与胃肠道相关,但与安慰剂组之间没有显著差异。血清代谢组学检测表明,在待测的15种循环胆汁酸中,有5种在TUDCA组显著升高。
3. 接下来采用流式细胞术评估了两组人群之间的外周免疫细胞比例。结果表明,TUDCA组的中枢记忆型CD4+T细胞、Th1/17(双阳性)细胞、Th1细胞和Treg细胞的比例下降,而CD4+初始T细胞比例上升,说明补充TUDCA可减少记忆T细胞和其他炎症性T细胞亚型。
4. 最后进行肠道菌群组成评估。宏基因组测序结果表明,TUDCA未改变患者的α和β多样性,但差异分析显示,相比对照组,TUDCA组有22个物种丰度降低,7个物种丰度升高;此外功能分析也鉴定出14条抑制通路和1条激活通路。总之,TUDCA的补充使得PM患者的肠道菌群的组成和功能发生了变化。
参考文献
Ladakis DC, Harrison KL, Smith MD, et al. Bile acid metabolites predict multiple sclerosis progression and supplementation is safe in progressive disease. Med. 2024
【伍】
Cell Metabolism | 营养过剩可通过增加交感神经系统活动导致胰岛素抵抗和代谢紊乱
细胞胰岛素信号受损一直被认为是肥胖诱导胰岛素抵抗的主要机制。已研究表明,营养过剩会导致血浆去甲肾上腺素增加,交感神经系统(SNS)过度激活,但其在肥胖中的作用存在争议。本研究发现,减少神经递质的释放可预防过度营养诱导的胰岛素抵抗及相关代谢疾病,表明SNS活性增加是独立于细胞胰岛素信号的关键因素,其主要通过触发脂肪组织脂解作用导致胰岛素抵抗。
1. 首先构建了一种特异性敲除外周组织中TH基因(神经递质生成关键酶)的小鼠模型,随后进行10周以上的高脂饮食处理。结果显示,模型鼠的体重增量、饮食量等指标与WT小鼠一致,但葡萄糖耐受性提高、甘油和血浆非脂化脂肪酸水平较低,血糖波动与常规饮食的对照小鼠相似、进一步的研究显示,相比WT鼠,模型鼠的胰岛素抑制肝糖原异生的能力显著提高,脂肪代谢调控酶也受到抑制,表明降低SNS活性可改善高脂饮食诱导的肝胰岛素抵抗。
2. 脂肪功能方面的研究表明,相比WT鼠,高脂饮食下模型鼠的脂肪组织炎症、脂肪纤维化基因和衰老标志物等指标均有所改善,说明SNS活性增加是肥胖导致脂肪组织功能障碍的关键驱动因素。代谢性肝病的研究结果与之类似:在高脂饮食下,模型鼠的肝脏脂肪变性程度显著减轻,肝脏脂肪生成相关的酶磷酸化程度降低,炎症标志物和纤维化基因水平显著降低。这些结果强调了降低交感神经活性可改善高脂饮食诱导的脂肪肝。
3. 在机制方面,长期的高脂饮食会导致儿茶酚胺(CA)抵抗,表现为β-肾上腺素能受体表达及信号传导降低,导致脂肪分解减少,并抑制激素敏感性脂肪酶的蛋白表达和磷酸化,而模型鼠中这些现象都得到了抑制。另外,考虑到SNS的一个关键作用就是刺激脂肪组织分解,因此也测试了脂解作用与SNS、胰岛素抵抗之间的关系。结果表明,通过药理抑制或基因敲除脂肪甘油三酯酶(ATGL)减少脂解作用,可以逆转或减轻由交感神经活动或高脂饮食引起的胰岛素抵抗。
参考文献
Sakamoto K, Butera MA, Zhou C, et al. Overnutrition causes insulin resistance and metabolic disorder through increased sympathetic nervous system activity. Cell Metab. 2024
【陆】
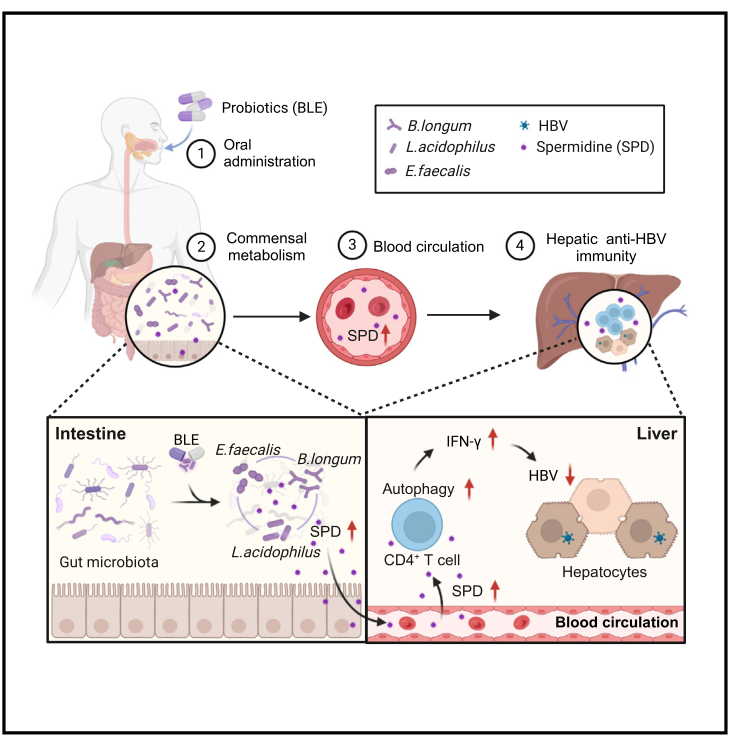
Cell Reports Medicine | 益生菌及其代谢产物亚精胺增强IFN-γ+CD4+细胞免疫抑制乙肝病毒
乙型肝炎病毒(HBV)感染是肝硬化和肝细胞癌的最主要因素。肝脏是协调HBV介导免疫反应的独特靶器官,通过肠-肝轴由肠道微生物衍生的配体或代谢物进行协调,肠道菌群稳态对于机体清除HBV具有积极作用,但其具体机制目前仍未完全阐明。本研究发现,益生菌及其代谢物能够增强IFN-γ+CD4+细胞的免疫应答,进而促进机体对HBV的清除。
1. 通过16S微生物组测序,对HBV携带者小鼠和益生菌BLE(包括长型双歧杆菌、嗜酸乳酸杆菌以及粪肠球菌)给药小鼠肠道微生物组成分析,结果发现BLE类群的物种丰富度显著增加,BLE小鼠的微生物组明显富含Prevotellaceae, Clostridiaceae, Akkermansia和Ruminococcaceae,且BLE处理小鼠代谢相关通路富集。
2. 通过粪菌移植实验发现,移植来自BLE小鼠的粪便微生物群(FMT-BLE)大大促进了受体小鼠对HBV的清除。与接受对照粪便微生物群的小鼠相比,血清HBsAg和HBV DNA水平明显降低,肝脏pgRNA表达明显降低。
3. 非靶向代谢组学分析显示,对照组和BLE小鼠之间有38种代谢物存在显著差异。其中低聚糖、氨基酸和多胺(SPD)变化差异最大。
4. 针对多胺(包括亚精胺SPD、精胺和腐胺)的代谢组学分析显示,在BLE小鼠的肝脏中积累的是亚精胺和腐胺而不是精胺,表明BLE产生的SPD可能通过血液循环从肠道转运到肝脏。
5. 在接受抗病毒治疗的乙型肝炎患者中,补充这些益生菌显示出加速血清HBsAg下降的初步趋势。结果表明补充BLE能够显著降低长期抗病毒治疗患者的血清HBsAg。
参考文献
Wang T, Fan Y, Tan S, et al. Probiotics and their metabolite spermidine enhance IFN-γ+CD4+T cell immunity to inhibit hepatitis B virus. Cell Reports Medicine. 2024.
【柒】
Cell | 饮食外源性物质的微生物转化对肠道菌群组成的影响
人体微生物与人体健康息息相关,而饮食是影响肠道微生物组成的一个主要因素,然而,饮食外源性物质对健康的确切影响仍不明确,个体间在饮食-微生物组相互作用上的差异也可能对健康产生不同的影响。基于这个背景,该研究分析并揭示了肠道微生物与不同类型的膳食异生物质的相互作用,同时系统地绘制了约150种小分子饮食外源性化合物与肠道微生物组之间的相互作用。
1. 饮食外源性物质对肠道微生物生长和代谢的影响:研究使用体外培养和代谢组学技术,研究了29个人类粪便样本与22种饮食外源性化合物的代谢情况,发现肠道微生物能够代谢约150种小分子饮食外源性化合物,而这些代谢作用在不同个体间存在显著差异。
2. 饮食外源性物质对肠道微生物群落的影响:使用16S技术和体外培养技术,分析了不同饮食外源性化合物对4个测试不同微生物群落组成的影响,结果表明,肠道微生物可将外源性化合物转化为有毒或无毒代谢物,从而改变微生物组结构。这一转化能力解释了同一种化合物在不同个体中可能产生不同效应的原因。
3. 白藜芦醇代谢:结合活性纯化和代谢组学技术,研究发现特定饮食外源性化合物(如白藜芦醇)的代谢产物能够抑制肠道共生细菌的生长,结合CRISPR基因编辑和异源表达技术,结果发现Elen_288是Coriobacteriia中负责白藜芦醇代谢的关键酶,该酶在不同个体间的差异表达与肠道微生物群落对外源性化合物的响应有关。
参考文献
Culp, E. J., Nelson, N. T., Verdegaal, A. A., & Goodman, A. L. Microbial transformation of dietary xenobiotics shapes gut microbiome composition. Cell. 2024
【捌】
PNAS | 7-oxo-DCA和isoDCA在结直肠癌症发生中的双重作用
结直肠癌(CRC)是美国第三大癌症死因,其发生与胆汁酸(BAs)的代谢紊乱密切相关,BAs与核受体FXR的相互作用在CRC发展中扮演关键角色。已有研究表明,肠道微生物能修饰BAs,其中7-氧脱氧胆酸(7-oxo-DCA)和异脱氧胆酸(isoDCA)与CRC进展相关,但其具体作用机制尚不清楚。基于这个背景,本研究旨在揭示这两种微生物修饰的BAs在肿瘤发生中的作用及其通过FXR信号通路影响肿瘤进展的机制。
1. 7-oxo-DCA促进肿瘤发展:使用动物模型以及细胞培养技术,发现7-oxo-DCA作为FXR的自然拮抗剂,能促进癌细胞生长,增加肠道干细胞的增殖,并在APCMin/+小鼠模型中增加了肠道通透性和肿瘤负担。结合基因表达分析技术,发现通过上调Wnt信号通路和下调FXR信号,7-oxo-DCA促进了肿瘤发生和恶性转化。
2. isoDCA抑制肿瘤发展:使用动物模型以及细胞培养技术,发现isoDCA作为FXR的强效激动剂能抑制癌细胞生长。结合基因表达分析技术,发现通过抑制Wnt信号通路和上调FXR信号,isoDCA能够抑制癌细胞生长,保护肠道屏障,并减少肿瘤负荷。
3. BA代谢的调结:使用靶向代谢组学技术,发现isoDCA和7-oxo-DCA都能改变体内的BA池,isoDCA增加了BA多样性,而7-oxo-DCA则影响了BA的代谢,从而对肠道健康和CRC进展产生影响。
4. 微生物组的改变:使用16S微生物组学技术,发现7-oxo-DCA和isoDCA都能重塑肠道微生物组,但重塑方向相反,7-oxo-DCA会降低了微生物多样性,而isoDCA则显示出增加多样性的趋势,它们通过影响肠道微生物组的组成和多样性,对CRC发展产生影响。
参考文献
Dong, X., Sun, F., Secaira-Morochoc, H., et al. The dichotomous roles of microbial-modified bile acids 7-oxo-DCA and isoDCA in intestinal tumorigenesis. PNAS. 2024
END