文献解读
Cell Metabolism | 支链氨基酸分解代谢的丧失增强mTORC1的活性并促进肿瘤的生长和进程
代谢重编程是肿瘤的一大重要特征,在过去几十年内已被大量报道。然而这究竟是细胞增殖的普遍现象,异常信号通路的无意识结果,还是功能性地参与癌变过程就知之甚少。肝脏是少数几个在部分切除后可完全再生的器官之一。因此,肝脏再生和癌变研究为了解良性和恶性增殖过程的异同提供了独特的机会。
肝癌本身是一个重大的健康负担,是导致癌症相关死亡的第二大原因。最近的遗传分析研究表明肝细胞癌相关突变主要影响p53, Wnt-β-catenin通路和PI3K-AKT-mTOR通路。然而,以它们为靶点的预防或治疗方式大多数是失败的,因此,迫切需要寻找新的干预因素或替代干预方法。为了发现可靶向干预的肿瘤特异性通路,新加坡的韩卫平科研团队采用转录组学和代谢组学技术在人类肿瘤组织、癌细胞系和动物模型上对肝癌形成和肝脏再生过程展开研究,相关成果发表于国际知名期刊《Cell Metabolism》。
肝癌发生发展中支链氨基酸分解代谢逐步丧失
对48例肝癌患者的癌症组织和癌旁组织进行转录组及差异表达分析,筛选出3624个显著的基因,并和已发表的一个独立肝癌队列(TCGA-LIHC)比对,在两个队列中共筛选出1405个显著变化的基因(图1A&B)。KEGG通路分析发现支链氨基酸(BCAA)降解是最显著的通路(图1C)。在参与BCAA降解的约40个代谢酶中,除了BCAT1和BCAT2,这些酶对应的转录产物在肿瘤组织中被广泛抑制(图1D)。BCAA分解代谢的两个关键且不可逆反应需要支链酮酸脱氢酶(BCKDH)复合物和酰基辅酶A脱氢酶(ACAD)的参与。Western blot分析显示肿瘤组织中BCKDHA、ACADS和ACADSB酶显著下调(图1E)。另一个独立队列的活组织免疫组化染色也证实了参与BCAA分解酶在蛋白水平广泛下调(图1F)。体外酶活试验也相应地显示肿瘤组织中BCKDH复合物活性急剧下降(图1G)。研究团队利用靶向代谢组学方法对肿瘤和癌旁组织中的氨基酸、有机酸和酰基肉碱类进行检测分析,在肿瘤组织中乳酸、乙酰肉碱和大量长链酰基肉碱水平显著增加,而许多中链酰基肉碱显著减少(图1H)。重要的是三种BCAAs在肿瘤组织中显著升高,而下游分解产物显著降低,与转录组结果一致。
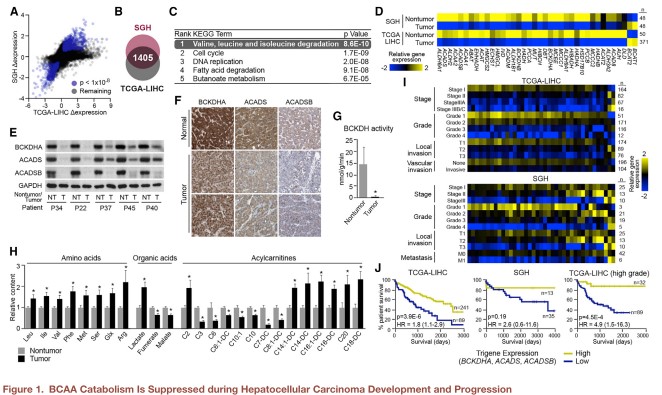
综上,转录组、酶和代谢组学分析结果显示BCAA分解代谢酶的抑制导致了肝癌组织中BCAAs的累积,肝癌中BCAA分解代谢酶表达的缺失在疾病进展过程中是被积极选择的,且对患者预后具有显著影响。
支链氨基酸分解代谢在再生肝组织中并不会被抑制
考虑到癌细胞增殖的代谢需求和正常肝细胞增殖的代谢需求是一致的,那么被抑制的BCAA分解代谢是肿瘤特有的,还是在肝脏再生中也会发生?研究团队采用了两种肝癌动物模型(二乙基亚硝胺DEN和同源原位Morris 3924a肝细胞癌模型),进行了类似的转录组和代谢组分析。即使剔除再生肝组织中差异表达的基因,BCAA分解代谢仍然是肿瘤组织中变化最显著的通路(图2A&B)。肿瘤组织中表达抑制的BCAA分解代谢酶在再生肝组织中却是适度增强(图2C)。代谢组学结果也显示BCAAs在两种动物模型中都是累积的,而在再生组织中并不会(图2D)。相应的,BCAA下游代谢物在肿瘤组织中显著降低,而再生肝组织中并不会降低(图2E)。
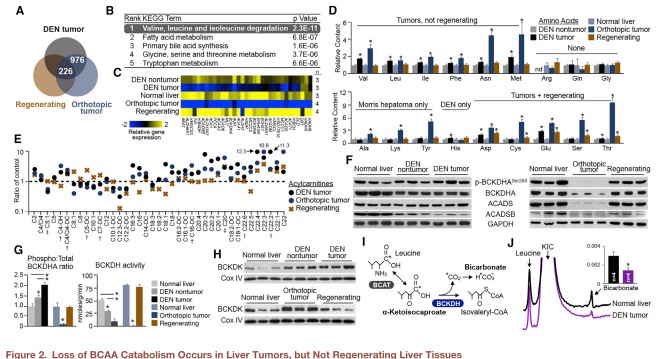
进一步对正常、肿瘤和再生肝组织中的蛋白水平和酶活性进行检测分析。值得注意的是,抑制BCKDH复合物的活性除了抑制总蛋白的水平还可通过BCKDK激酶磷酸化BCKDHA亚基来实现。Morris肿瘤组织中BCAA分解代谢酶的蛋白水平急剧下降,DEN诱导的肿瘤中BCKDHA磷酸化更为明显(图2F)。相比于正常肝组织,DEN暴露的肝组织中磷酸化BCKDHA占总BCKDHA的比例升高,并在肿瘤中进一步升高(图2G)。BCKDK激酶在癌变前组织和癌组织中及人类肝癌组织中均过表达(图2H)。BCKDH酶活试验证实无论是磷酸化还是总蛋白水平抑制,所有肿瘤组织中酶的分解代谢能力显著降低(图2G)。重要的是,再生肝组织中磷酸化/总BCKDHA的比例、BCKDH活性和BCKDK的表达都是不变的(图2G&H)。基于自主建立的超极化13C磁共振光谱法对体内酶活性定量分析,发现BCKDH活性在活体肿瘤组织中也是显著降低的(图2J)。
以上数据表明,与肝肿瘤发生相比,再生肝组织的增殖并不会表现出BCAA分解代谢减少或BCAAs的累积。
肿瘤组织中BCAA分解代谢酶的表达与拷贝数及转录因子的变化有关。
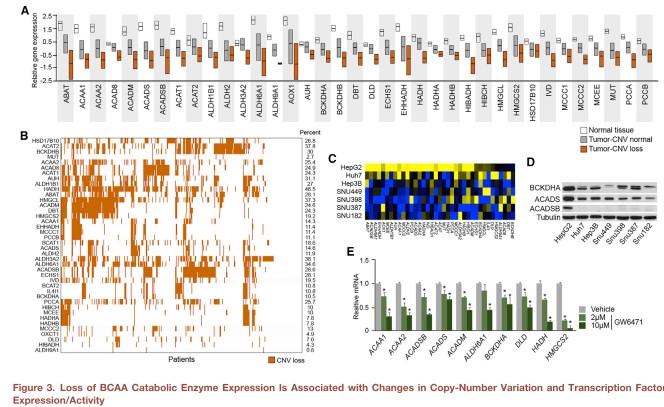
细胞系的结果和人类、动物肝组织的结果一致。与分化良好的非致瘤细胞系HepG2相比,致瘤HCC细胞系在mRNA和蛋白水平上都显著降低BCAA分解酶的表达(图3C&D)。和上游分析结果一致,敲低PPARα或用拮抗剂GW6471抑制PPARα的转录活性可显著抑制HepG2细胞BCAA分解代谢酶的表达(图3E)。
以上数据表明肝癌组织中BCAA分解代谢酶的下调可能是因为体细胞拷贝数和转录因子功能的变化。
BCAA分解代谢调控mTOR活性和细胞增殖
前文探讨了肿瘤组织中BCAA分解代谢发生变化的可能原因,那么它的变化会引起怎样的后果呢?和许多其他癌症一样,肝癌也能够模拟慢性生长因子来刺激mTORC1蛋白。以往的研究表明mTORC1的激活能显著促进细胞生长及肿瘤发生,包括肝癌在内。本研究在人类和动物肝癌组织中也发现mTORC1的下游效应蛋白S6K和S6过度表达或高度磷酸化(图4A)。mTORC1结合生长因子和营养丰度信号,且去除任何一种输入都足以阻断其活性。关键的代谢物能够导致Rag蛋白的激活,诱导mTORC1至溶酶体以便Rheb蛋白能够激活mTOR。已有报道表明亮氨酸具有这种独特的功能,它的移除即使在其他氨基酸存在时也会使Rag蛋白失活。因此,作者假设肝肿瘤组织中BCAA分解代谢的抑制和BCAAs的累积可能是肿瘤促进mTORC1慢性活化的主要机制。研究团队在永生化肝细胞系AML12中发现,敲低BCKDHA可致胞内BCAAs累积,增强mTORC1活性和细胞增殖速率(图4B)。
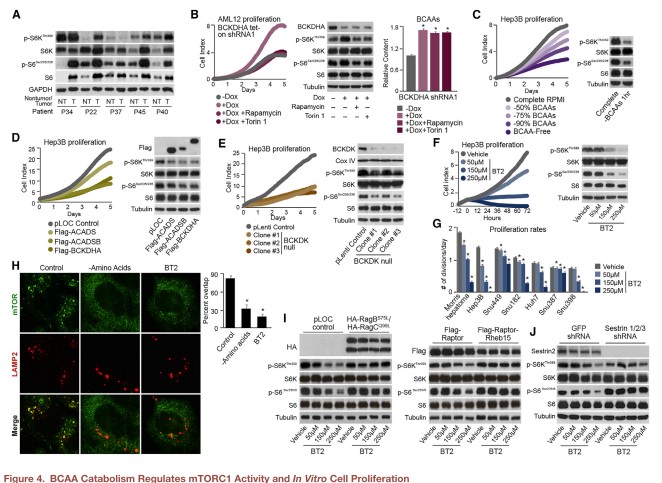
BCAAs属于必需氨基酸,不能内源性合成。那么限制BCAAs的补充或恢复BCAA分解代谢是否能影响肝癌细胞的体外增殖?研究团队采用Hep3B肝癌细胞系发现,降低或去除BCAAs能显著抑制mTORC1的活性和细胞增殖速率(图4C),而恢复BCAA分解代谢酶的表达亦有同样的效果(图4D)。由于人类和动物肝癌组织中BCKDK表达增强,而激酶可作为潜在药物靶点,是否能够通过抑制激酶活性来恢复BCAA分解代谢从而抑制细胞增殖?的确,BCKDK基因敲除能降低细胞增殖速率和mTORC1的活性(图4E)。使用已经明确的BCKDK抑制剂BT2来处理肝癌细胞,同样发现剂量依赖性的细胞增殖和mTORC1活性降低(图4F),且结果在不同细胞系中是一致的(图4G)。BT2处理可诱导和营养素(氨基酸)移除类似的mTOR弥散(图4H),提示BT2通过调节营养感应臂来抑制mTORC1活性。相应地,表达活化的突变Rag蛋白或使mTORC1复合物靶向溶酶体的关键成分能够让细胞抵抗BT2介导的mTORC1活性抑制(图4I)。Sestrin2是主要的可调节Rag蛋白的亮氨酸感应器。将Sestrin敲低后,细胞可获得类似的抵抗能力(图4J)。
综上表明,BCAA补充和分解调控癌细胞的增殖和mTORC1活性,提示肿瘤中BCAA分解代谢的丧失有助于维持mTORC1的慢性激活。
高BCAAs膳食摄入增强肿瘤发生发展
操控BCAA的水平能否影响体内肿瘤的发展?研究团队对DEN肝癌小鼠模型给予标准或高水平BCAAs喂养。考虑到脂肪酸对BCAAs累积的影响,同时对低脂和高脂饮食进行了考察。注射DEN五个月后,低脂饮食组没有发生肿瘤,而高脂和/或BCAAs组肿瘤发生率为20-40%(图5A),且最大的肿瘤来自于高BCAAs组(图5B)。注射八个月后,高BCAAs组肿瘤数目和大小显著增加(图5D-F)。此外,注射DEN的高BCAAs组肝重增加,而没有注射DEN的肝重却没有增加(图5C&G),提示饮食BCAAs能够影响有癌变倾向的肝组织,但对健康肝组织的影响微乎其微。相应地,无DEN注射的正常肝组织对高BCAAs或脂肪的响应是增强BCAA分解代谢酶表达,而它们在注射DEN的非肿瘤组织中是显著降低的,且在肿瘤组织中进一步降低(图5H)。
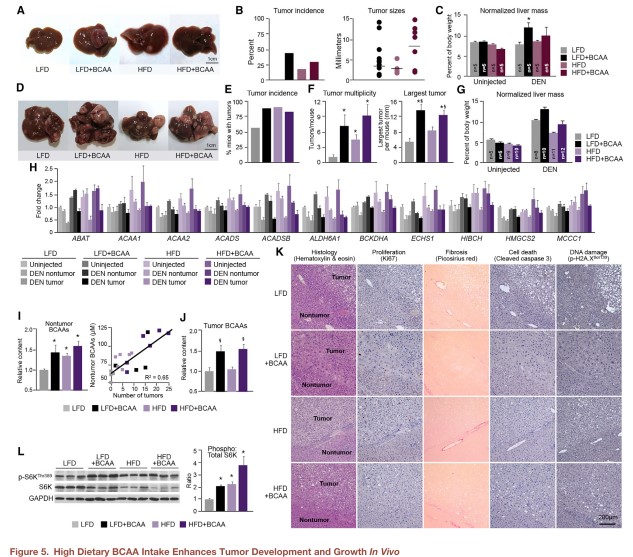
代谢组学分析显示高BCAA喂养组小鼠的非肿瘤肝组织和肿瘤组织中都发生了显著的BCAAs累积(图5I&J),且BCAAs的含量和肿瘤的数目或大小相关(图5I&F)。另外,高BCAAs膳食并不会增强DNA损伤、纤维化或细胞死亡(图5K)。相反,和体外实验结果一致,在高BCAA膳食小鼠肝组织中mTORC1通路被高度激活(图5L)。因此,肝组织中BCAAs的含量和肝肿瘤的发生及大小直接相关,而这主要是由于饮食中的高BCAAs摄入及mTORC1通路的激活。
增强BCAA分解代谢或约束饮食BCAAs摄入可限制肿瘤负荷
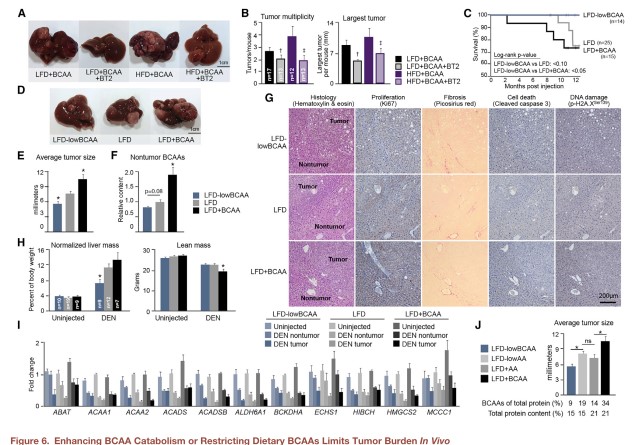
既然BCAAs累积和肿瘤发生直接相关,那是否可以通过增加BCAA分解或限制饮食摄入来减轻肿瘤负荷?使用BCKDK抑制剂BT2处理高BCAA膳食DEN肝癌小鼠模型后,肿瘤负荷显著降低(图6A&B)。更重要的是该化合物在实验期间没有任何明显的副作用。将饮食中BCAAs减少一半后,DEN小鼠在实验期间全部存活,而只有70%喂食正常或高BCAAs的小鼠存活下来(图6C)。低BCAAs组小鼠的肿瘤明显减小,肝BCAAs含量也显著降低(图6D-F),且瘦体重和肝功能得以维持(图6G-I)。此外,高和低BCAAs饮食的影响并不是因为蛋白摄入量的差异,因为按总蛋白矫正后,结果依然是类似的(图6J)。
以上数据表明BCAAs的累积对于肝肿瘤的发生发展是至关重要的,而饮食的干预能够影响肿瘤的进程和总体生存。
不同癌症间BCAA分解代谢的对比
为了验证BCAA分解酶在不同癌症间的表达是否存在差异,在TCGA上筛选出16种癌症的数据集,大约70%的癌症表现出对至少一半的BCAA分解代谢途径的显著抑制(图7A)。除了BCATs,大部分酶的表达都是显著降低的(图7B)。和肝细胞癌类似,结肠、直肠、胃、肾和肾上腺皮质癌中相关酶的表达降低与肿瘤进程及侵袭性相关(图7C),大量BCAA分解酶的表达水平可用于预测这些癌症患者的生存率。

BCAA低组织分解代谢及高膳食摄入与高癌症死亡风险相关
作者在TCGA上收集了33种癌症的转录组数据,并用BCKDHA、ACADS和ACADSB组成的表达指数来筛查这些癌症队列。大约60%的癌症有中度到强烈的患者生存差异,上述三种基因的表达越高,患者的预后越好(图7D)。将所有癌症作为一个泛癌症队列,表达指数更高的患者生存期大大延长(70%存活率时,1849天对732天)。为了明确日常摄入BCAAs和人类癌症死亡率的关联,作者分析了美国国家健康与营养调查(NHANES)Ⅲ数据集和相关死亡率数据。总体上,50-66岁高摄入人群的癌症死亡风险比低摄入人群增加了200%(图7E),等热量地将BCAAs替换为碳水化合物或脂肪可以降低50%以上的癌症死亡风险。
小结
利用多组学技术检测了肝癌形成和肝组织再生过程中转录组和代谢组学的变化,发现支链氨基酸分解代谢的逐步丧失促进肿瘤的发生发展(图7G)。在人类和动物肝癌组织中,BCAA分解代谢酶的抑制会导致BCAAs的累积,而在正常增殖的肝再生组织中并不会。癌变过程中BCAA分解代谢的缺失, mTORC1活性增强,促进肿瘤的发生发展,这些不可逆分解代谢酶(最显著的是BCKDHA、ACADS和ACADSB)被抑制的程度和肿瘤的侵袭性高度相关,且可独立预测临床结果。人为干预BCAAs的累积可以在体外调节癌症细胞的增殖,在体内可以调节癌症负荷及总体生存率。人类饮食中BCAAs摄取量和死亡风险相关。BCAA分解代谢的丧失给予肿瘤功能性方面的优势,可在特定的癌症中被开发成新的治疗靶点。
参考文献
Ericksen et al., 2019, Loss of BCAA Catabolism during Carcinogenesis Enhances mTORC1 Activity and Promotes Tumor Development and Progression. Cell Metabolism 29 , 1–15.



