文献解读
Cell Metabolism | 底物网络“追踪”记:代谢流揭秘新生脂质合成途径
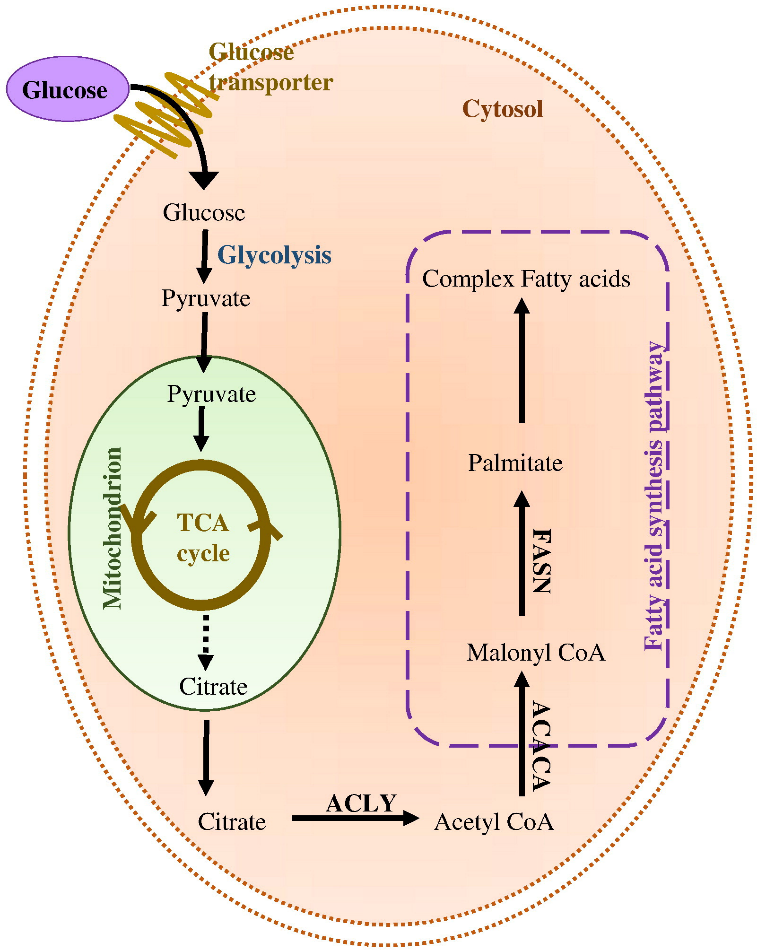
在生物体内所有产生热量的分子中,脂类具有最高的能量密度,这为它们能量的储存和消耗提供了巨大的优势。新生脂质合成(DNL,也叫“从头合成“),就像一座微型的 “脂肪工厂”,利用碳水化合物、氨基酸、蛋白质等原料来生产脂质,为身体储存能量、构建细胞膜等提供关键物质。
De novo lipogenesis in health and disease,Ameer, Fatima et al. Metabolism-Clinical and Experimental, Volume 63, Issue 7, 895-902
DNL主要发生在肝脏和脂肪组织中。一般来说脂质新生对全身脂质储存的贡献相对较小,但如果摄入碳水过多,超过了当下需求和储存所需,这时候脂质新生的速率会明显增加。在代谢性疾病状态下,新生脂质合成(DNL)也会普遍升高。胞质的乙酰辅酶A是DNL中心通路的共同前体,以其为靶标从而针对DNL可能是一种有效的干预方案。但DNL的底物构成网络十分复杂:一方面,TCA循环中的丙酮酸可以通过线粒体丙酮酸载体(MPC)-线粒体柠檬酸载体(CiC)轴为DNL功能,另一方面,胞质中的乙酸也可以通过乙酰辅酶A合成酶2(ACSS2)直接与辅酶A结合生成乙酰辅酶A,从而绕过线粒体转运和代谢步骤。因此,明确这些途径中的酶和底物如何相互作用以及各底物的贡献比例,是建立干预方案的前提和基础。
2024年10月,美国爱荷华大学卡佛医学院团队在Cell Metabolism上发表了题为“A hierarchical hepatic de novo lipogenesis substrate supply network utilizing pyruvate, acetate, and ketones”的研究论文,揭示了来自丙酮酸/柠檬酸和乙酸的乙酰辅酶A产生途径在DNL中的关系,同时也发现一条酮体来源的回补途径,为治疗性调节DNL的策略提供了理论信息。
研究思路
DNL:新生脂质合成;CiC:线粒体柠檬酸载体
ACSS2:乙酰辅酶A合成酶2;ACLY:ATP-柠檬酸裂解酶
MPC:线粒体丙酮酸载体;AACS:乙酰乙酸裂解酶
研究结果
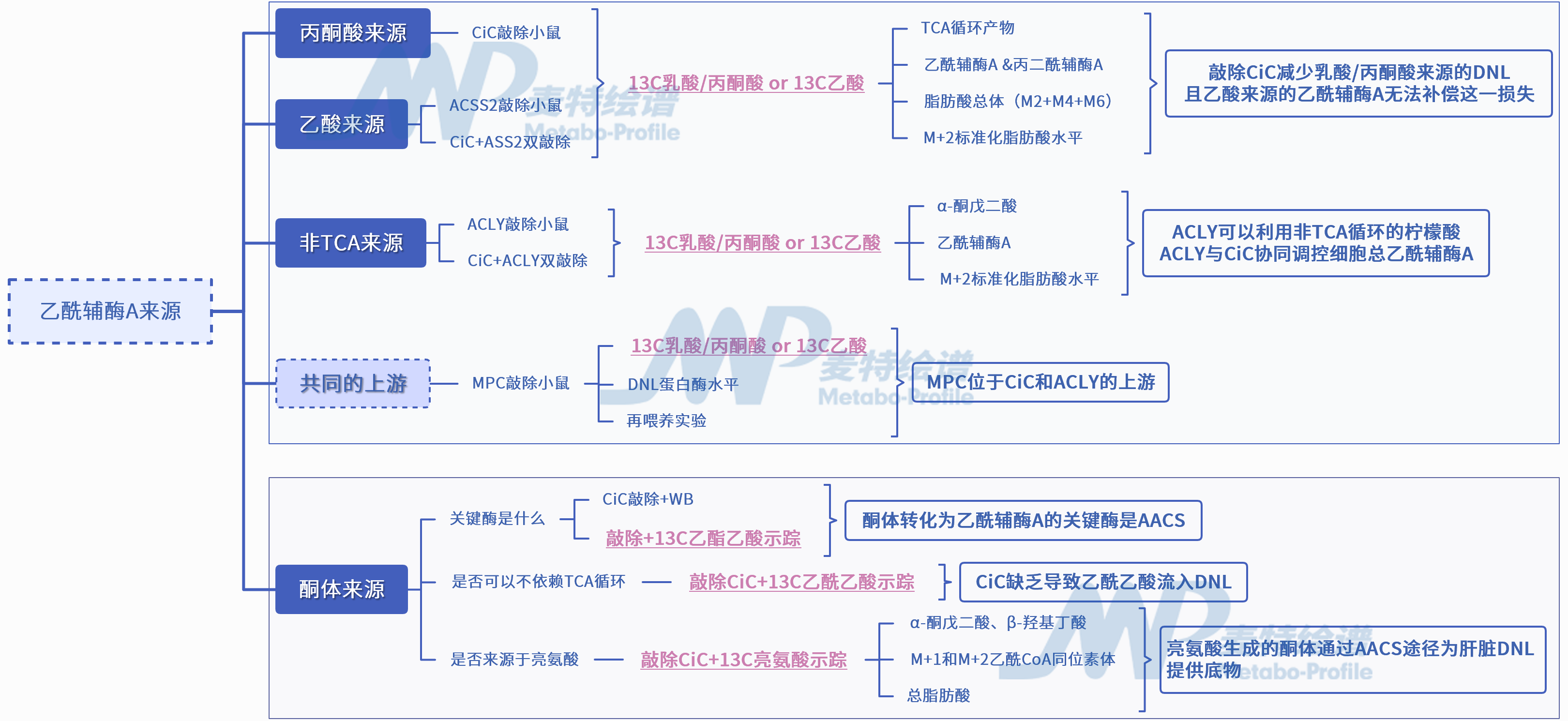
1. CiC可调控肝脏的DNL
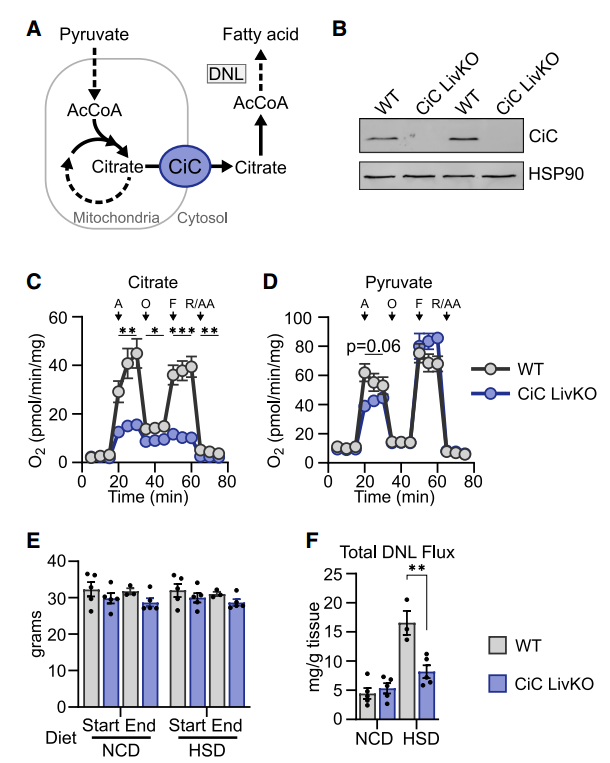
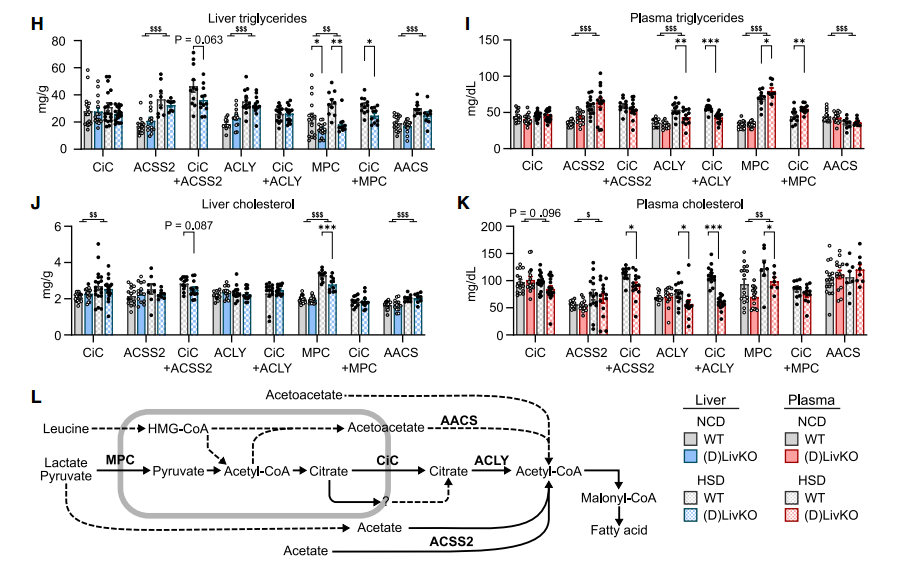
首先构建肝脏特异性CiC敲除小鼠,通过呼吸测量实验验证了线粒体柠檬酸氧化显著减少,而丙酮酸氧化未受影响,此外高糖饮食干预未使得CiC敲除小鼠的体重发生显著变化,也排除了肥胖对代谢测试的干扰。
随后对正常和高糖饮食的CiC敲除小鼠进行体内2H2O注射,利用NMR对肝脏脂质中的氘进行追踪,以确定新生脂肪的含量。结果表明,CiC非依赖性的DNL途径可以一定程度弥补CiC的缺失,且高糖诱导的肝脏DNL增加需要CiC的参与。
2. 敲除CiC减少乳酸/丙酮酸来源的DNL
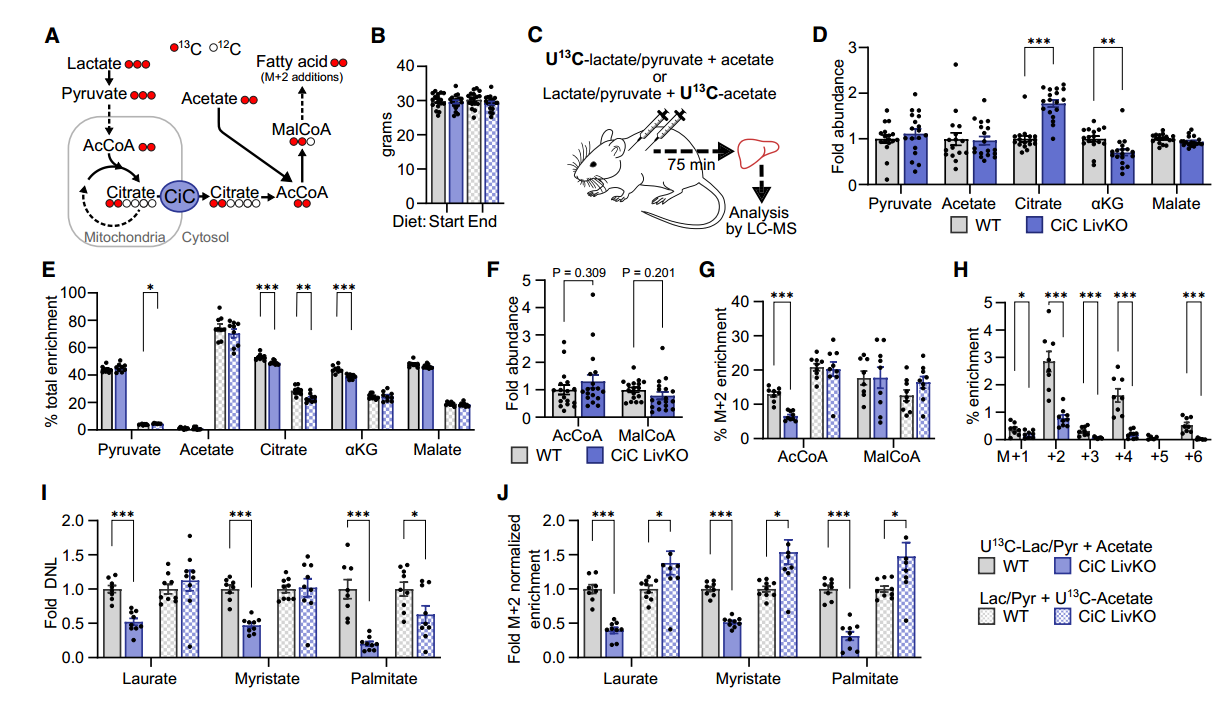
随后为了确认CiC非依赖性DNL的底物来源,分别用13C标记的丙酮酸和乙酸进行了代谢流检测,具体而言,研究者设计了底物竞争实验,通过腹腔注射分别给予CiC敲除小鼠[U13C]乳酸/丙酮酸(10:1)+未标记的乙酸盐的组合,以及未标记的乳酸/丙酮酸+[U13C]乙酸盐的组合,通过靶向代谢组检测分析13C流向和富集情况,以此观察丙酮酸和乙酸盐在DNL中的利用情况。
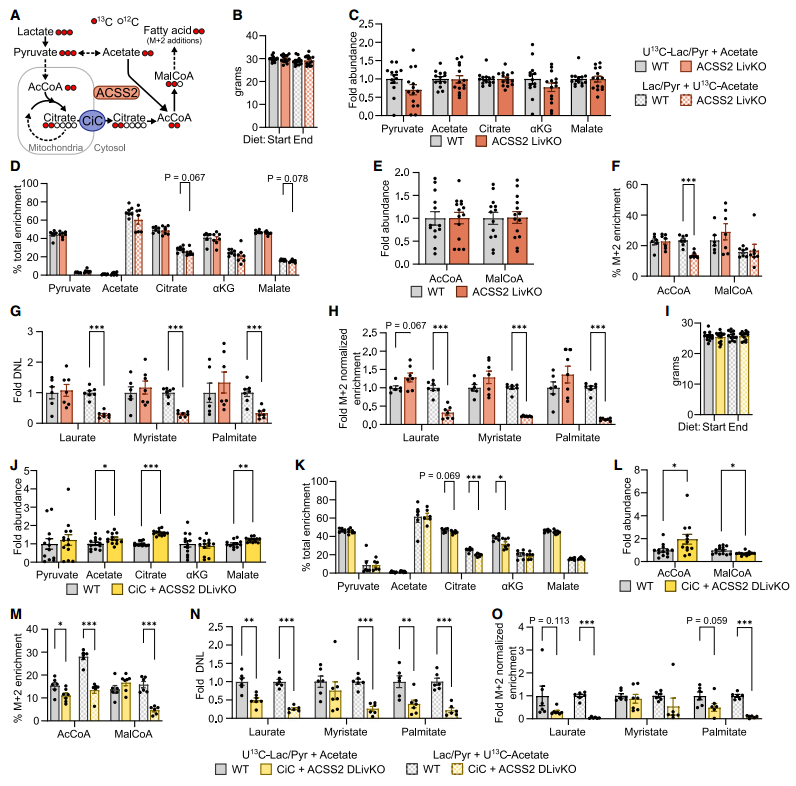
线粒体柠檬酸盐载体(CiC)控制肝脏从头脂肪生成(DNL)
在TCA循环中,观察到CiC敲除小鼠肝脏中柠檬酸水平增加,而下游产物水平降低,13C-丙酮酸的富集程度低于13C-乙酸盐,但来自[U13C] 乳酸/丙酮酸的TCA产物富集程度高于来自[U13C]乙酸的。此外,CiC敲除小鼠肝脏的乙酰辅酶A和丙二酰CoA总体水平没有显著变化,但13C示踪显示来自乳酸/丙酮酸的乙酰辅酶A略有减少。
在DNL过程中,敲除CiC导致 [U13C]乳酸/丙酮酸来源的13C脂肪酸比例均显著下调,而并未观察到来自乙酸盐的DNL回补。进一步对各脂肪酸的同位素异构体进行M+2水平的标准化,发现敲除CiC导致丙酮酸对作为DNL前体的乙酰CoA池的贡献减少,而乙酸盐的贡献增加。
CiC敲除减少来自乳酸/丙酮酸来源的DNL,但不减少乙酸来源的DNL
3. ACSS2介导的乙酸旁支无法回补CiC的缺失
基于上述结果,接下来评估乙酸分流能否作为CiC敲除后的乙酰辅酶A来源。构建肝脏ACSS2特异性敲除的小鼠模型后,进行平行的13C标记底物竞争实验。
进一步地构建了CiC+ACSS2双肝脏特异性敲除小鼠,观察到与CiC敲除小鼠相似的柠檬酸累积现象;确定ACSS2的敲除减少来自乙酸来源的DNL,但不减少乳酸/丙酮酸来源的DNL。
ACSS2的敲除减少来自乙酸来源的DNL,但不减少乳酸/丙酮酸来源的DNL
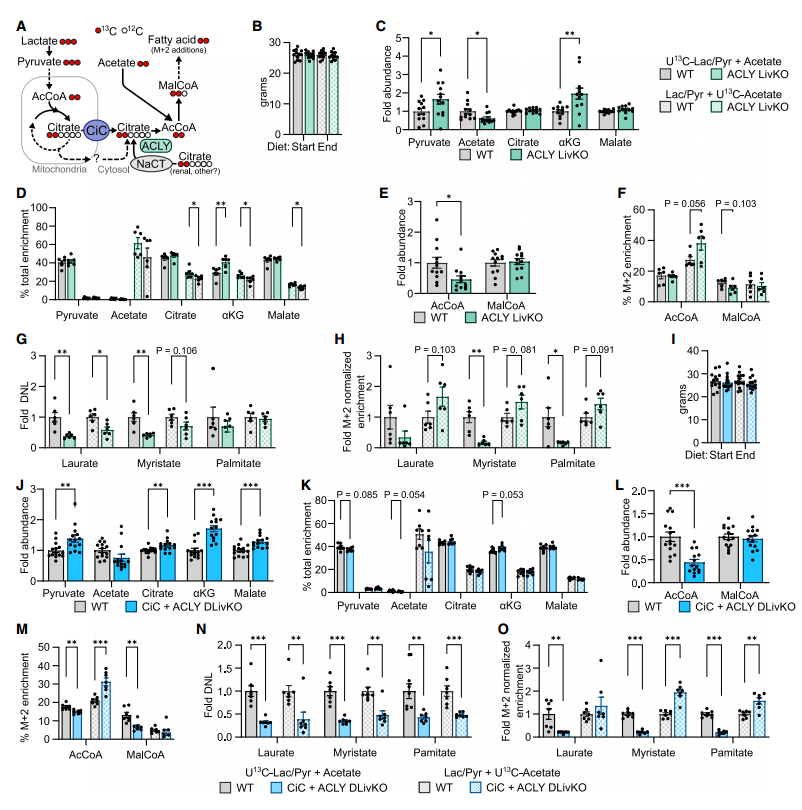
4. 乙酰辅酶A的另一来源:ACLY旁支
在排除了乙酸旁支后,研究者考虑胞质柠檬酸是否通过非TCA循环生成乙酰辅酶A。考虑到ACLY(ATP-柠檬酸裂解酶)可以利用除线粒体外其他来源的柠檬酸,因此构建了ACLY肝脏敲除小鼠重复上文所述的平行13C标记实验。
鉴于TCA循环和ACLY具有明显不同的代谢效应,研究者同时敲除小鼠的CiC和ACLY,继续重复平行13C标记实验。
以上结果表明,ACLY在控制细胞总乙酰辅酶A方面对TCA循环具有代谢上位性,二者协同调控来自丙酮酸的DNL。
ACLY敲除从乳酸/丙酮酸来源减少DNL
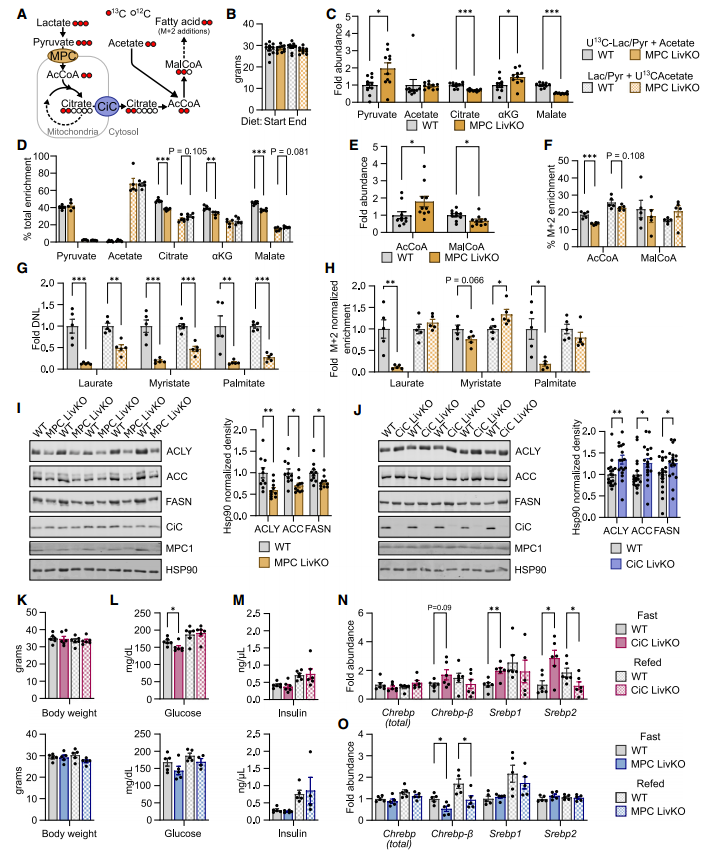
5. MPC位于TCA和ACLY的上游
鉴于敲除CiC和ACLY在DNL过程中的相似性,研究者考虑线粒体丙酮酸通过MPC作为二者上游的作用。结果显示,MPC敲除导致乳酸和丙酮酸含量增加,而TCA产物大多减少,其中来自乳酸/丙酮酸的13C富集减少,而乙酸来源的不受影响;此外,敲除MPC使得乙酰辅酶A含量增加,丙二酰辅酶A含量减少,其中乳酸/丙酮酸来源的乙酰辅酶A标记减少,导致总13C脂肪酸富集降低,程度超过CiC或ACLY敲除;从DNL蛋白酶水平来看,MPC敲除小鼠中ACLY、ACC和FASN的水平降低,而CiC敲除小鼠中这些酶上调。
MPC敲除同时减少来自乳酸/丙酮酸和乙酸的DNL
6. 除此之外还存在酮体来源的互补途径
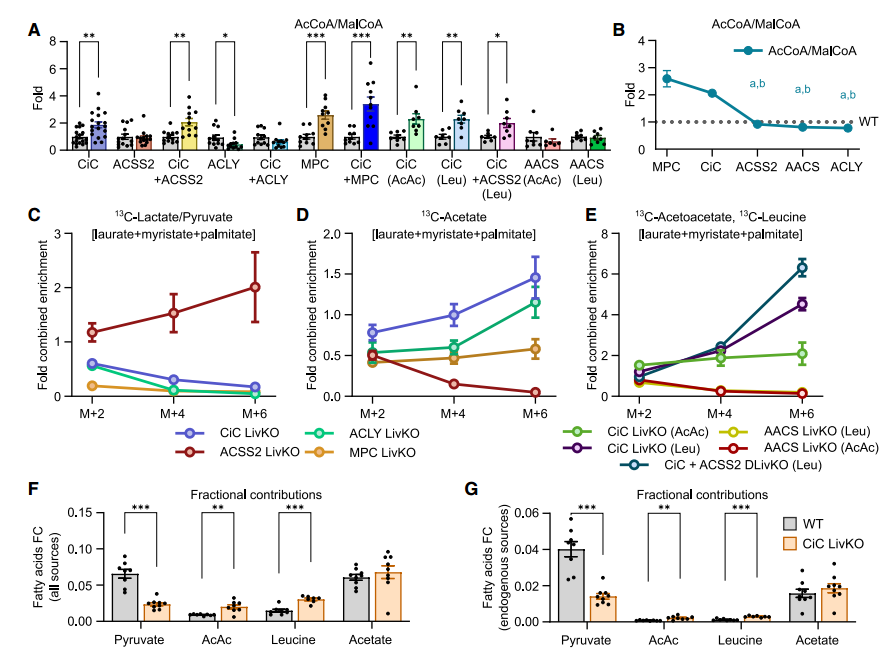
由于丙酮酸和乙酸代谢无法完全解释DNL底物的冗余现象,研究者探索了其他可能的途径。早期研究表明酮体可作为DNL的底物。禁食处理下CiC敲除小鼠肝脏中AACS转录水平增加,而ACAT2转录水平不变,提示乙酰乙酸来源的胞质乙酰CoA生成可能上调。为验证此假设,研究者创建了AACS和ACAT2肝脏特异性敲除小鼠,并追踪了[U13C]-乙酰乙酸在DNL中的利用。进一步证实了AACS在乙酰乙酸生成DNL中的特异性作用。
在高生理极化状态下,研究者假设酮体来源的DNL可能不依赖柠檬酸-丙酮酸循环(CiC)。通过对CiC敲除小鼠进行高脂饮食喂养及13C-乙酰乙酸追踪实验,发现外源性及亮氨酸生成的酮体通过AACS途径为肝脏DNL提供底物,且破坏线粒体柠檬酸转运能上调酮体喂养的DNL。
线粒体-细胞质DNL网络结构
研究结论
本研究通过广泛的13C示踪代谢流技术和肝脏特异性基因敲除技术,研究了肝脏新生脂肪生成(DNL)中乙酰辅酶A的来源途径和贡献比重。结果表明:
1. 线粒体丙酮酸载体(MPC)和ATP-柠檬酸裂解酶(ACLY)是肝脏生成乙酰辅酶A的重要调控者;乙酰辅酶合成酶2(ACSS2)与之并行工作。
2. 此外,还存在一条酮体来源的互补途径,当TCA循环受阻时,乙酰乙酸来源的乙酰辅酶A水平上升,维持DNL。
参考文献
A hierarchical hepatic de novo lipogenesis substrate supply network utilizing pyruvate, acetate, and ketones. Cell Metab. 2024.
请扫描二维码阅读原文
绘谱帮你测
麦特绘谱提供全面的代谢流检测服务,可追踪含13C和15N等被标记物100+种,全面覆盖糖酵解和TCA循环通路、磷酸戊糖途径、 氨基酸代谢、脂肪酸代谢、 一碳代谢、 核苷酸代谢通路等。丰富的个性化标记定制经验–[U-13C6]-Fructose,[U-13C16]-Palmitate, [U-13C3]-Serine,[U-13C2]-Glycine, [U-13C3]-Alanine, [U-13C3]-Pyruvate, [U-13C4]Malic Acid, [U-13C18]-Oleic Acid, 13CO2, 15N-NH4CL, [1, 2-13C2]-Glucose, [2,3,3-D3]-Serine, [2,3-13C2]Alanine, [1,2,3-13C3]-Choline等。历经数年项目积累,检测各类贴壁细胞、悬浮细胞、菌体、培养液、线粒体、组织、粪便等样本类型,涵盖多发性骨髓瘤、肝癌、线粒体遗传代谢病、免疫细胞活性与疾病、心血管疾病等多个研究方向,合作项目成果突出,文章平均IF>10+。