文献解读
Nature | 翻译组重塑新视角:生酮饮食下的脂肪酸信号通路与肿瘤抑制
禁食(Fasting)作为一种历史悠久的饮食干预方法,被证实可通过酮体生成促进健康,但其基因表达调控机制在蛋白质层面尚未清晰;在这一过程中,P-eIF4E(磷酸化真核翻译起始因子4E)作为关键的翻译因子,在禁食期间选择性调控mRNA翻译,影响酮体代谢,探究其调节机制对于酮体代谢相关疾病治疗具有重要意义。
2024年8月,加州大学旧金山分校Davide Ruggero团队在Nature上发表题为“Remodelling of the translatome controls diet and its impact on tumorigenesis”的研究论文,揭示了禁食期间肝细胞翻译组重塑的分子机制,发现了脂肪酸通过AMPK-MNK-eIF4E信号通路调控生酮作用的新途径,为癌症治疗提供了新的思路和方法。
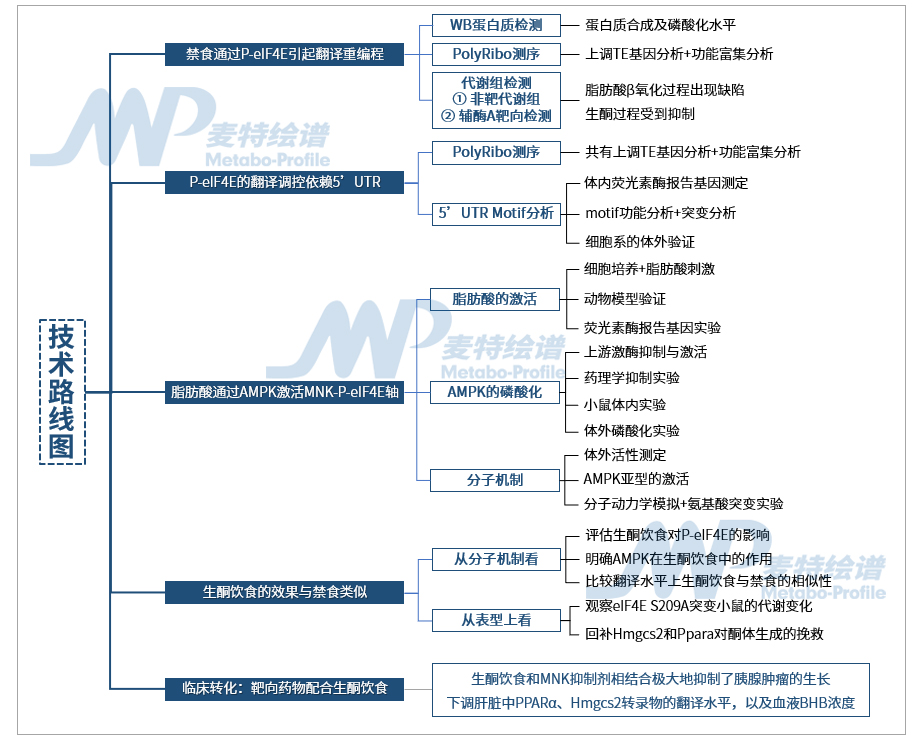
技术路线图
研究结果
1. 禁食可通过P-eIF4E在翻译水平上控制生酮
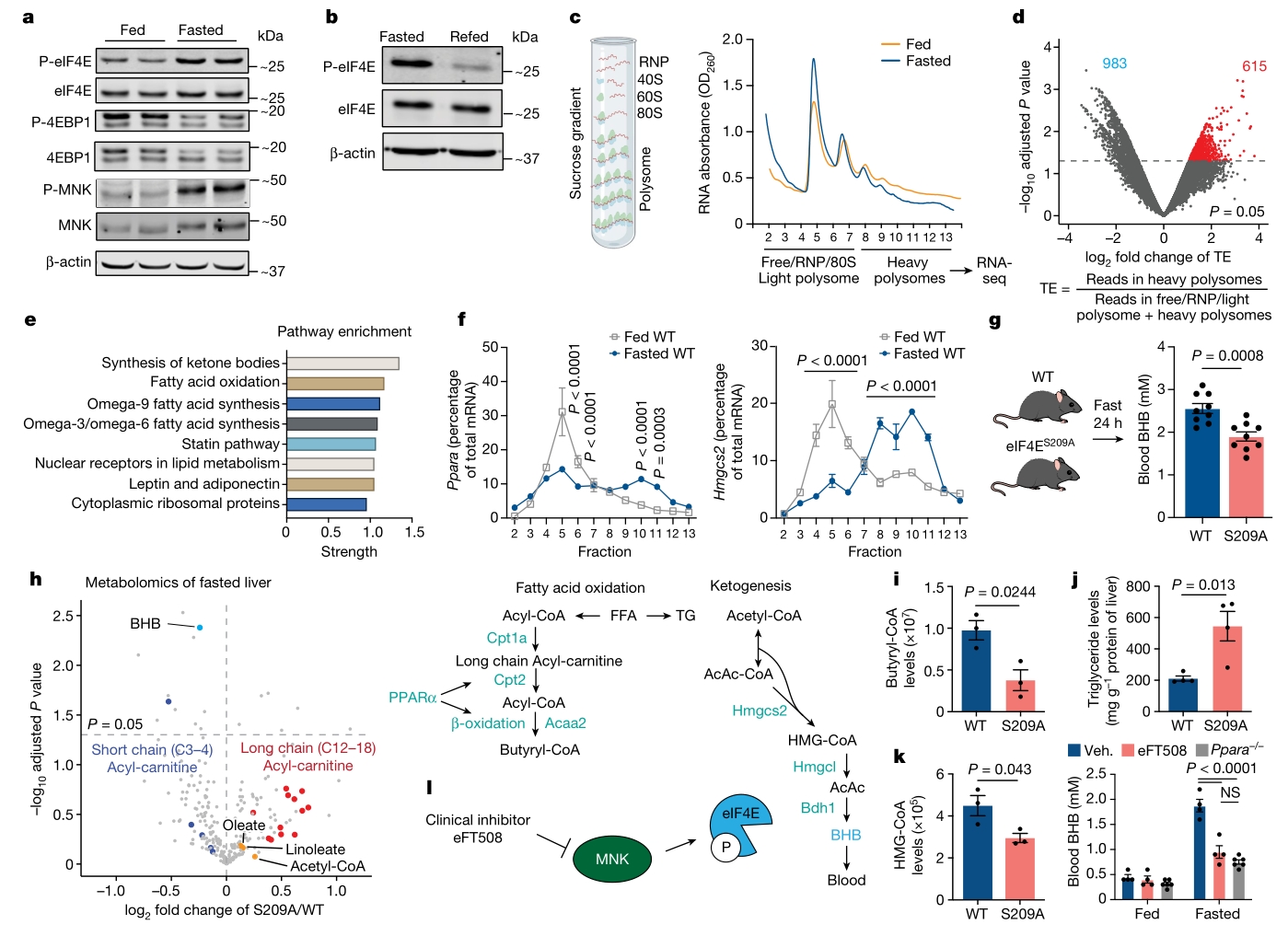
首先对野生WT对照组/禁食组小鼠肝脏进行WB检测,发现在禁食条件下,mTOR下调表达从而造成全局蛋白质合成受到抑制,但P-eIF4E的活性却在禁食24小时后显著增加,进一步发现MNK的磷酸化水平在禁食期间也增加,并参与了P-eIF4E的磷酸化。
接下来,为了探究肝脏在禁食期间是否发生翻译重编程,对禁食和WT小鼠的肝脏裂解物进行了翻译组测序(PolyRibo-seq)。通过计算mRNA的相对翻译效率(TE),发现有615个转录物的TE在禁食时显著上调,富集分析显示这些基因主要参与脂质代谢,其中包含酮体产生。特别发现,生酮限速酶Hmgcs2、脂质代谢及生酮主要调节因子PPARα的mRNA翻译显著上调,该结果表明,禁食期间肝脏脂质代谢和酮体产生相关基因在翻译水平上调。
随后,为探讨P-eIF4E在禁食诱导的生酮过程中的作用,对MNK无法磷酸化的eIF4ES209A小鼠模型的肝脏和血浆组织进行检测。结果表明,禁食24h后,eIF4ES209A小鼠产生的β-羟基丁酸(BHB)显著少于WT小鼠,而血糖和胰岛素浓度与WT小鼠相当;进一步的代谢组学分析显示,在禁食的eIF4ES209A小鼠肝脏中,BHB是第二位的显著下调的代谢物,同时长链酰基肉碱积累,而短链酰基肉碱耗竭,这表明脂肪酸β氧化过程出现了缺陷。从关键代谢物来看,脂肪酸β氧化产物:丁酰CoA显著下调,Hmgcs2的产物HMGCoA同样显著减少,而其前体乙酰CoA则保持不变,这表明Hmgcs2的活性受到抑制。这些结果表明,禁食期间P-eIF4E的缺失对肝脏中的脂肪酸β氧化和生酮过程有抑制作用。
图1. 禁食可通过P-eIF4E在翻译水平上控制生酮
2. P-eIF4E通过靶基因的5′UTR motif序列进行翻译调控
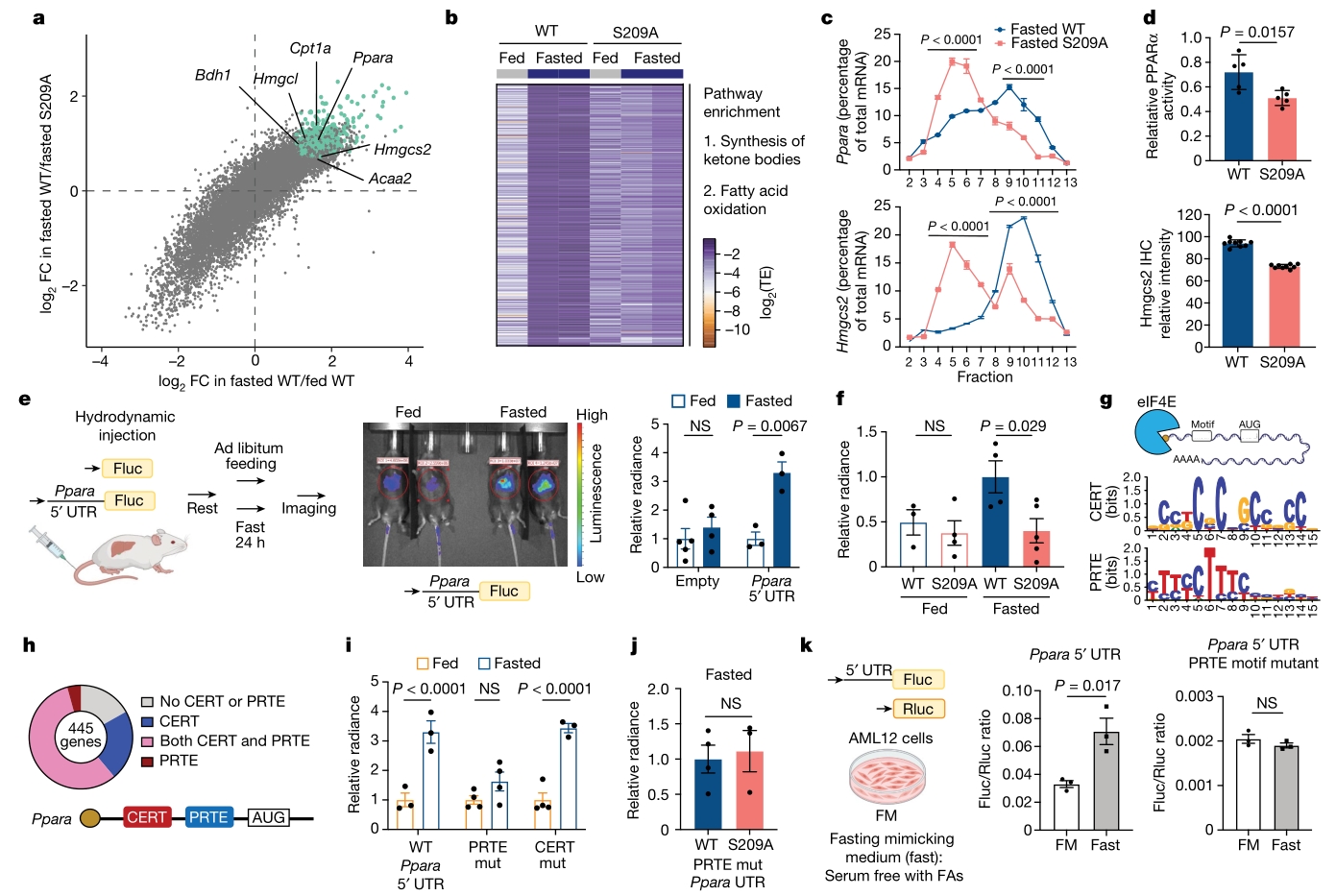
对eIF4ES209A小鼠肝脏进行PolyRibo测序,发现在WT小鼠禁食时上调的615个基因中,有445个基因在eIF4ES209A小鼠禁食的肝脏中显著下调。这些基因包括Ppara和Hmgcs2;进一步对这445个基因做功能富集分析发现,它们主要参与了酮体生物合成、脂肪酸β氧化和生酮等代谢途径。这表明P-eIF4E在调控这些代谢途径的基因翻译中起着重要作用,蛋白活性测定和免疫组化染色也证实了这一结论。
先前的研究表明,mRNA的5′UTR可能包含不同的基序(motif),赋予mRNA对eIF4E翻译调节的选择性。利用体内荧光素酶报告基因测定,发现Ppara 5′UTR在WT小鼠禁食时增强翻译,而eIF4ES209A突变鼠无此效应,证实其对P-eIF4E依赖的翻译敏感性。PolyRibo-seq及突变实验揭示PRTE motif为关键顺式元件,响应P-eIF4E变化调控翻译。体外模拟禁食条件的小鼠肝细胞系验证上述发现,表明PRTE motif与P-eIF4E互作,在禁食期间介导mRNA选择性翻译。
图2. P-eIF4E是通过5′UTR上的PRTE motif进行禁食诱导翻译所需的
3. 脂肪酸通过增强AMPK活性,激活MNK-P-eIF4E轴
在禁食过程中,血浆中游离脂肪酸的增加是一个关键特征,这些脂肪酸不仅作为能量来源,还被证明能够作为信号分子发挥作用。在无血清和脂肪的培养基中,利用多种脂肪酸刺激AML 12细胞与小鼠原代肝细胞发现均可激活MNK-P-eIF4E轴,其中亚油酸效应最为显著。深入研究显示,亚油酸显著提升AML 12细胞Ppara与Hmgcs2 mRNA翻译水平,小鼠体内实验亦佐证此发现。荧光素酶报告基因实验进一步确认,脂肪酸处理诱导AML 12细胞Ppara 5′UTR依赖性基因表达,彰显了脂肪酸对翻译特异性的精密调控。以上结果表明,在禁食期间,脂肪酸发出信号激活MNK-P-eIF4E轴,进而调控肝脏中生酮转录物的下游翻译控制。
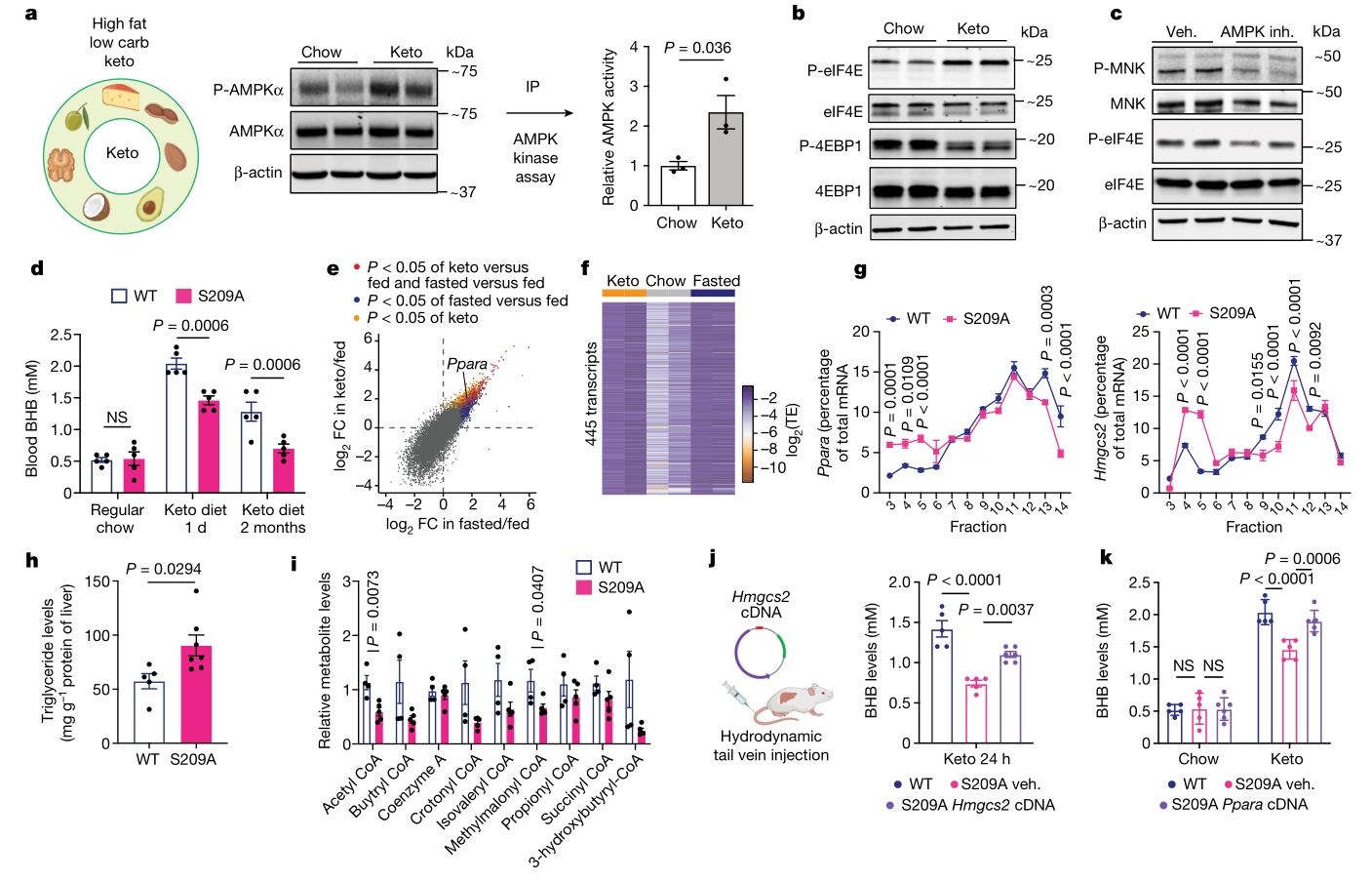
为探究MNK-P-eIF4E轴对脂肪酸刺激的响应,筛选了上游激酶。AMPK抑制下调P-eIF4E,阻断脂肪酸诱导的PPARα和Hmgcs2翻译。禁食WT小鼠中AMPK激活,而mTOR等磷酸化下调,AMPK抑制减少酮生成。重组蛋白、体外活性测定和质谱分析确认AMPK以剂量依赖的方式直接磷酸化MNK,并发现三个磷酸化位点(Ser 39、168、394),这些位点的突变影响AMPK介导的MNK磷酸化。以上结果表明,AMPK可通过直接磷酸化MNK,并促进随后的ERK磷酸化,最终激活P-eIF4E,从而调控mRNA的特异性翻译。
在脂肪酸激活AMPK的机制方面,通过体外实验发现亚油酸即便无AMP也能激活AMPK,其激活效应随浓度增加。分子模拟显示亚油酸稳定结合AMPKγ1的隐藏口袋,且此结合受AMPKγ1亚基中特定氨基酸的调控。这一发现确认了长链脂肪酸,如亚油酸,直接作为AMPK的激活剂,进一步调控下游的代谢过程,包括MNK-P-eIF4E的磷酸化。
图3. 脂肪酸增强AMPK活性,诱导MNK-P-eIF4E轴
4. 生酮饮食也可起到与禁食相似的效果
随后,探讨了基于高脂肪和低碳水化合物含量的生酮饮食能否通过类似的途径发挥与禁食相似的下游翻译调控。在生酮饮食条件下,WT小鼠肝脏中的AMPK-MNK-P-eIF4E轴被显著激活,导致eIF4E磷酸化水平上升。通过PolyRibo-seq分析,发现生酮饮食与禁食在翻译组重构上存在显著的相似性,特别是在AMPK-MNK-P-eIF4E轴调控的基因表达上。进一步eIF4ES209A突变小鼠在生酮饮食后表现出酮体生成受损及代谢异常,这些异常与禁食状态相似。最后通过外源注射Hmgcs2和Ppara的cDNA,能够部分或完全恢复酮体生成,这进一步强调了eIF4E磷酸化在生酮代谢中的核心调控作用。
综上,生酮饮食通过AMPK-MNK-P-eIF4E轴调控了P-eIF4E的磷酸化,进而影响了下游的翻译活动。
图4. 生酮饮食激活P-eIF4E依赖性翻译以调节生酮
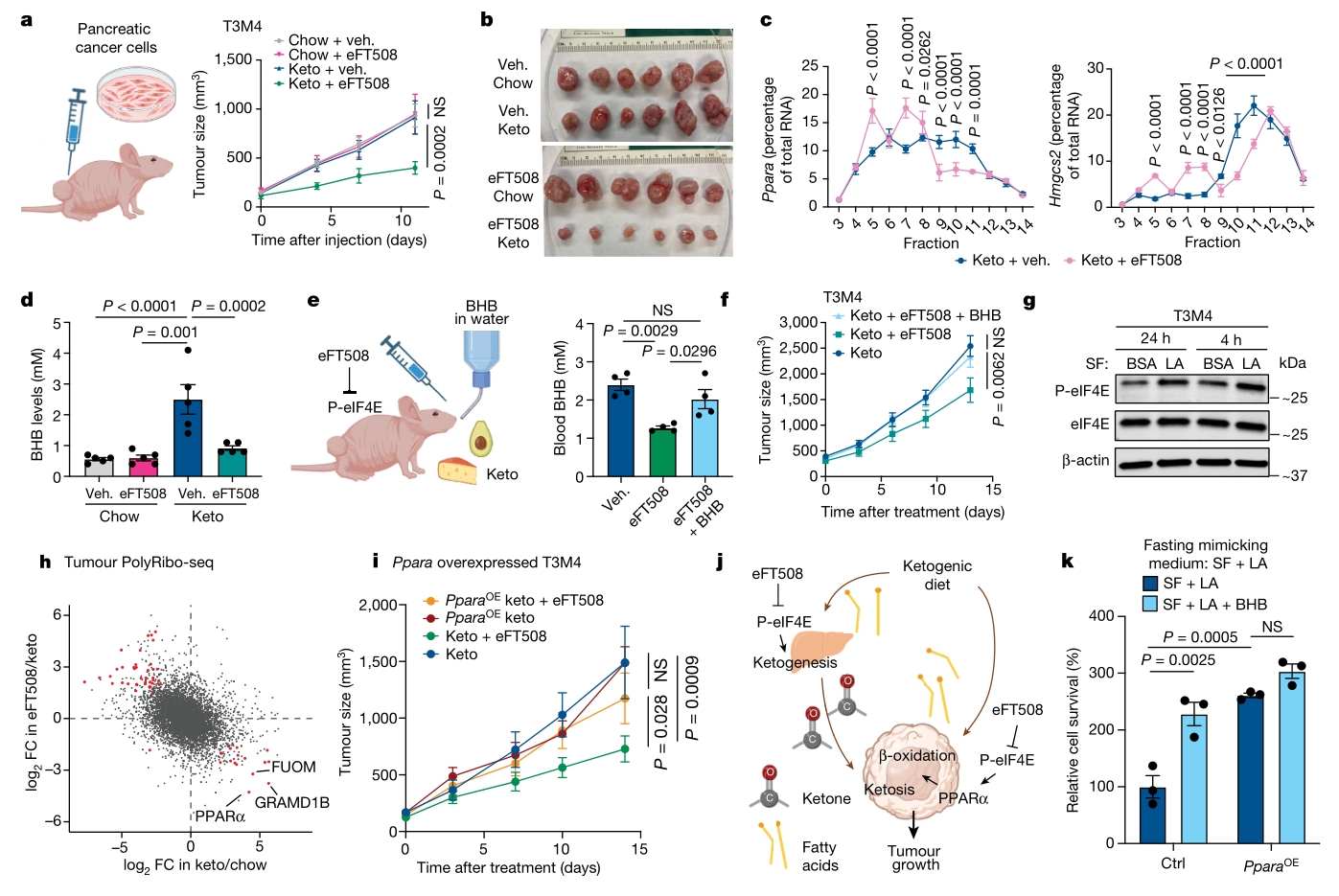
5. 生酮饮食与靶向药物结合可抑制肿瘤生长
最后探讨了生酮饮食、MNK临床抑制剂:eFT508以及酮体(BHB)在胰腺肿瘤生长中的作用机制。生酮饮食与MNK抑制剂eFT508联用显著抑制胰腺肿瘤,eFT508下调Ppara和Hmgcs2翻译,同时生酮饮食降低了血液BHB浓度。PolyRibo-seq示生酮重塑肿瘤翻译组,而eFT508抑制此过程。此外BHB和Ppara促进肿瘤生长,挽救eFT508诱导的细胞死亡,凸显了其在胰腺肿瘤生长中的关键作用。以上结果表明,通过联合使用生酮饮食和eFT508,可以限制胰腺肿瘤细胞中酮的可用性,从而抑制肿瘤生长。
图5. 药理学靶向P-eIF4E与生酮饮食联合限制胰腺肿瘤生长
研究结论
本研究揭示了细胞在禁食或生酮饮食时,通过P-eIF4E和AMPK等分子机制调整翻译控制,以适应能量状态变化。长链脂肪酸作为AMPK的新配体,促进其在无AMP情况下的激活,进而通过MNK–P-eIF4E轴调控特定mRNA的翻译。这种翻译控制不仅影响细胞代谢适应,还为癌症治疗提供了新的思路,如结合生酮饮食和P-eIF4E抑制剂抑制肿瘤生长。
参考文献
Yang H, Zingaro VA, Lincoff J, et al. Remodelling of the translatome controls diet and its impact on tumorigenesis. Nature. 2024.
请扫描二维码阅读原文
绘谱帮你测
近年来内源性代谢物作为转录翻译调控配体的相关研究日益增加,凸显了代谢物作为转录翻译调控因子的巨大潜力,该领域值得代谢研究者密切关注。麦特绘谱开创性搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章400+篇,累计影响因子4000+,平均IF>10,包括Cell, Nature, Science, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等顶级期刊。