文献解读
贾伟院士团队十年攻坚,破译大脑橡皮擦-“肠道菌-代谢物-脑轴”揭开阿尔茨海默病诊疗密钥
《世界阿尔茨海默病报告》显示,我国阿尔茨海默病(Alzheimer’s disease,AD)患者已超过千万,居世界首位。AD起病隐匿,进行性发展,发病机制尚无定论,临床缺乏有效治疗手段,早期发现对于干预认知障碍进展意义重大。
贾伟教授团队深耕AD代谢研究十余载,作为全球阿尔茨海默病代谢组学联盟(Alzheimer Disease Metabolomics Consortium , ADMC)的核心成员,早在2013年,贾伟教授团队就与美国的杜克大学、夏威夷大学、德国的环境健康研究中心等二十余个科研团队合作,基于大规模多中心队列、全球领先的代谢组学和神经影像平台开展AD相关的研究[3-5]。接下来绘谱君邀请您一起鉴读贾伟教授团队十余年AD研究的最新进展,探究如何消除“脑海中的橡皮擦”。
01
Cell Rep Med最新报道
千例队列超多模型探究AD致病机制
2024年5月1日,贾伟教授团队在Cell Reports Medicine上发表了题为:Increased intestinal bile acid absorption contributes to age-related cognitive impairment 的研究论文,建立健康人(n=682)、轻度认知障碍(n=535)、阿尔茨海默病(n=637)临床队列,在老年啮齿动物、细胞和药物治疗大小鼠等水平进一步验证,从而探究衰老相关的认知障碍的致病机制和潜在干预方法[10]。
研究思路图
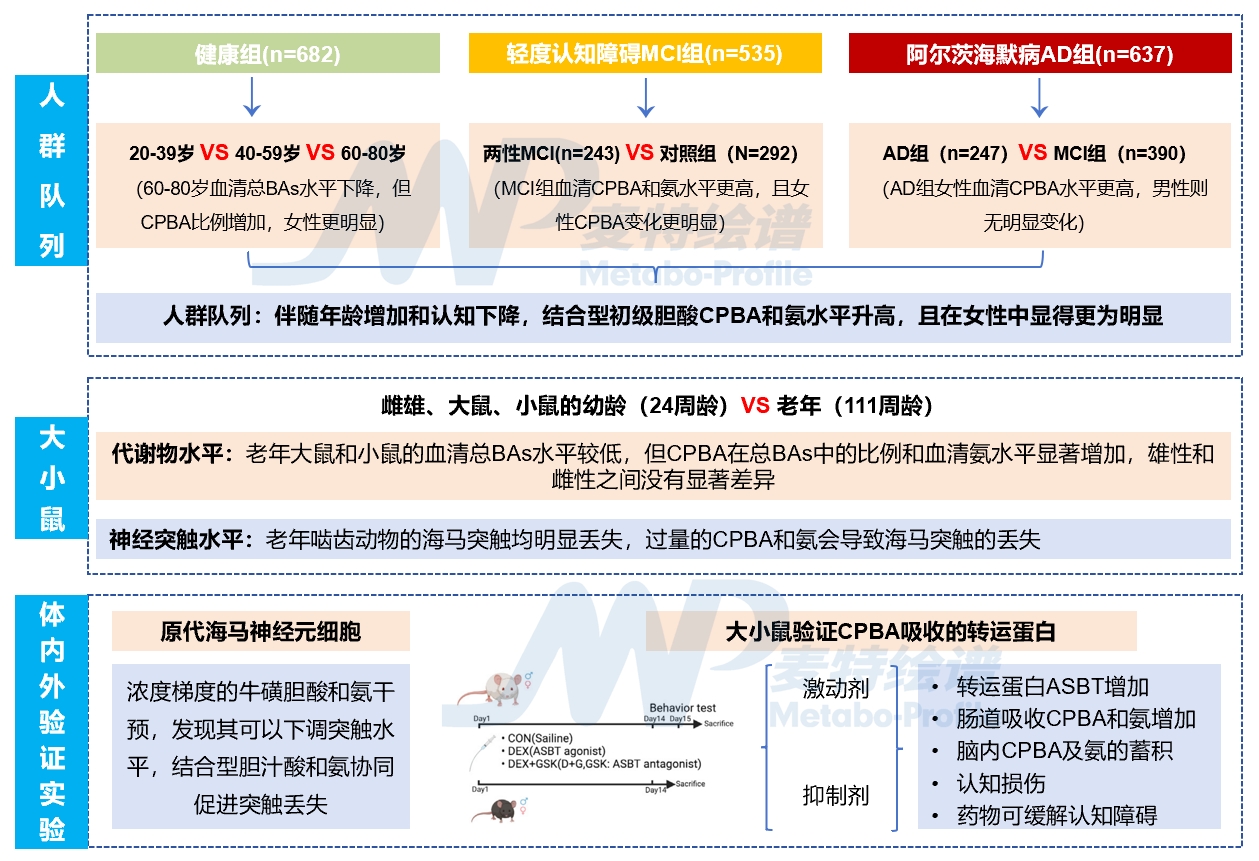
肠道胆汁酸吸收增加会导致与年龄相关的认知障碍
主要结论
基于临床队列、动物模型、原代海马神经细胞等水平,发现肠道对结合型胆汁酸吸收特异性增加,进而促使氨入血增加,是诱导突触丢失的关键,体内外验证实验证明药物抑制肠道胆汁酸的重吸收是缓解衰老相关认知障碍的一种有效策略。
02
Nat Commun最新报道
万例队列机器学习全面评估AD代谢特征
2024年5月7日,贾伟教授团队在Nature Communications上发表了题为:Metabolic phenotyping reveals an emerging role of ammonia abnormality in Alzheimer’s disease的研究论文,对来自不同认知状态的样本(中国人群n=1397;欧美人群n=7685)进行了多中心分层血清代谢组学研究,涵盖认知正常(CN)、主观认知障碍(SCD)、轻度认知障碍(MCI)和阿尔茨海默病(AD)患者,全面评估AD疾病代谢特征[11]。
研究思路图
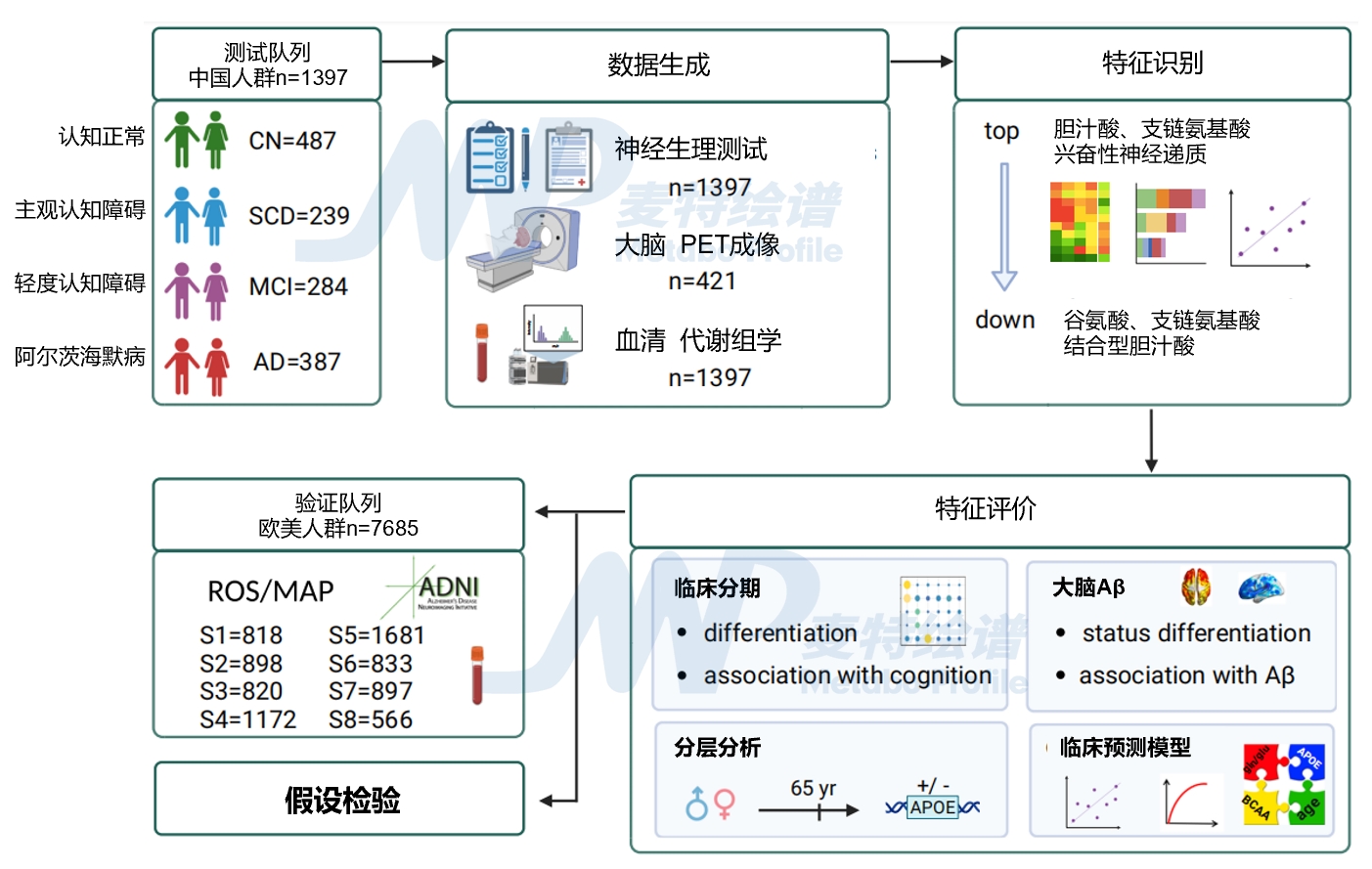
氨紊乱或为阿尔茨海默病潜在新靶点
主要结论
基于近万例队列研究数据建立AD亚型预测机器模型,发现氨在AD不同阶段中具有水平差异(AD>MCI>SCD>CN),与已确认的胆汁酸、谷氨酸和BCAA相关代谢特征具有显著相关性,验证了氨代谢异常在阿尔茨海默病中可能发挥的核心作用和作为AD诊疗新靶点的潜力,助力AD早期诊断。
03
十年一剑,厚积薄发
肠道菌群-代谢物-脑轴:AD诊疗新视野
十年攻坚,贾伟教授研究团队持续聚焦微生物与代谢领域,从多中心、跨地域、大队列、联合全球团队等层面揭示了肠道菌群及代谢紊乱对神经精神类疾病发生发展的重要影响。
过去的研究阐明了结合型胆汁酸与氨水平升高在肝性脑病、衰老相关认知障碍中的关键作用,提出了肠道菌群-胆汁酸-脑轴在AD及认知障碍发生发展中具有重要地位。
近日,团队深入探索AD相关代谢特征,发现氨在AD不同阶段中具有水平差异(AD>MCI>SCD>CN),与已确认的胆汁酸、谷氨酸和BCAA相关代谢特征具有显著相关性,并且基于近万例队列研究数据建立AD亚型预测机器模型,推动了对AD病理机制的探索,为疾病诊疗提供全新视野。
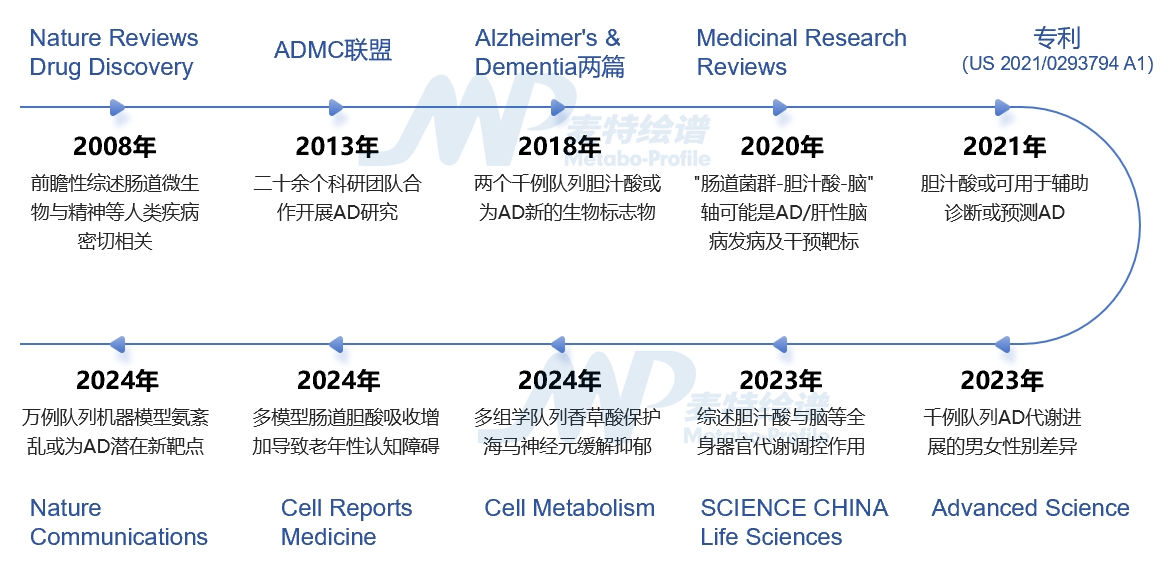
贾伟教授团队十余年AD等精神类疾病研究节点
AD代谢标志物的最初发现
2018年由贾伟教授、杜克大学(美国)等二十余家研究单位在Alzheimer’s & Dementia权威期刊同期发表了两篇前沿性文章,建立两个千例队列(n1=1562,n2=1464),采用靶向代谢组学分析策略,系统阐明了肠道微生物代谢产物胆汁酸与三种AD生物标记物(A/T/N=淀粉样蛋白/tau蛋白/神经退化)之间的关联[3,4]。(点此查看文章解读)
AD/肝性脑病发病及干预靶标
2020年贾伟教授、美国杜克大学脑科学研究院等在国际学术期刊Medicinal Research Reviews对AD与肝性脑病(hepatic encephalopathy)发病中的肠道菌群紊乱、外周与中枢胆汁酸、胆固醇代谢异常等共性机制进行了阐述,提出了”肠道菌群-胆汁酸-脑”关系轴可能是AD/肝性脑病发病及干预靶标的假说[5]。(点此查看文章解读)
AD代谢进展男女有别
2023年贾伟教授团队在Advanced Science期刊再解密AD代谢进展的性别差异,通过千例队列随访,全面刻画男性和女性胆汁酸谱水平随着疾病阶段变化的轨迹,发现男性比女性变化的更早且更显著,证实胆汁酸对预测疾病进展有积极作用[7]。(点此查看文章解读)
全面评估AD代谢特征:诊疗新视野
2024年贾伟教授团队几乎同期在Cell子刊和Nature子刊分别发表两篇AD重磅研究,通过原代海马神经元细胞、大小鼠、万例临床队列等多模型、多中心研究数据集,并建立机器学习模型,全面评估AD代谢特征:再次验证胆汁酸、支链氨基酸和兴奋性神经递质与AD密切相关,并解密AD诊疗新靶点:氨代谢异常在AD中可能发挥核心作用[10,11]。
贾伟教授
● 欧洲科学院生理学与神经科学学部院士
● 上海交通大学医学院附属第六人民医院转化医学中心主任
● 香港大学李嘉诚医学院药理系终身讲席教授
● 麦特绘谱生物科技(上海)有限公司创始人

研究成果在Science, Sci Transl Med,Cancer Cell, Cell Metab, Blood, PNAS, Nat Rev Drug Discov, Nat Rev Gastroenterol Hepatol等顶级学术期刊发表500余篇。总引用率超过40000次 (H index = 95)。2013年一项研究成果被Science杂志入选当年全球十大科技突破,2021年的研究被Cell Metabolism杂志入选胰岛素发现100周年特刊。
2020-2023连续四年荣登爱思唯尔“高被引学者”榜单。
主持美国国立卫生研究院项目、科技部973重大科学研究、科技部国际合作专项等项目。
申请国际国内专利30余项,软件著作权20余项。
发表《医学代谢组学》、《精准医学与代谢组学》等专著6部。
参考文献
1.Gut microbiota: a potential new territory for drug targeting. Nat Rev Drug Discov. 2008
2.阿尔茨海默病代谢组联盟(Alzheimer’s Disease Metabolomics Consortium, ADMC): https://sites.duke.edu/adnimetab/
3.Altered bile acid profile associates with cognitive impairment in Alzheimer’s disease—An emerging role for gut microbiome. Alzheimers Dement. 2018
4.Altered bile acid profile in mild cognitive impairment and Alzheimer’s disease: Relationship to neuroimaging and CSF biomarkers. Alzheimers Dement. 2018
5.Expert insights: The potential role of the gut microbiome-bile acid-brain axis in the development and progression of Alzheimer’s disease and hepatic encephalopathy. Med Res Rev. 2020
6.专利(US 2021/0293794 A1)
7.Serum bile acids improve prediction of Alzheimer’s progression in a sex-dependent manner. Advanced Science. 2023
8.Bile acid signaling in the regulation of whole body metabolic and immunological homeostasis. Sci China Life Sci. 2023
9.Gut bacteria-driven homovanillic acid alleviates depression by modulating synaptic integrity, Cell Metabolism. 2024
10.Increased intestinal bile acid absorption contributes to age-related cognitive impairment. Cell Reports Medicine. 2024
11.Metabolic phenotyping reveals an emerging role of ammonia abnormality in Alzheimer’s disease. Nature Communications. 2024
END


