文献解读
CNS争相报道能延寿50%还能治疗肿瘤的新明星:多胺的前世今生最全梳理!
从细菌、真菌、植物到哺乳动物的生物体衰老过程中伴随着多胺含量的下降,科学家发现短期或终生摄入亚精胺都能让小鼠的寿命被大幅延长,效果最好可达50%!且在脱发问题、肥胖、抗肿瘤免疫、心血管健康、记忆力提升等方面也展现了神奇的作用,相关成果发表于Nature, Cell, Science Advances, Cell Metabolism, Nature Aging, Nature Metabolism, Nature Reviews Cancer等权威期刊。
关于多胺研究的历史起源、生物合成、分解代谢、生理功能、致病机理与研究范例等详细介绍,绘谱君整合了百年研究历史和近期重磅报道,万字长文系统梳理了这类新晋明星小分子代谢物。
建议先收藏,再慢慢看!您还想看哪一类代谢物的系统介绍,请在文末留言。
01
多胺简介
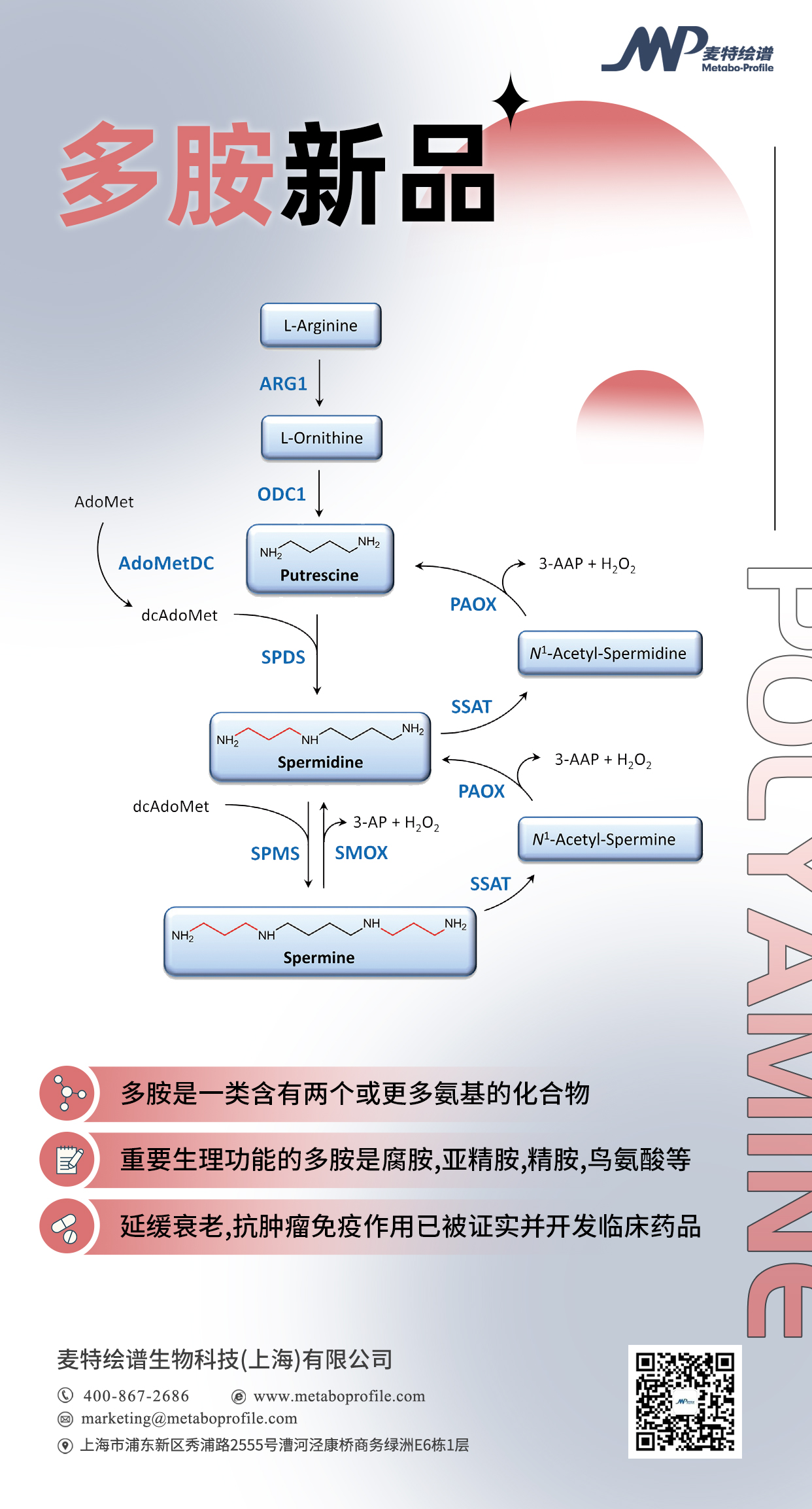
多胺是一类含有两个或更多氨基的化合物,其合成的原料主要为鸟氨酸和精氨酸,关键酶是鸟氨酸脱羧酶和精氨酸脱羧酶,最普遍也是有重要生理功能的多胺是腐胺,亚精胺,精胺等。
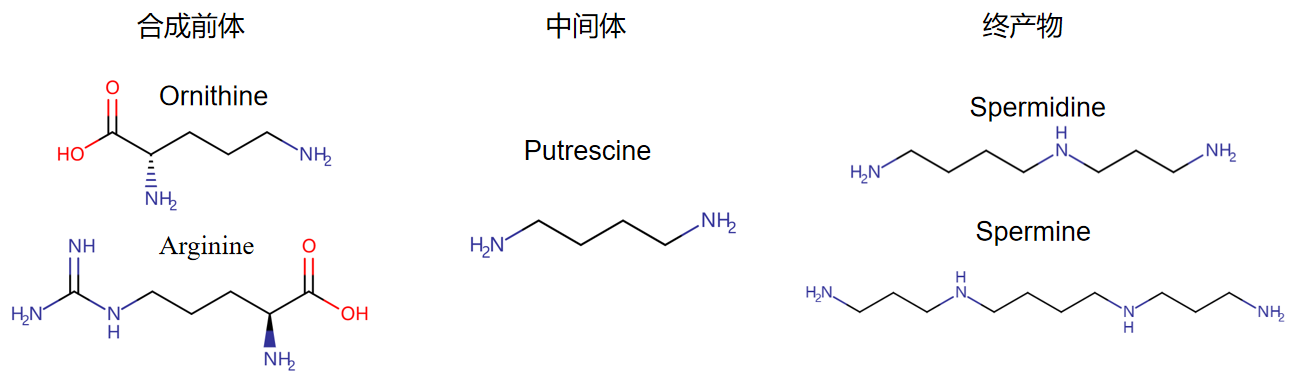
多胺合成前体、中间体和终产物
1.1 多胺研究的历史起源
已知多胺的存在已有近350年的历史。1678年,安东尼·范·列文虎克(Antonie van Leeuwenhoek)用他刚发明的显微镜在自己的精液中鉴定出一种晶体物质。后来,这种物质被命名为精胺。精胺主要负责精液的特征性气味。值得注意的是,多胺的发现是在弗里德里希·米歇尔(Friedrich Miescher)在1869年发现DNA之前200年进行的,但是直到1926年才澄清了精胺的结构特征。随后,精胺的两个前体被确定为亚精胺和腐胺。它们都具有特征性的线性构象和多个氨基,因此被称为多胺[1]。
1.2 动物体内的多胺
动物体内多胺的来源
多胺普遍存在于动植物细胞中,广泛参与生物体内的生理和病理过程[9]。动物体内的多胺有3种来源,分为内源性和外源性来源,其中内源性来源是通过生物合成和相互逆转以及消化分泌物和肠道自身的催化产物,分为肠道微生物合成和细胞合成;外源性来源主要是膳食和人乳,其吸收主要发生在十二指肠和空肠前段[10]。由于多胺是阳离子,能与 DNA、ATP、磷脂、特定种类的蛋白质相互作用[11],因此多胺对细胞代谢、生长和组织更新至关重要,是哺乳动物细胞普遍存在且必不可少的成分[12]。
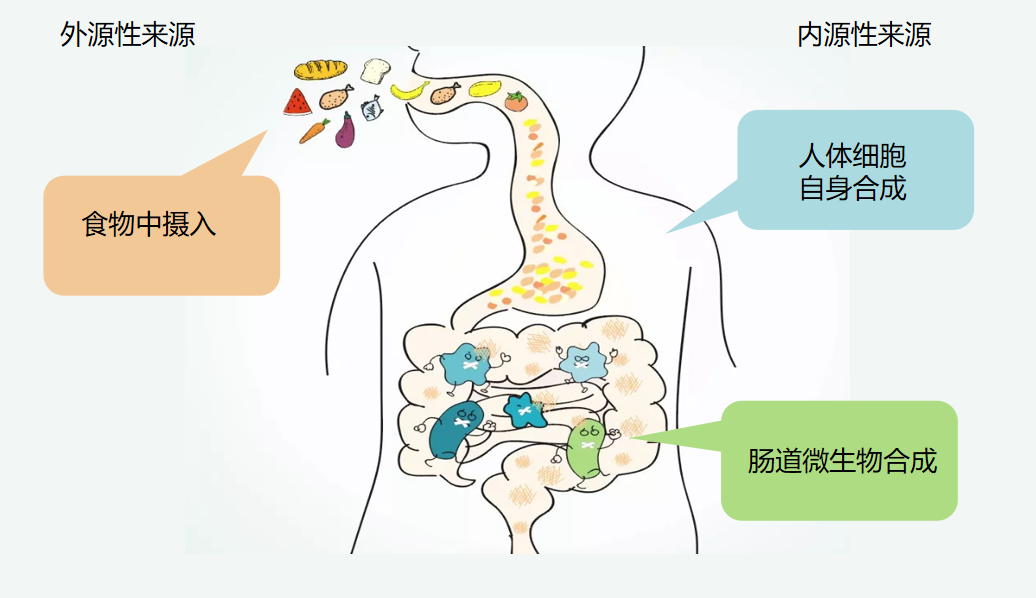
动物体内多胺的3种来源
动物体内多胺的含量
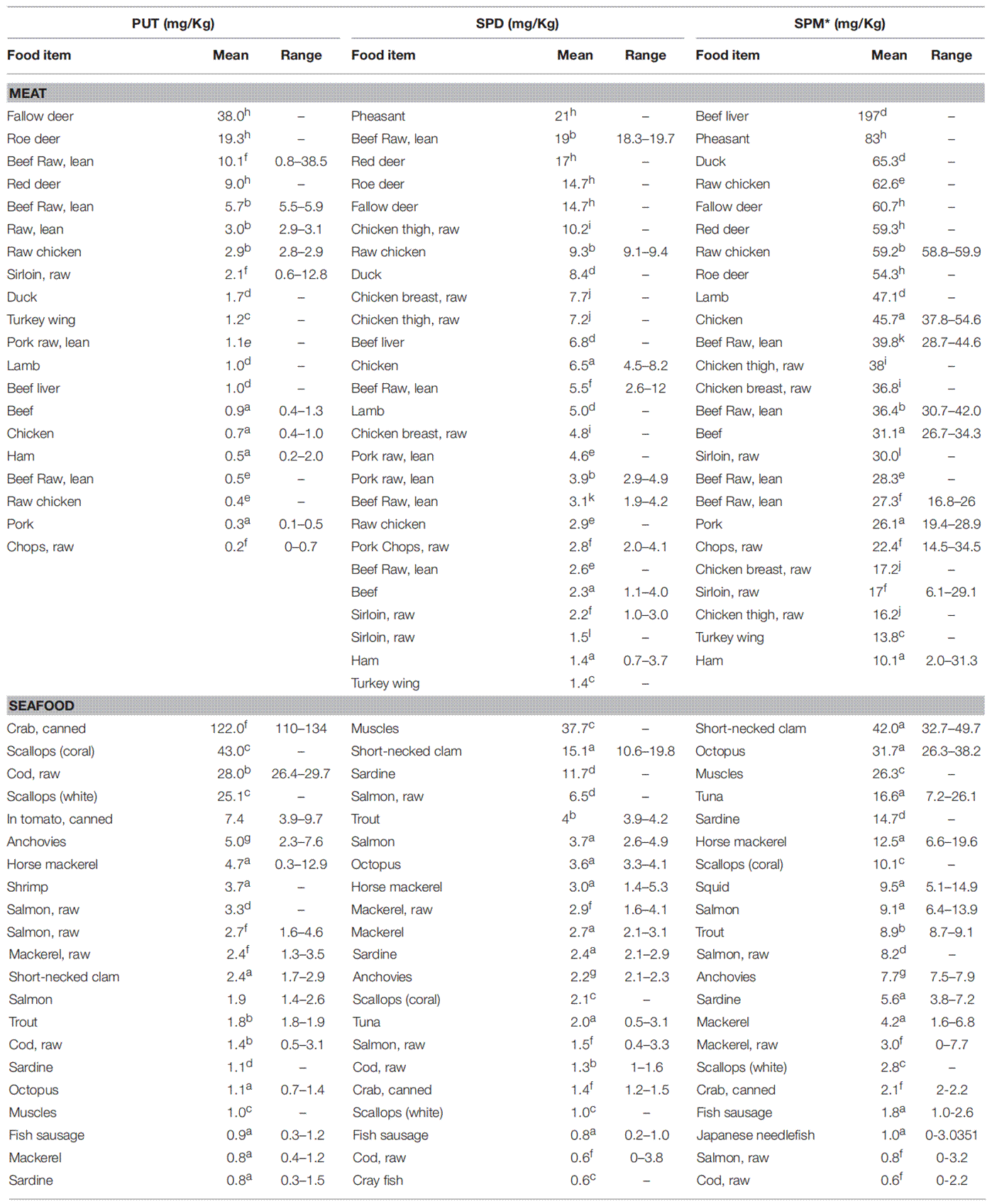
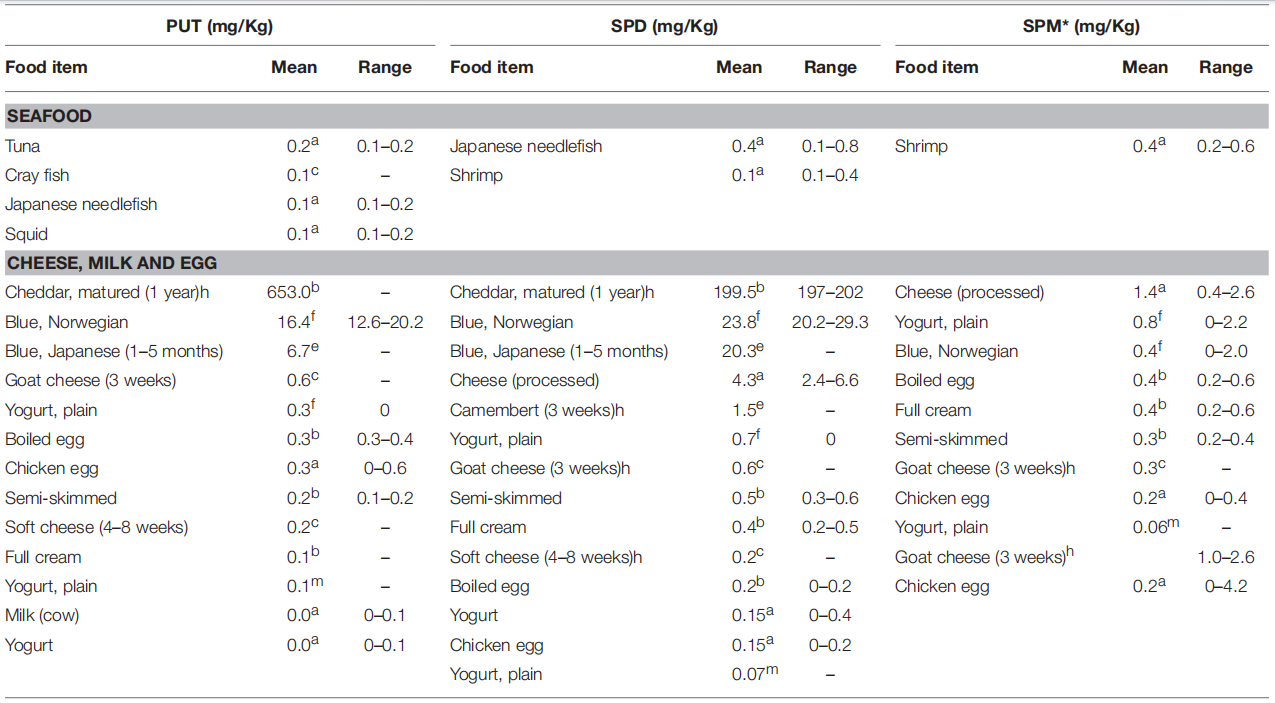
多胺广泛存在于动物和植物来源的食物中,含量较高的食物类别是谷物、豆类与大豆衍生物和动物肝脏[3]。鸡肝、猪肝、牛肝、麦胚、咸鱼子、鸡心、鳗鱼肝等食物中精胺含量超过 500 nmol/g[4]。食品的加工方式和储存条件也显著影响膳食中多胺的含量。Kozová 等[5]研究发现,鸡胸部和大腿在-18℃下储存3个月后,精胺和亚精胺的含量减少,而6个月后则明显增加,且此过程中未检测到腐胺。将鸡胸肉在有氧包装的条件下储存,精胺和亚精胺的含量与屠宰后并无显著差异。对于精胺和亚精胺,与煮沸和炖煮相比,新鲜鸡胸肉的烘烤、烧烤和油炸造成的损失更多,造成此差异原因可能是烧烤、油炸等过程温度更高,更容易破坏精胺和亚精胺[6]。
肉类、海鲜、乳制品和其他动物性饮食中的多胺含量[33]
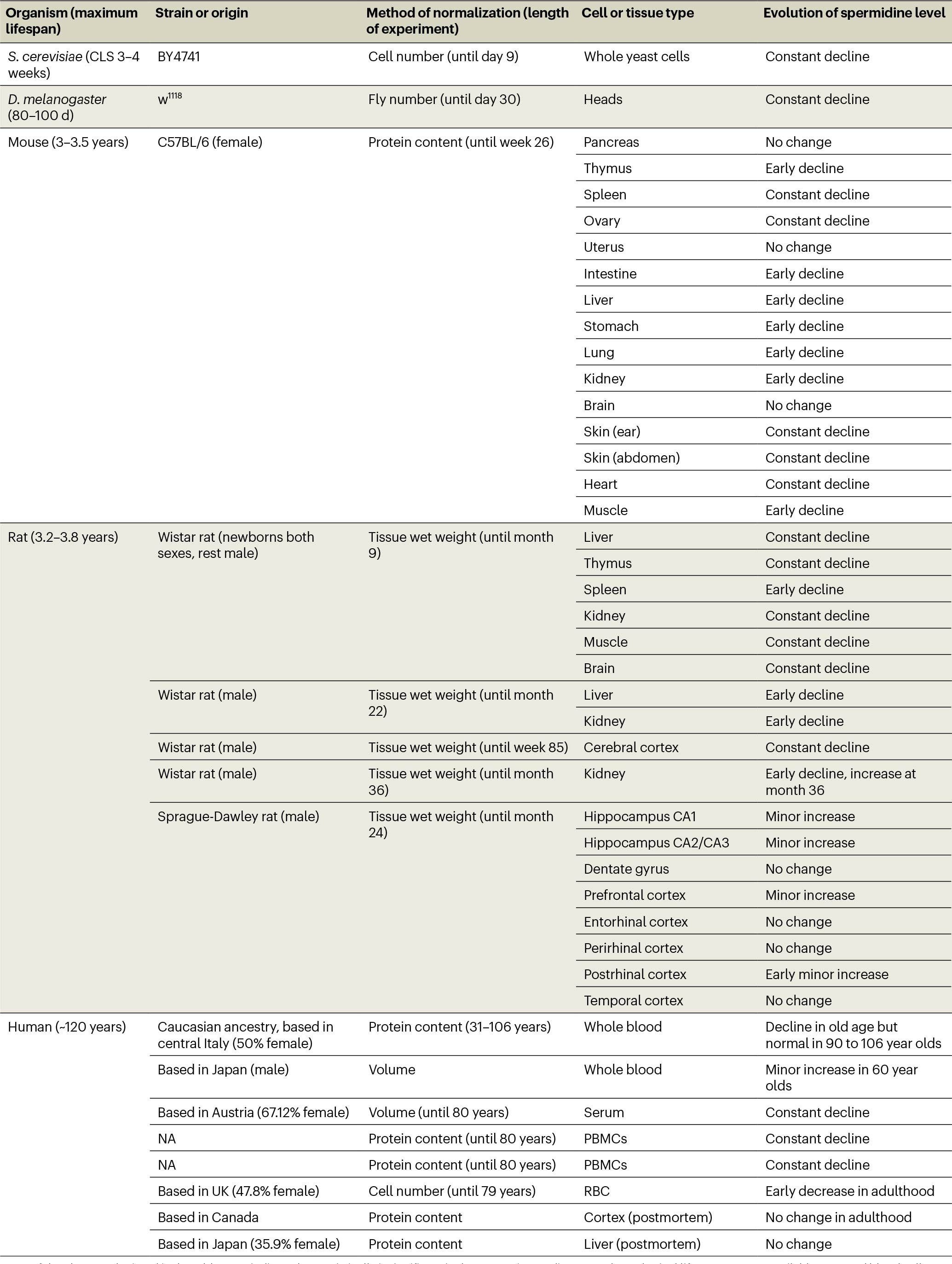
动物体衰老过程中多胺含量的变化
多胺普遍存在于动植物细胞中,广泛参与生物体内的生理和病理过程[9]。多胺水平以复杂的年龄依赖、组织和细胞类型特异性方式下降,但在健康的九十岁和百岁老人中仍能维持[8]。多胺的动态平衡是一个严格调控的过程,这一过程是由多胺的生物合成、分解代谢和运输之间共同调控的[13]。
各种组织和生物体在衰老过程中亚精胺水平的变化[56]
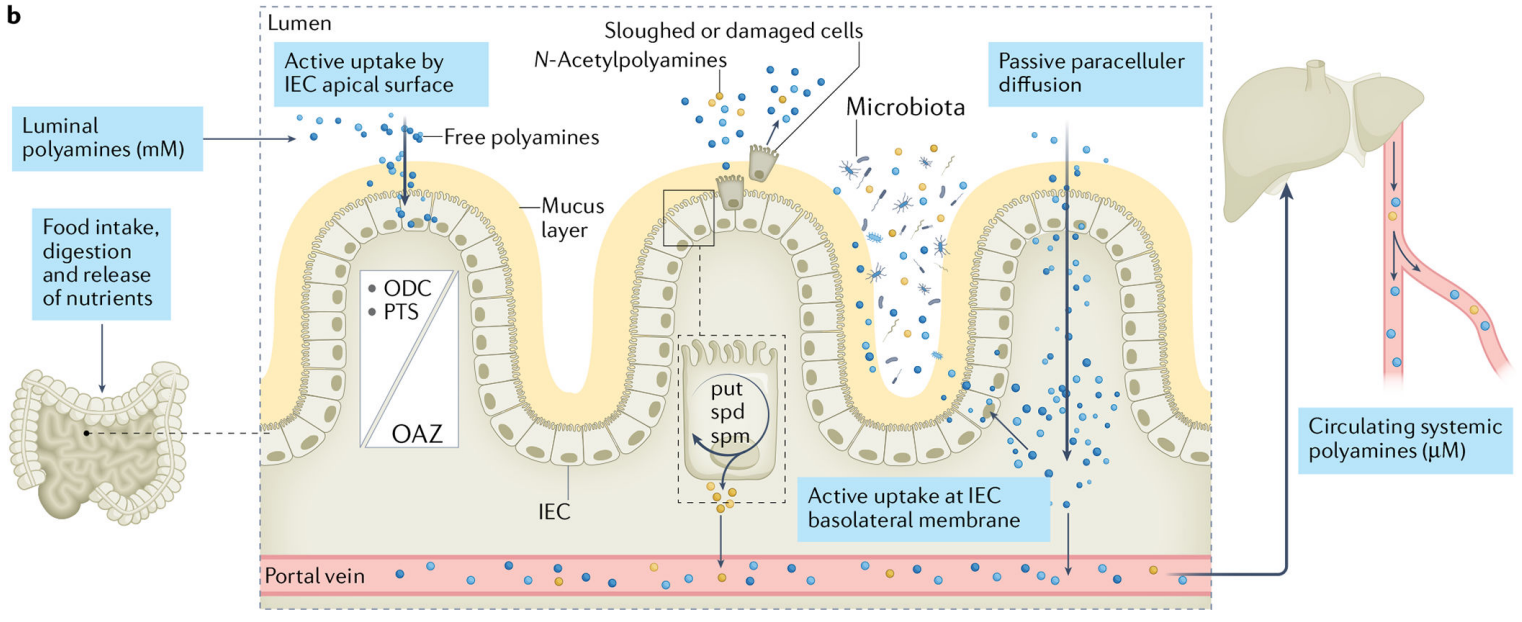
动物体内多胺的运输
多胺代谢失调会影响肿瘤微环境中不同类型细胞的招募和功能,特别是免疫细胞。多胺可通过APAO和SMOX氧化酶分解代谢产生有毒的ROS,因此必须对多胺代谢进行精细调节,这不仅是为了平衡多胺的含量,而且也是为了防止细胞氧化应激和损伤[14]。
高水平的多胺池是通过增加生物合成、增加运输和减少分解代谢来维持的,许多癌基因(MYC、JUN、FOS、KRAS和BRAF)参与了这一过程。多胺在细胞外环境的也很丰富,特别是在胃肠道中,其管腔中的多胺来源于饮食、微生物区系和脱落或受损的细胞。大多数腔内多胺通过小肠近端被动地扩散到循环中,还有一些被主动运输到肠上皮细胞(IECS)。在IECS中,多胺可通过多胺代谢酶相互转化或以乙酰化多胺的形式分泌出胞外进入循环的多胺及其代谢物可被全身细胞利用,从而影响远处部位的肿瘤微环境[13]。
由于其阳离子性质,多胺需要跨膜转运。溶质载体家族(SLC)、有机阳离子转运体(OCT)和阳离子氨基酸转运体(CAT)是决定多胺通量的主要载体。供给多胺分泌和细胞中多胺的囊泡储存和随后的胞吐,细胞外多胺的吸收[14]。
多胺的体内运输
1.3 多胺与体内许多其他化合物的关系
糖酵解、戊糖磷酸途径 (PPP)、三羧酸循环和脂肪酸氧化 (FAO) 作为核心的代谢途径,能将环境中的营养物质转化成碳源及化学能,这些中心碳代谢还能与各种特殊代谢途径相互联系,包括多胺生物合成[15]。
吲哚胺2,3-双加氧酶1(IDO1)将L-色氨酸Trp转化为犬尿氨酸Kyn,并通过激活芳香烃受体AhR进而增加了多胺SPD的产生,多胺和犬尿氨酸是免疫调节回路的参与者,对自身免疫性疾病和癌症的免疫治疗具有潜在影响[14]。
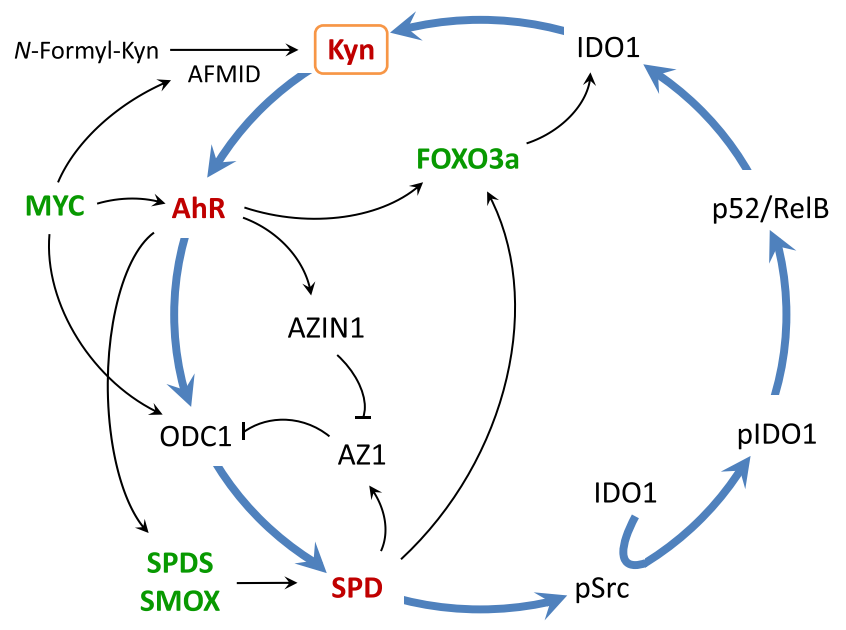
犬尿氨酸-多胺-芳香烃受体回路
多胺及其生物合成前体结合胆汁酸增加了微生物修饰型胆汁酸的多样性,这些多胺胆汁酰胺在食肉动物中普遍存在,在人类中也存在,而人类体内多胺胆汁酰胺的水平会随着其饮食类型从地中海转变为美国饮食而改变,揭示了胆汁酸修饰的巨大多样性,强调了胆汁酸在健康和疾病中作用的研究潜力[16]。
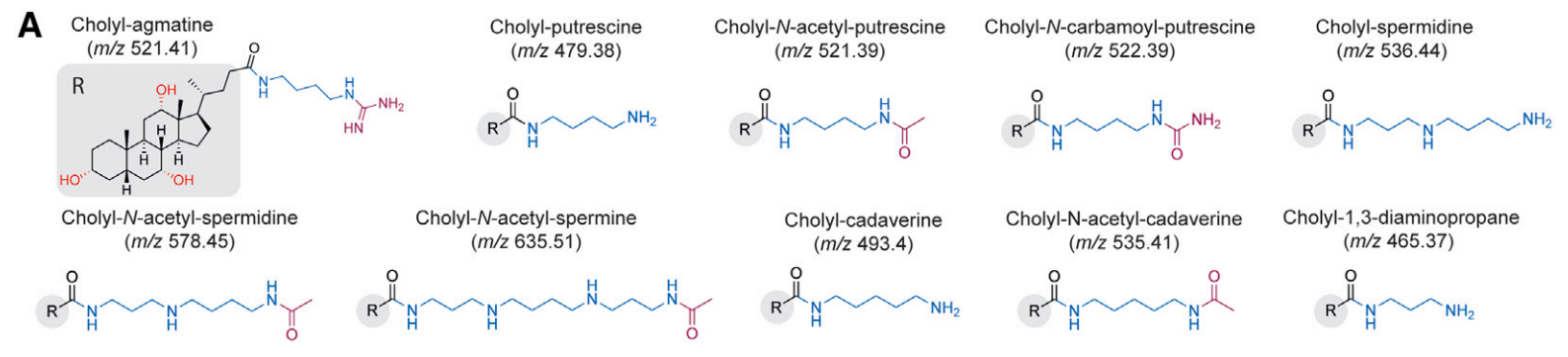
多胺修饰型胆汁酸
02
多胺的生物合成、分解代谢和生理功能
2.1 为什么需要多胺
临床前研究表明,补充亚精胺或可延长寿命,或有改善心血管健康、神经保护、免疫调节、增强自噬和毛囊功能、抗癌、抗衰老等作用[8]。
长期以来,多胺代谢与癌基因有直接联系,所以多胺代谢一直是癌症治疗药物的潜在靶点,目前已有广泛报道多胺调节剂对肿瘤细胞的作用。多胺参与各种细胞过程,包括染色质组织、基因调控、细胞增殖和分化、细胞死亡和免疫系统功能[13]。
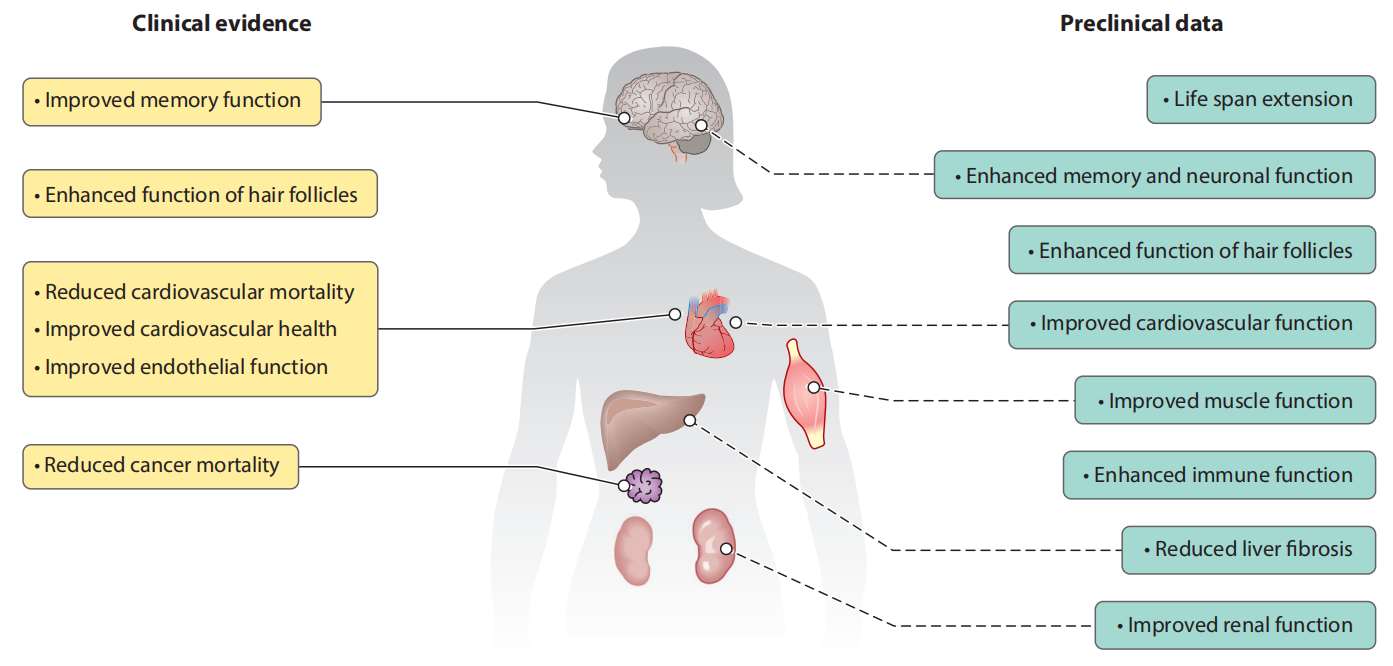
膳食多胺的临床相关研究
2.2 多胺的生物合成
精氨酸是多胺生物合成的主要的碳供体[14]
多胺生物合成的第一步-鸟氨酸(Orn,精氨酸(Arg)由精氨酸酶1(ARG1)代谢生成)脱羧生成。限速酶鸟氨酸脱羧酶1(ODC1)催化Orn转化为腐胺,ODC1是一种依赖磷酸吡哆醛(PLP)限速酶,其表达是在响应多种刺激(如激素、癌基因、生长因子和多胺本身)的反应中被诱导。ODC1活性受转录、翻译和翻译后水平控制,实际上,ODC1受到泛素非依赖蛋白酶体降解机制的影响,该机制涉及到抗酶1(AZ1)和ODC抗酶抑制剂(AZIN1)蛋白。多胺生物合成的下一步是由亚精胺合酶(SPDS)催化,产生亚精胺,再由精胺合酶(SPMS)转化为精胺。
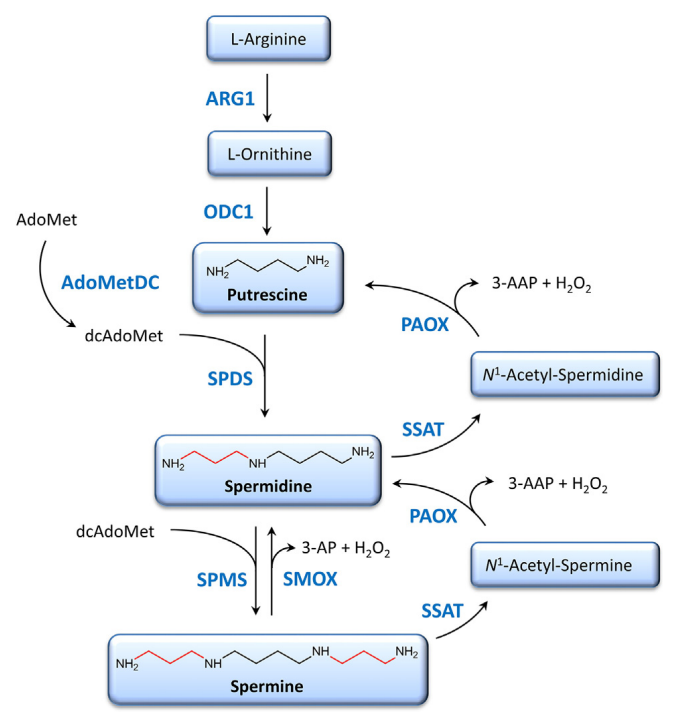
多胺的从头合成
谷氨酰胺是多胺生物合成的次要碳供体
作者采用13C分别标记的最有可能成为多胺来源的精氨酸、谷氨酰胺、脯氨酸,发现精氨酸是多胺的主要的碳供体,谷氨酰胺是支持T细胞多胺生物合成的次要碳供体。继而在采用条件性培养的T细胞中,研究者们发现T细胞激活中一个连接精氨酸分解代谢和多胺从头生物合成的代谢轴在调节细胞功能方面发挥的重要作用[17]。
谷氨酰胺在胰腺导管腺癌中作为主要的碳供体产生多胺,15N谷氨酰胺同位素示踪及代谢组学技术揭示胰腺癌细胞通过鸟氨酸转氨酶(OAT)促进多胺合成进而促进肿瘤生长的重要机制,使用OAT抑制剂可有效抑制胰腺癌细胞增殖[47]。
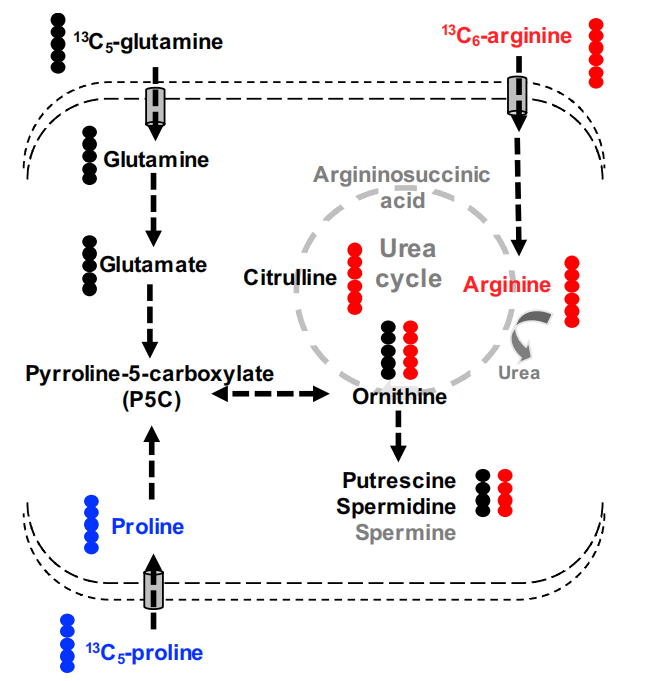
多胺合成的替代途径
细菌中多胺合成的新途径[18]
亚精胺作为最广泛分布的三胺,存在于所有真核生物、古菌以及大多数细菌中,被认为是生命始祖中存在的原始代谢物之一。作者利用动态代谢组学、稳定同位素示踪以及遗传和生化表征,揭示了一条新的亚精胺合成途径——CAPA途径,首先,胍丁胺和天冬氨酸半醛通过还原缩合生成一种此前未知的多胺,羧氨丙基胍丁胺(CAPA),该反应由NADPH依赖的CAPA脱氢酶催化;随后,CAPA脱羧酶催化CAPA发生脱羧反应生成氨丙基胍丁胺(APA);最后,APA经尿素水解酶催化水解产生亚精胺。该途径广泛分布于变形菌、厚壁菌和拟杆菌等多种细菌中。
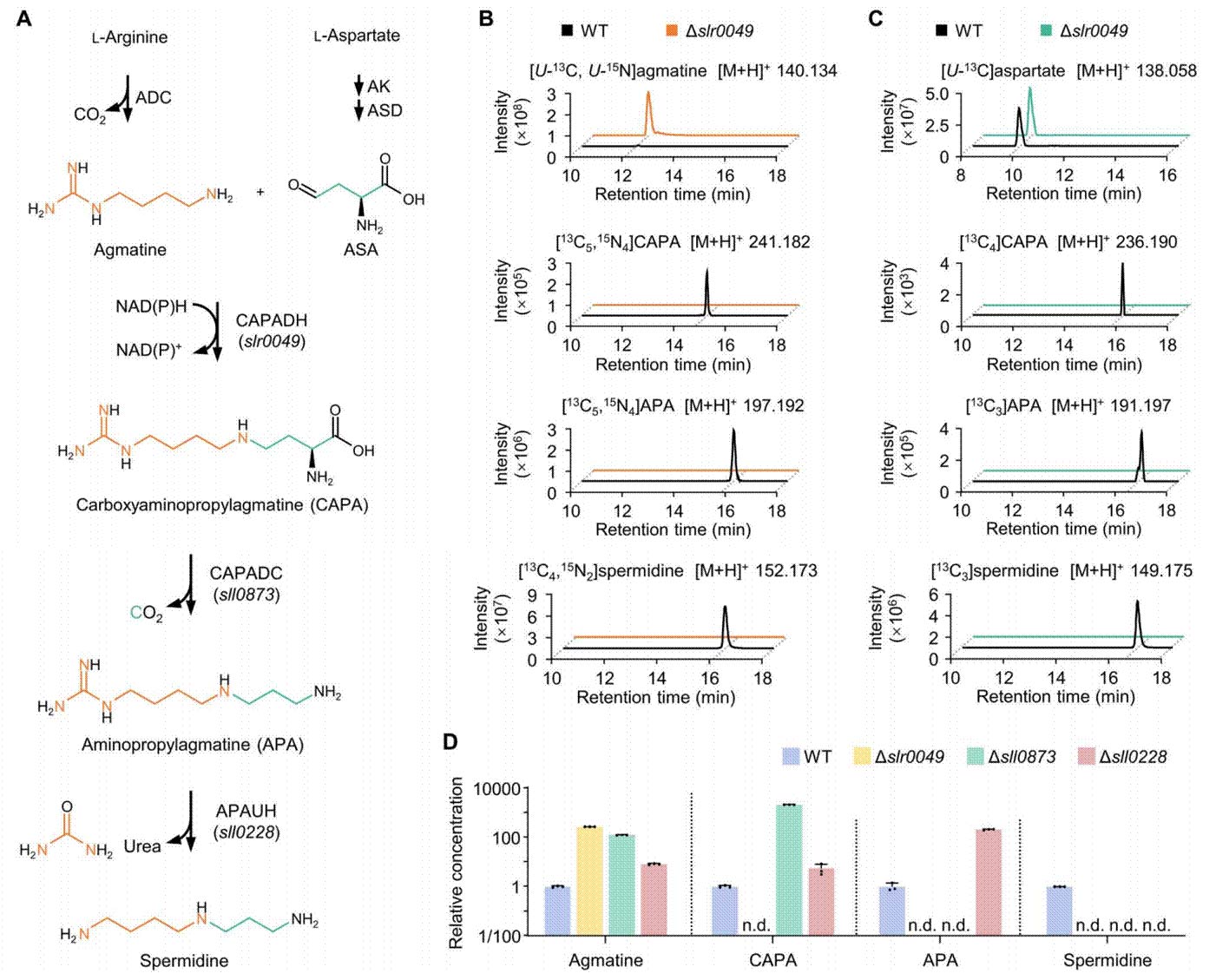
细菌中亚精胺生物合成途径的鉴定
2.3 多胺的分解代谢
在过去几十年里,多胺的分解代谢(包括高级多胺反转化为腐胺)变得越来越重要,因为它极大地影响细胞内每种多胺的总量。精胺和亚精胺通过两个连续反应分别循环回到亚精胺或腐胺的生产,即亚精胺/精胺N-1-乙酰转移酶(SSAT)催化的乙酰化反应和乙酰多胺氧化酶(APAO)介导的氧化反应[14]。多胺的这种相互转化是一个循环过程,根据其在体内的需要和功能控制其周转并调节细胞内稳态。
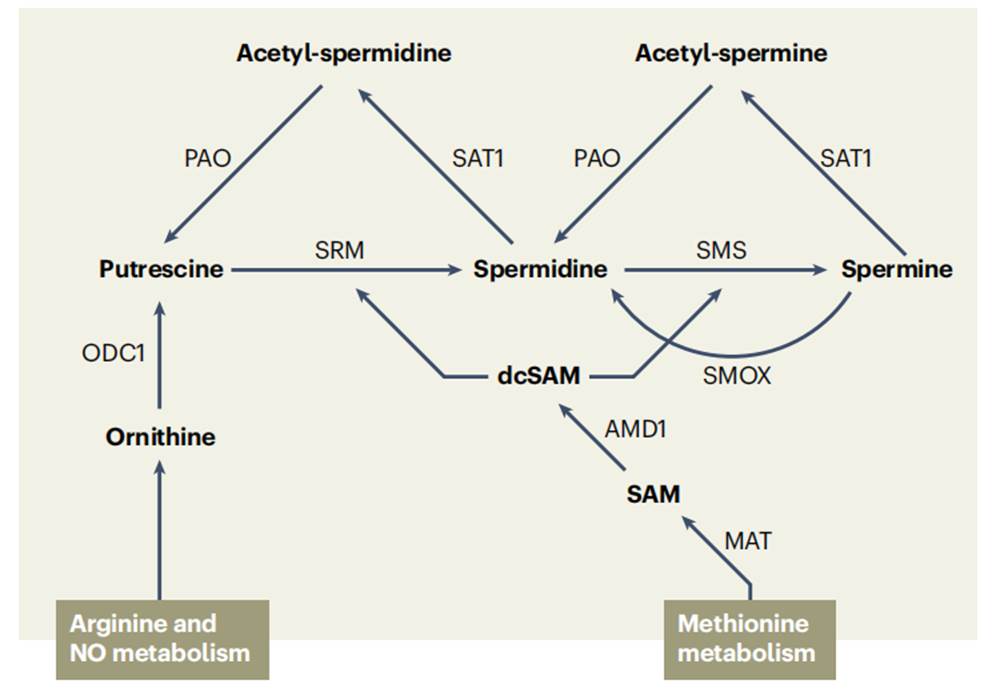
多胺的相互转化[56]
2.4 多胺的生理功能
在细胞中,多胺在细胞质、细胞核和细胞的动力室线粒体中具有多种功能。多胺在细胞生长和增殖、DNA稳定、RNA转录、蛋白质合成、免疫反应的调节和发展、离子通道和炎症反应的调节以及作为抗氧化剂、保护膜脂方面发挥着重要作用。
多胺在肿瘤微环境中的作用[13]
淋巴细胞功能:多胺与适应性免疫系统的功能(B细胞、T细胞的生成和激活)有关。多胺上调可以帮助抗肿瘤免疫。
免疫抑制微环境:产生免疫抑制表型的特殊细胞群需要高水平的多胺来支持其生长和代谢。
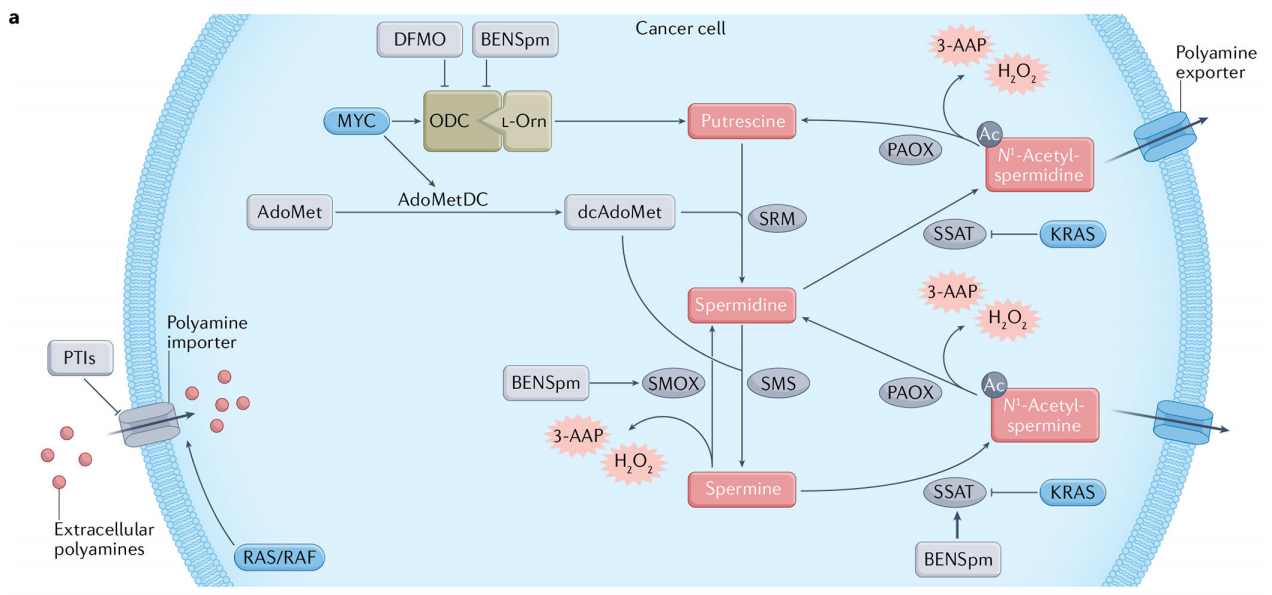
肿瘤微环境中多胺代谢调控
缺氧环境:低氧刺激显著增加肿瘤细胞腐胺和亚精胺水平。细胞外精胺促进肿瘤细胞的迁移、侵袭和转移。
炎症:免疫和在上皮细胞炎性细胞因子的刺激下进一步促进多胺代谢。胞外多胺可以提供抗炎作用,但也有可能产生有利于转化细胞选择性生长的免疫抑制微环境。利用多胺代谢降低慢性炎症环境中表观遗传或基因变化是一个正在进行的研究领域。
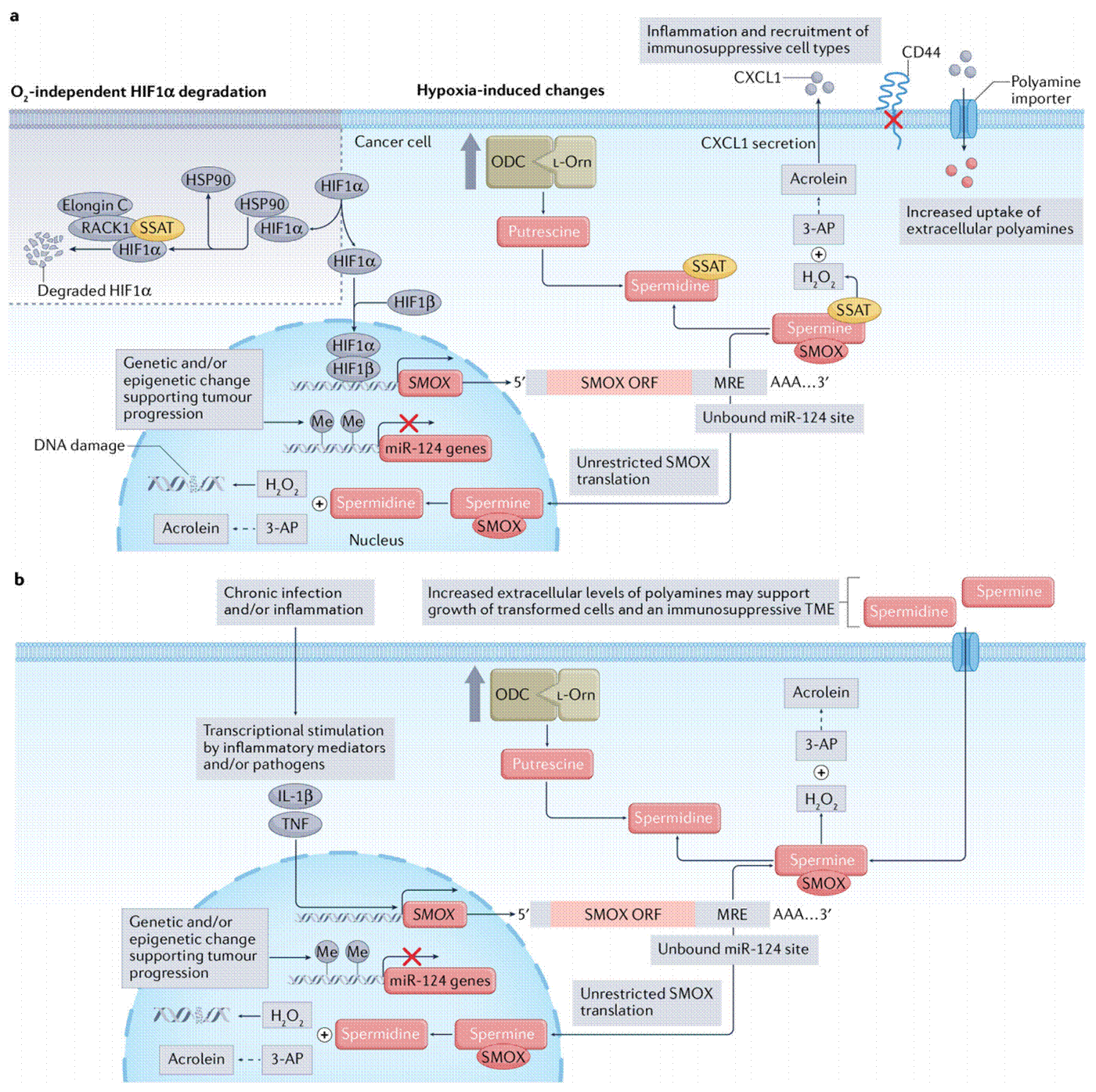
缺氧和慢性感染/炎症微环境促进致癌性多胺代谢
亚精胺在体内的代谢作用
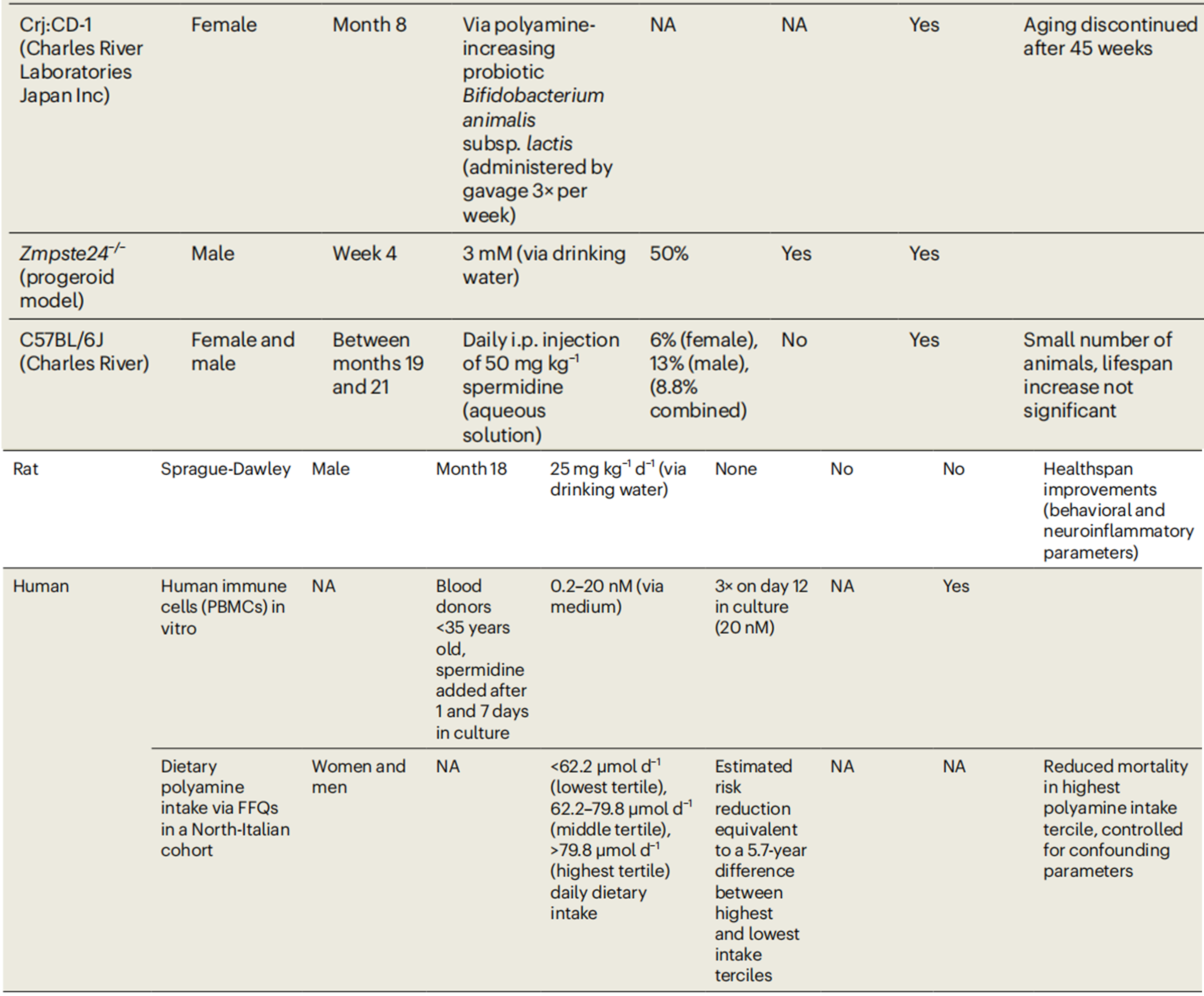
细胞自噬:自噬和多胺水平都会随着年龄的增长而降低。研究表明亚精胺是一种有价值的长寿补充剂。小鼠被分为四组:4个月大的小鼠和18个月大的小鼠,分别饮用含有或不含亚精胺的水。亚精胺被发现可以将中位寿命延长10%[19]。
促进毛发生长:研究涵盖人体试验、动物研究(小鼠)和体外试验,展示了亚精胺如何减少脱发并促进头发生长[20, 22]。除了减少脱发之外,亚精胺还可以部分改善与年龄相关的大脑葡萄糖代谢变化,改善心脏、肾脏和肝脏与年龄相关的病变,防止心脏组织端粒缩短[23]。
支持认知功能:在一项针对患有痴呆症的老年人进行的为期三个月的研究中,85名年龄在60岁至96岁之间的受试者每周六天每天接受3.3毫克亚精胺或 1.9毫克烤面包卷中的亚精胺早餐。结果表明,在亚精胺剂量较高的轻度和中度痴呆受试者中,亚精胺的摄入量与认知能力的改善之间存在明显的相关性[23]。
抗氧化特性并改善炎症反应:亚精胺可能提供抗氧化保护作用,有助于减少炎症和与年龄相关的动脉粥样硬化[24, 25]。
降低死亡率:一项为期20年的前瞻性人口研究评估了 829 名年龄在 45 岁至 85 岁之间的参与者的膳食亚精胺摄入量与死亡率之间的关系,全因死亡率会随着亚精胺摄入量的增加而降低[26]。
骨骼肌健康、促进身体产热:亚精胺促进自噬可能有助于维持骨骼肌质量。亚精胺通过调节脂质代谢和增强抗氧化能力来减少肝脏脂肪变性[27, 28]。
肠道稳态:快速增殖发育的肠细胞中常常伴随着多胺含量的增加,多胺对于动物肠道发育、肠道黏膜屏障、抗氧化和代谢等生理过程具有重要调控作用[29]。
03
疾病中的多胺代谢
过去几十年针对多胺研究的报道更多的是在植物、畜牧等领域,随着近期几篇顶刊的重磅研究陆续报道,多胺在临床疾病中的功能愈发重要。
多胺是一种普遍存在于所有生物体内的重要的多阳离子代谢物。多胺稳态的破坏可影响多种细胞功能,包括转录、翻译、氧化还原平衡和线粒体稳态。大量证据表明,多胺稳态在细胞环境中受到严格调控,参与炎症性及自身免疫性疾病,在免疫调节和防御中起着关键作用[30, 32]。根据我们对大量文献的分析,多胺对人类/动物健康的影响可分为两大类:有益和有害;对健康细胞的生理过程有益,在病理条件下有害[33]。
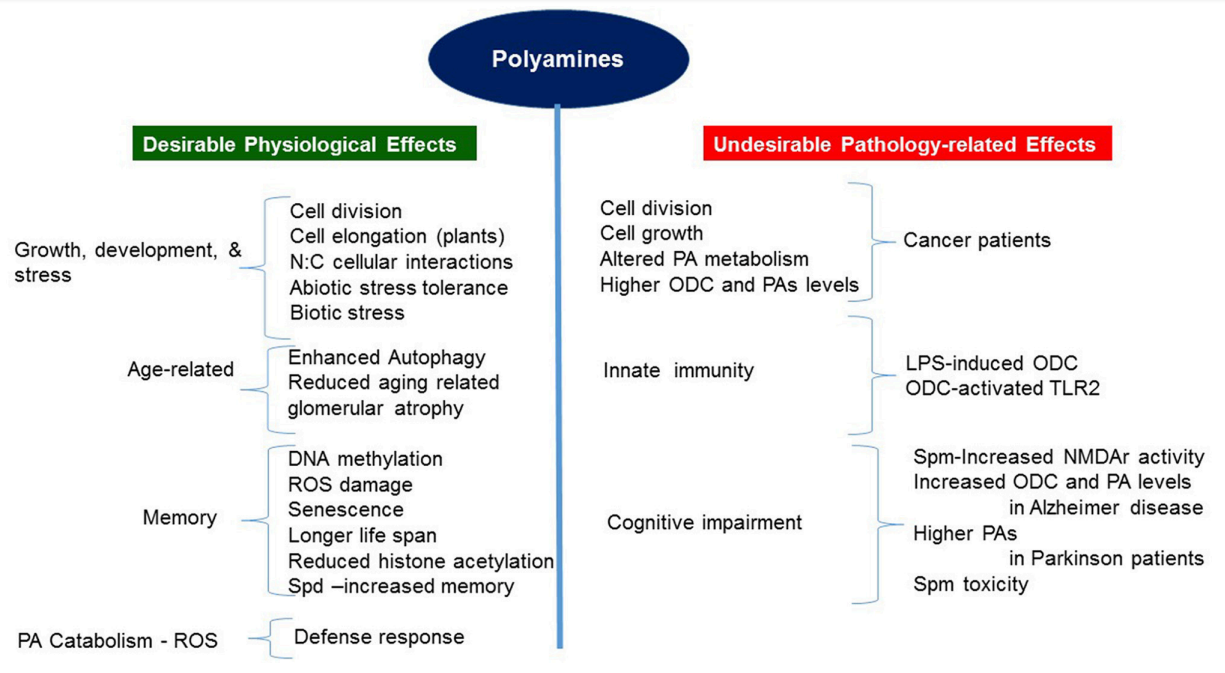
多胺在植物、动物和人中的有益和有害功能影响
3.1 多胺与衰老疾病
从细菌、真菌、植物到哺乳动物的生物体衰老过程中伴随着多胺含量的下降。许多生物体,包括果蝇、小鼠和人类,都表现出年龄依赖性的记忆障碍,这与多胺的减少有关,特别是腐胺和亚精胺。虽然这种损伤的分子基础尚不清楚,但多胺已被证明在衰老和与年龄相关的记忆丧失中发挥了重要作用。
高剂量的多胺对阿尔茨海默病和帕金森病患者患病期间的癌症、衰老、先天免疫和认知障碍有害。严格量化可食用植物来源和膳食肉类中的多胺水平是至关重要的。
使用在膳食中补充外源性亚精胺的研究,改善了小鼠、果蝇衰老的许多有害生理影响,并导致其寿命增加15-40%,支持了亚精胺对健康受试者有益的论点。
亚精胺直击九大衰老标识[56]
人群中亚精胺水平是可变的,50岁以下人群较高,60-80岁人群水平较低,而90岁或以上人群亚精胺水平与年轻人群相似(<50岁)。亚精胺能多面调控衰老标识,显著减少衰老细胞数量,当衰老小鼠连续6个月补充亚精胺后,端粒缩短速度被明显延缓,达到年轻小鼠相似水平,通过诱导细胞自噬,亚精胺恢复了肌肉干细胞的再生功能、促进肌肉生成,是逆转肌少症的有力候选物质,延长生物体寿命。
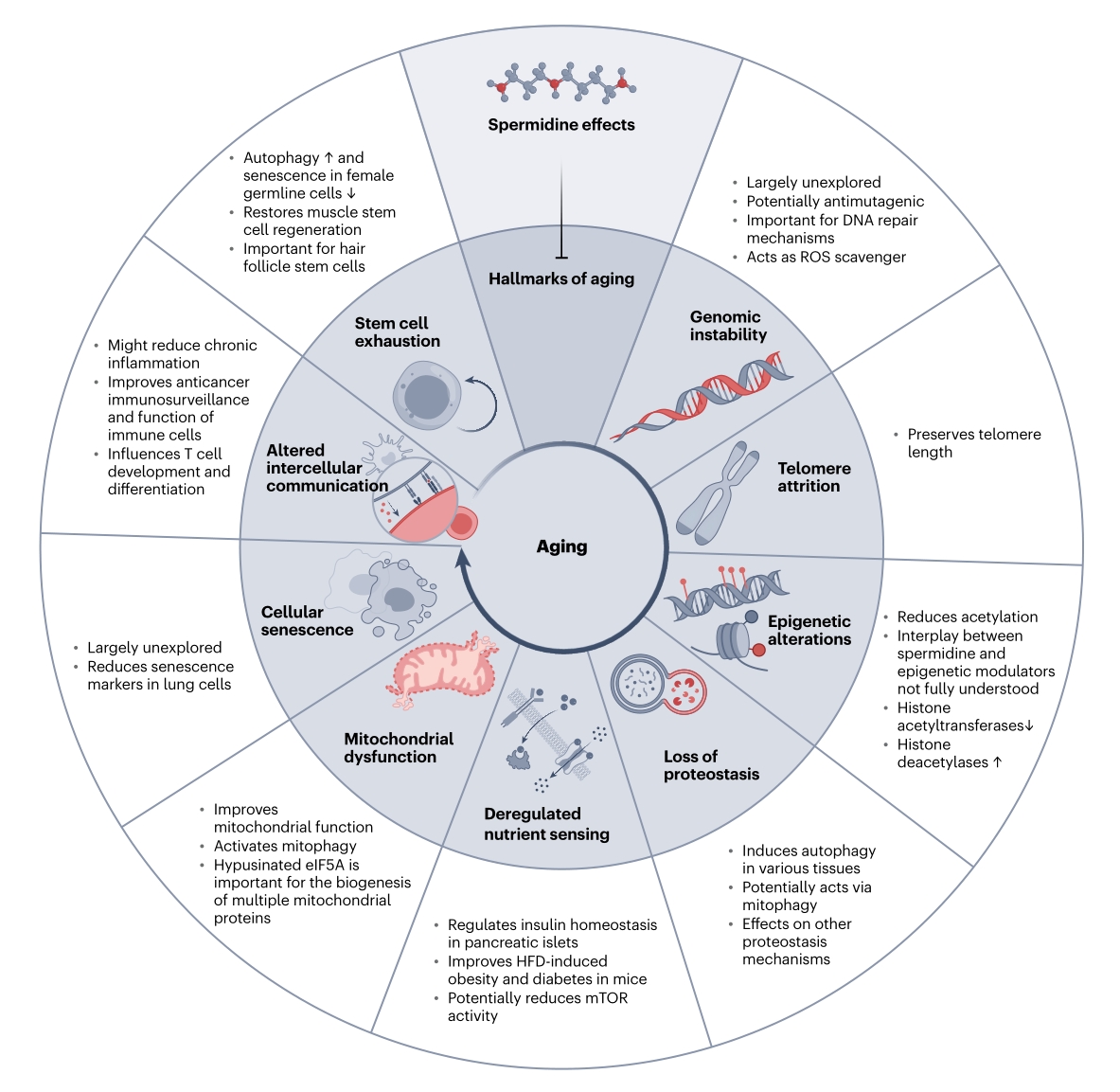
亚精胺直击九大衰老标识
阿尔茨海默病
越来越多的证据表明,阿尔茨海默病(AD)是一种普遍的代谢性疾病,发病机理涉及多种生化途径的失调。目前对AD的治疗方法为抗淀粉样β(Aβ)蛋白疗法,但是该方法治愈率低。所以确定AD发病机制的新靶点对于开发有效的治疗方法至关重要。过去的研究表明,胆碱相关生化途径的异常可能与阿尔茨海默病的发病机制有关,特别是转甲基化、多胺合成/分解代谢和相关途径。PLOS Medicine一项研究表明,与对照组相比,AD患者观察到更高浓度的精氨酸[34]。AD中多胺分解代谢基因SAT1和SMOX表达增加,多胺合成基因SRM和ODC1表达减少。在阿尔茨海默病中,多胺合成增加以及多胺分解代谢增强产生的活性醛类都有直接的细胞毒性作用。
帕金森病
帕金森病(Parkinson′s disease)是一种常见的中老年神经系统退行性疾病,主要以黑质多巴胺能神经元进行性退变和路易小体形成的病理变化,纹状体区多巴胺递质降低、多巴胺与乙酰胆碱递质失平衡的生化改变。研究表明,帕金森病患者也会伴随多胺水平的变化。
帕金森病降低了一种分解多胺代谢的酶SAT1的表达,从而使患者的多胺水平升高。多胺水平的增加通过NMDAr通路与帕金森患者的认知能力降低有关[35]。帕金森患者中较高的多胺水平也与α-突触核蛋白的聚集有关,但其在帕金森病中的作用尚不清楚。
多胺诱导模式生物寿命增加
免疫系统无法做出适应性反应是衰老的标志, B细胞功能下降导致疫苗接种效果不佳,老年人感染率高。研究表明,降低的自噬是免疫衰老的核心分子机制。成熟淋巴细胞的自噬水平特别降低,导致老年人的记忆B细胞反应受损。另外, 精胺在老年人体内减少,导致细胞自噬转录因子TFEB表达和自噬降低。添加精胺可以恢复这一途径,并改善老年人体内B细胞的功能[36]。
Cell Metabolism杂志上发表的一项研究显示,老年小鼠体内的多胺水平下降会减慢昼夜节律,通过膳食补充亚精胺能够逆转这种效果[37]。Nature Reviews Cardiology重磅综述心血管衰老的八大标志[38],即巨自噬功能受损、蛋白稳态丧失、基因组不稳定(特别是不确定潜能的克隆性造血)、表观遗传学改变、线粒体功能障碍、细胞衰老、神经激素信号失调和炎症。天然多胺和自噬诱导剂亚精胺可在心脏和血管的衰老过程中起到保护作用,如减轻心肌增厚、僵硬和舒张功能障碍、改善血管内皮功能障碍、血压调节、动脉硬化、心室-血管耦合和减少慢性低度炎症。
在生殖衰老过程中,多胺代谢物亚精胺的水平在卵巢中下降,其中还伴随着卵母细胞质量下降和卵巢衰老的其他迹象。补充亚精胺,能够通过增强线粒体自噬来恢复老龄雌性小鼠的卵母细胞质量和生育力。这一研究成果将促进对哺乳动物和人类生育寿命的治疗性研究[39]。
从细胞、无脊椎动物到哺乳动物,亚精胺均被证实具有明显延寿功效。如哺乳动物小鼠模型中,短期或终生摄入亚精胺都能让小鼠的寿命被大幅延长,效果最好可达50%。
亚精胺诱导的模式生物寿命增加[56]
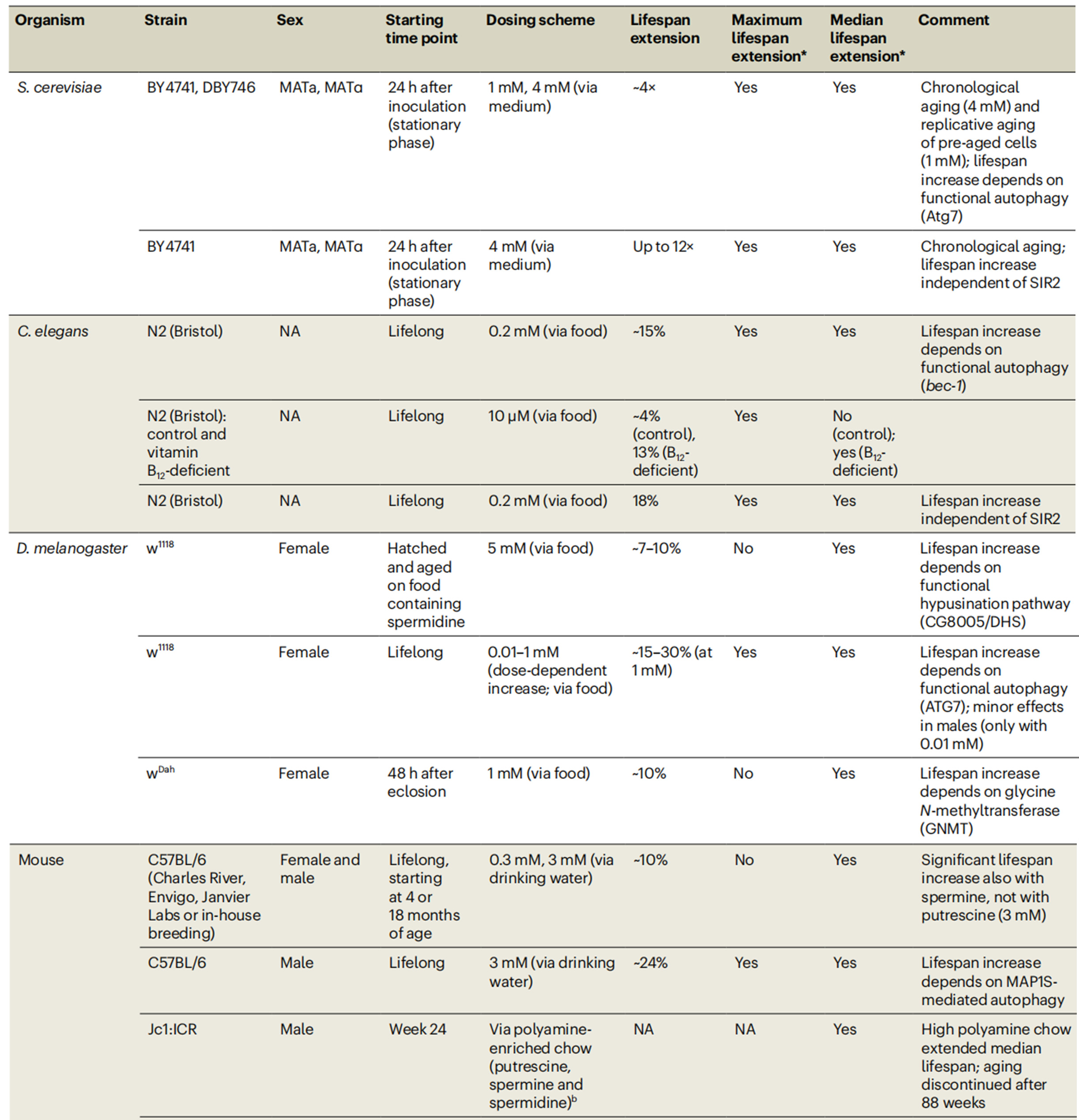
多胺延缓衰老的分子机制
高多胺水平,特别是亚精胺对衰老的影响被归因于多种生化机制,包括自噬增加、脂质代谢、细胞生长和死亡过程。
自噬通过从细胞中去除受损的蛋白质和细胞器,在减缓衰老过程中发挥着积极的作用。亚精胺抑制组蛋白乙酰化酶,从而通过增强细胞保护来延长寿命。
亚精胺凭借激活自噬及调控机体信号通路中的转录因子、能量感知通路(AMPK和mTORC1)等,多方恢复生物机体代谢健康[56]。
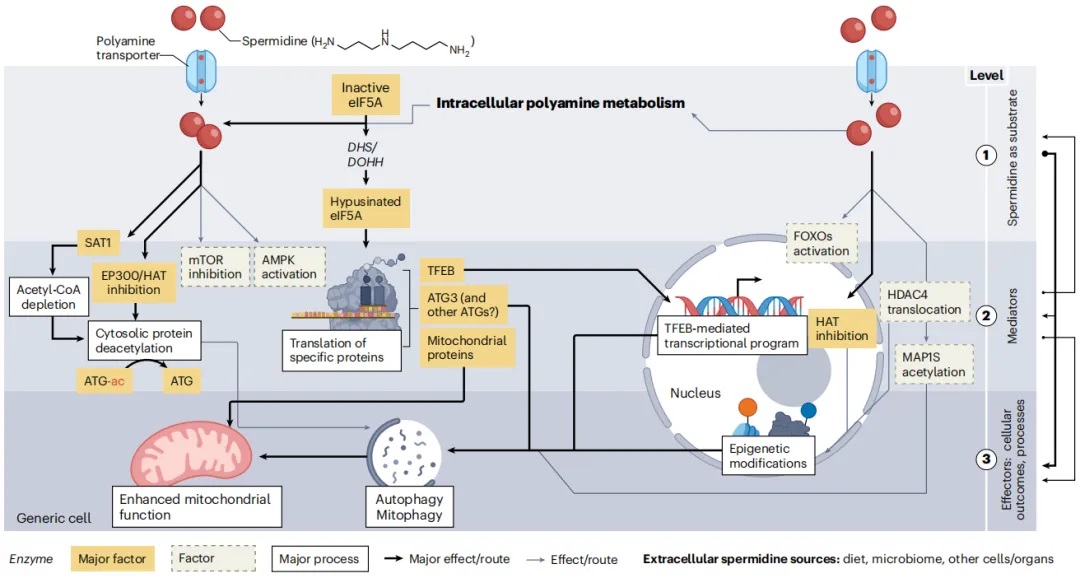
亚精胺作用的主要分子和代谢机制
小结
多胺对生物体的作用具有双面性,其抗衰老作用具有巨大的经济价值,也是多胺最重要的功能。多胺是神奇的抗衰老物质,亚精胺被发现具有促进自噬、直击衰老标识、延长50%寿命等功效,且在人体心血管健康、脱发问题和记忆力提升等方面也展现了神奇的作用[56]。
3.2 多胺与抗肿瘤免疫
国家自然科学基金委员会为进一步强化原始创新,推动肿瘤研究的原创性突破,其生命与医学板块拟资助“肿瘤免疫与肿瘤代谢”原创探索计划项目,旨在资助聚焦于肿瘤新的免疫检查点、肿瘤代谢干预新靶点的发现,以及肿瘤预防和肿瘤治疗新策略的探索项目,促进对肿瘤发生发展规律的变革性认识,实现有效预防和治疗肿瘤的目的。
长期以来,多胺代谢与癌基因有直接联系,所以多胺代谢一直是癌症治疗药物的潜在靶点。虽然大家已经广泛研究多胺调节剂对肿瘤细胞的作用,但对肿瘤微环境的非肿瘤细胞的影响知之甚少。已经有证据表明:多胺具有抗炎、免疫抑制等特性,降低多胺水平可以提高抗肿瘤免疫反应。
抑制多胺合成以治疗肿瘤的历史起源
● 最初发现
1971年,科学家惊讶的发现在各类肿瘤患者的尿液中,都发现多胺浓度显著地增加了[40]。该发现迅速引起了肿瘤医生的关注,他们开始以尿液多胺水平作为标志物用来检测肿瘤。更进一步,他们希望能够阻断多胺的生物合成,期待这种方法能用于治疗肿瘤。
二氟甲基鸟氨酸(DFMO)后续被制造出来,用于阻断哺乳动物细胞中的多胺合成,它可以在动物模型上抑制皮肤癌、结肠癌等肿瘤[41]。
● 临床失败
受这些结果鼓舞,学术界陆续开展了一系列DFMO治疗晚期肿瘤的临床试验。然而,从安全性和有效性的角度来看,均告失败。DFMO治疗肿瘤的疗效非常有限,且副作用如腹泻、呕吐、脱发、听觉毒性等纷纷显现。
● 重回“战场”
直到近些年,多篇顶刊重磅报道多胺抗肿瘤免疫的作用,又重新将这类代谢物拉回科学家的视野。接近一半的高危神经母细胞瘤患者伴有原癌基因MYCN的高表达,引发神经母细胞瘤代谢模式的改变,导致这种类型的神经母细胞瘤在一定程度上依赖于多胺合成[42]。在临床前试验中,DFMO被证明能够联合多种临床用药物协同杀伤神经母细胞瘤[43]。因此,科学家们提出在常规治疗后,用DFMO联合化疗方案,可能进一步延长这些复发和/或难治性神经母细胞瘤患者的寿命。2023年10月,《临床肿瘤学杂志》发表了一项研究,在抗GD2单抗免疫治疗后持续口服DFMO显著降低了高危神经母细胞瘤患者的复发风险,改善了患者的无事件生存期[44]。
基于科学家的研究,美国FDA已于2023年12月13日批准将DFMO应用于高危神经母细胞瘤治疗。
多胺抗肿瘤免疫的近期重磅报道
● 多胺
Nature Reviews Cancer发表重磅综述新热点,聚焦多胺代谢、微生物群和饮食相互连接建立一个促进癌症的起始和进展的肿瘤微环境的许多方式。系统总结了多胺与肿瘤微环境间的相互作用[45]。
Nature Metabolism发表肿瘤细胞在半胱氨酸饥饿的状态下,引发脂质过氧化,导致一种独特细胞代谢性死亡-铁死亡,多胺代谢通路上调应对半胱氨酸的缺失,为肿瘤治疗提供了新的思路[46]。Nature发表胰腺癌细胞通过鸟氨酸转氨酶促进多胺合成,进而促进肿瘤生长的重要机制,使用鸟氨酸转氨酶抑制剂能有效得缓解胰腺癌细胞的增殖,这将为胰腺癌患者带来生命的曙光[47]。
Cell背靠背发表了两篇文章,提供了多胺对自身免疫影响的直接证据,而对免疫CD4+T细胞的深入研究也会给其他相关许多疾病带来线索,奠定了多胺临床研究的新方向的基础[49, 50]。Science Advances发现T细胞激活中一个连接精氨酸分解代谢和多胺从头生物合成的代谢轴在调节细胞功能方面发挥的重要作用,从头合成和替代途径协调调节多胺稳态以调控T细胞增殖及功能,为治疗炎症性疾病和自身免疫性疾病提供创新性的方法[51]。
PNAS发现肺癌中多胺分解代谢的激活会通过H2O2的产生以及多胺水平的下降来促进肿瘤细胞对谷氨酰胺的利用以及GSH合成,促进肿瘤细胞对谷氨酰胺的依赖,产生可靶向的脆弱性,为肺癌提供了潜在的联合治疗方案[63]。
●精胺及亚精胺
Immunity杂志发表精胺及亚精胺代谢通过控制Z-DNA形成调节cGAS活性新机制,为治疗cGAS活化异常相关抗感染及肿瘤免疫疾病提供了治疗靶点[48]。精胺能够通过靶向抑制蛋白质精氨酸甲基转移酶PRMT1,在基因组水平显著下调AR与靶基因的结合及AR靶基因的H3K27ac修饰水平,进而下调AR-FL、AR-V7信号通路,在去势抵抗性前列腺肿瘤CRPC中发挥抗肿瘤作用[62]。
● 腐胺
Advanced Science报道平滑肌细胞中腐胺促进腹主动脉瘤发展新机制[59]。不仅在肝脏,在人类阿尔茨海默病患者的大脑中,也存在着类似浓度的尿素,抑制ARG1和ODC1,都能降低腐胺水平、改善过量GABA导致的神经元活动异常[60]。
● 尸胺
TAAR13c作为一种敏感的嗅觉感受器识别死亡相关气体尸胺。低浓度的尸胺激活了一小群表达TAAR13c的嗅觉神经元,并在斑马鱼中引发强烈的先天回避行为[61]。
多胺代谢的致癌机制[45]
癌细胞需要持续升高的细胞内多胺池来维持增殖。高水平的多胺池是通过增加生物合成、增加运输和减少分解代谢来维持的,许多癌基因(MYC、JUN、FOS、KRAS和BRAF)参与了这一过程。最值得注意的是,编码多胺生物合成的两个限速酶的基因,鸟氨酸脱羧酶(ODC;由ODC1编码)和S-腺苷甲硫氨酸脱羧酶(AMD1),都是MYC的直接转录靶标。腐胺是由鸟氨酸脱羧酶合成的,鸟氨酸脱羧酶是一种被α-二氟甲基鸟氨酸抑制的限速酶(DFMO)。S-腺苷蛋氨酸脱羧酶(AdoMetDC)产生亚精胺合成酶(SRM)和精胺合成酶(SRS)活性所需的氨丙基。精胺/亚精胺N1-乙酰转移酶(SSAT)乙酰化精胺或亚精胺的N1位,可以输出到胞外或被过氧化体乙酰多胺氧化酶(PAOX)氧化后反转。精胺可以被精胺氧化酶(SMOX)直接分解为亚精胺。PAOX和SMOX副产物(H2O2、3-氨基丙醛(3-AP)和3-乙酰氨基丙醛(3-AAP))可导致氧化应激。SSAT和SMOX可由多胺类似物(如N1,N11-双(乙基)去甲精胺(BENSpm))诱导。多胺转运抑制剂(PTI)可阻断多胺摄取。

多胺代谢的致癌机制
小结
多胺的抗肿瘤免疫是科学家长期关注的重点,在不同疾病中具有不同的作用机制,具有重要的临床价值,是靶向治疗肿瘤药物开发的重要方向之一。
3.3 膳食多胺及其他疾病领域
全谷物、蔬果、豆类、菌菇等是亚精胺的主要膳食来源,食物储存和加工可影响其含量和稳定性;膳食和菌群产生的多胺分别主要在小肠和大肠处吸收,经内吞作用、多种转运子和被动扩散等机制被细胞摄入,乙酰化是多胺胞内代谢的关键环节;临床前研究表明,膳食补充亚精胺或可延长寿命,或有改善心血管健康、神经保护、免疫调节、增强自噬和毛囊功能、抗癌、抗衰老等作用[8]。
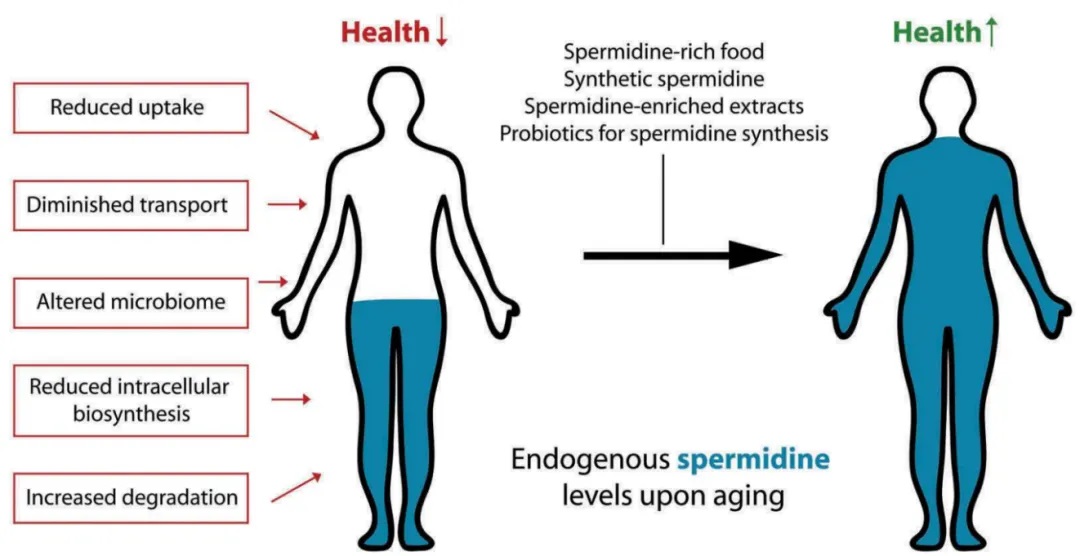
膳食补充亚精胺可以延长机体寿命[10]
在老年小鼠中,膳食补充亚精胺可改善其认知功能,这与增强海马区的线粒体呼吸能力有关;在果蝇中,膳食亚精胺能增强线粒体呼吸能力,改善嗅觉记忆,该作用由自噬调节因子Atg7和线粒体自噬因子Pink1及Parkin介导;机制上,膳食亚精胺可进入大脑,通过促进海马区的eIF5A羟腐胺赖氨酸化,增强细胞自噬和线粒体自噬,改善线粒体功能,促进认知功能;在纳入815人的前瞻性队列中,膳食亚精胺摄入量与人的认知表现相关[52, 53]。
Nature Metabolism发表一类减肥的新功能信号分子,揭示了内皮细胞通过精胺、亚精胺和腐胺等与脂肪细胞通讯,以促进脂肪组织的血管化,从而逆转肥胖的代谢作用[54]。Cell metabolism报道巨噬细胞中mTORC1的激活诱导多胺合成,小鼠结肠中的亚精胺和精胺及其前体腐胺水平在平衡状态下升高,上皮细胞吸收多胺,支持它们的增殖,巨噬细胞衍生的多胺支持结肠上皮细胞的代谢重编程,支持防御与细胞增殖[55]。
小结
综合研究结果,每天补充5-15mg亚精胺将有效延缓、甚至逆转与年龄相关的组织器官功能恶化[56]。
3.4 多胺相关研究范例
Cell细胞间通过代谢物交换让彼此一起延寿
主要结论:酵母细胞建立跨代代谢物交换的相互作用;代谢物交换的相互作用可延长酵母群落寿命;SeMeCo的寿命延长由旁分泌机制介导;甲硫氨酸的交换在自然界中频繁出现;寿命延长由保护性代谢物介导;甲硫氨酸交换相互作用影响多种衰老途径。
多胺的生物合成需要S-腺苷甲硫氨酸(SAM),这是甲硫氨酸生物合成途径的中间产物,也是生成精氨酸和精胺的底物。与野生型或MET15-SeMeCo在静止期相比,在SeMeCo中检测到的精胺和腐胺的水平增加。
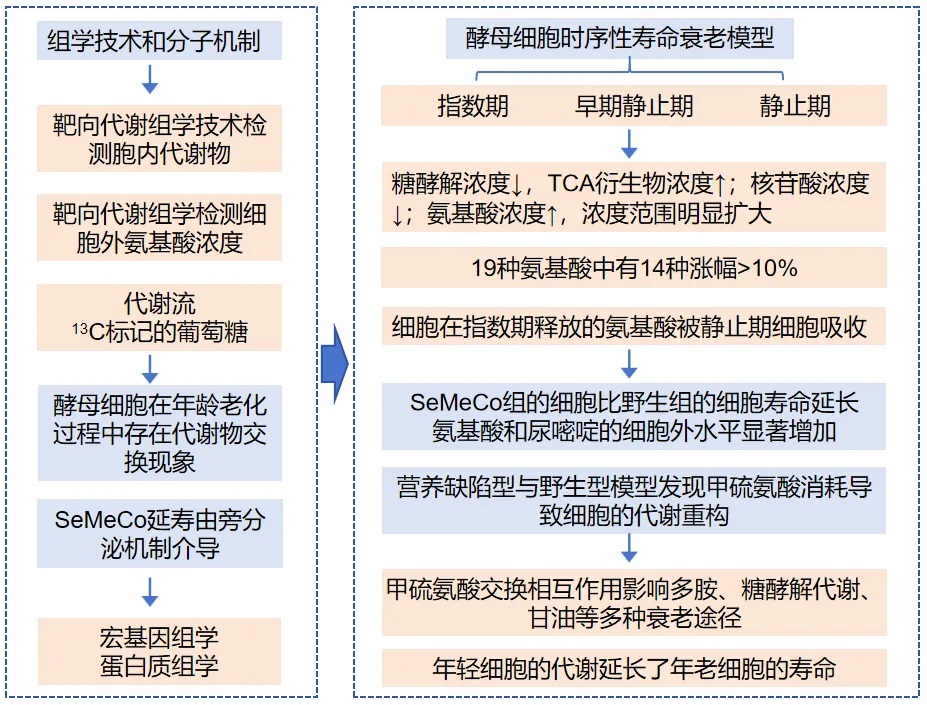
本研究确立了代谢物交换的相互作用是细胞衰老的决定因素,并表明代谢交换的细胞可以塑造代谢环境以延长双方寿命,这一发现将对人类衰老过程和与年龄有关的疾病研究提供重要指导[57]。
Nature鸟氨酸转氨酶,胰腺癌新靶点
主要结论:胰腺导管腺癌(PDA)通过谷氨酰胺生成多胺;PDA的肿瘤微环境中精氨酸被耗竭;PDA依赖于鸟氨酸从头合成(DNS);原癌基因KRAS驱动PDA多胺合成;抑制鸟氨酸转氨酶(OAT)可缓解PDA进展;OAT介导PDA的基因组及表观遗传改变。
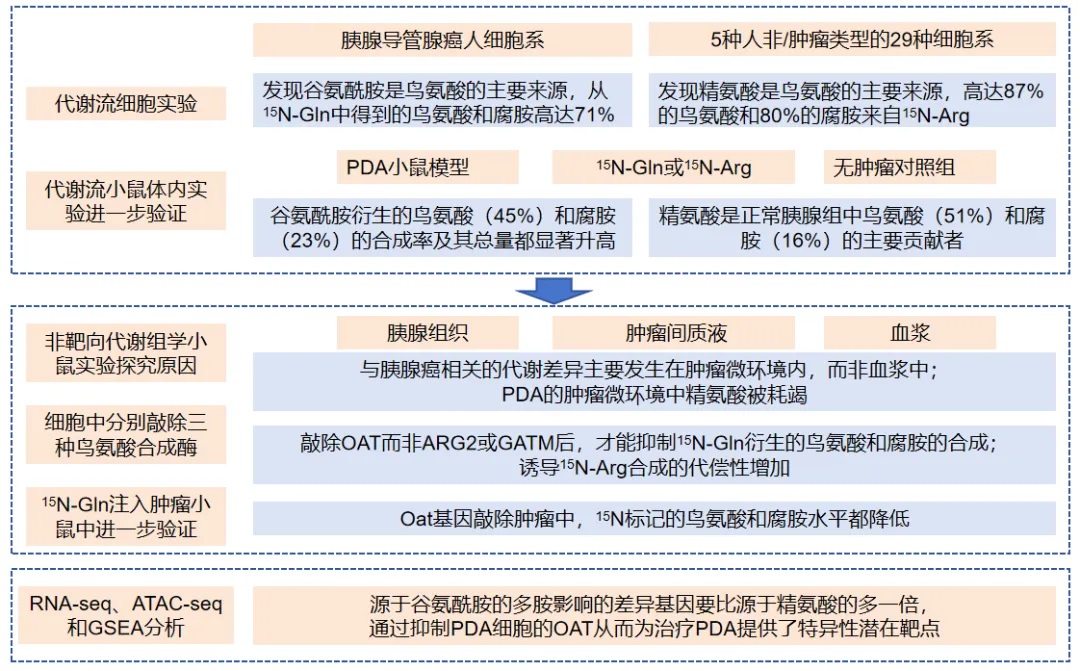
研究在人类和小鼠的体外和体内模型中使用利用15N谷氨酰胺同位素示踪及代谢组、基因敲除和抑制剂等方法,表明PDA对谷氨酰胺衍生的鸟氨酸合成有显著的依赖性。PDA组织(而非正常组织)对OAT介导的从头合成鸟氨酸的独特依赖性,为OAT抑制剂治疗胰腺癌提供了一种具体而有效的策略,而且毒性最小[47]。
靶向肿瘤代谢重编程改善食管鳞癌顺铂耐药的新途径
主要结论:缺氧常导致代谢重编程,研究人员通过代谢组学分析进一步了解到,异常的IGF1R通路通过c-MYC的转录活性促进代谢酶ASS1和PYCR1的表达。具体而言,ASS1的表达增强促进精氨酸代谢以进行生物合成代谢,而PYCR1则激活脯氨酸代谢以维持氧化还原平衡。
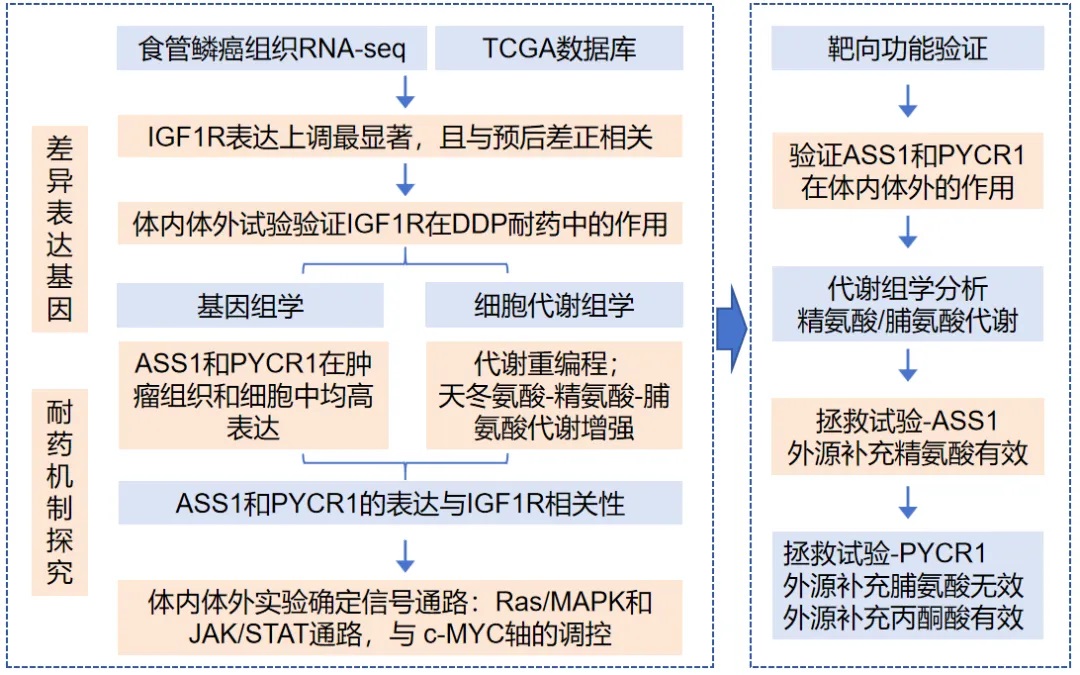
研究揭示了通过胰岛素样生长因子-I受体(IGF1R)途径上调精氨酸琥珀酸合成酶1(ASS1)和吡咯烷-5-羧酸还原酶1(PYCR1)的表达,靶向精氨酸和脯氨酸代谢,促进OSCC对DDP的耐药,提示靶向IGF1R信号转导的Linsitinib可能为DPP耐药的OSCC患者提供有前景的联合治疗选择[58]。
04
膳食多胺延缓衰老
4.1 植物中天然多胺的分类标准
天然产物领域国际顶级期刊《Natural Product Reports》提出了多胺(polyamine,或称聚胺)分类标准,系统总结了近20年来含多胺天然产物的来源、化学结构、生物活性与生物合成等方面的研究进展[2]。根据结构与来源的不同,多胺可分为衍生于氨基酸(AAs)的多胺与衍生于脂肪酸/聚酮(FA/PK)的多胺。根据与多胺单元相结合骨架部分的结构差异,将含多胺的天然产物分为两个大类:第一大类为含氨基酸源多胺的天然产物,包括多胺生物碱(polyamine alkaloids)、多胺铁载体(polyamine siderophores)、非核糖体肽-(聚酮)-多胺杂合体(NRP-(PK)-PA hybrids)、多胺甾醇(polyaminosterols,PASs)和肽-长链多胺杂合体(peptide-lcPA hybrids)等5个小类,而第二大类含脂肪酸/聚酮源多胺的天然产物目前仅发现有非核糖体肽-聚酮-长链聚脂肪胺杂合体(NRP-PK-lcPFAN hybrids)。
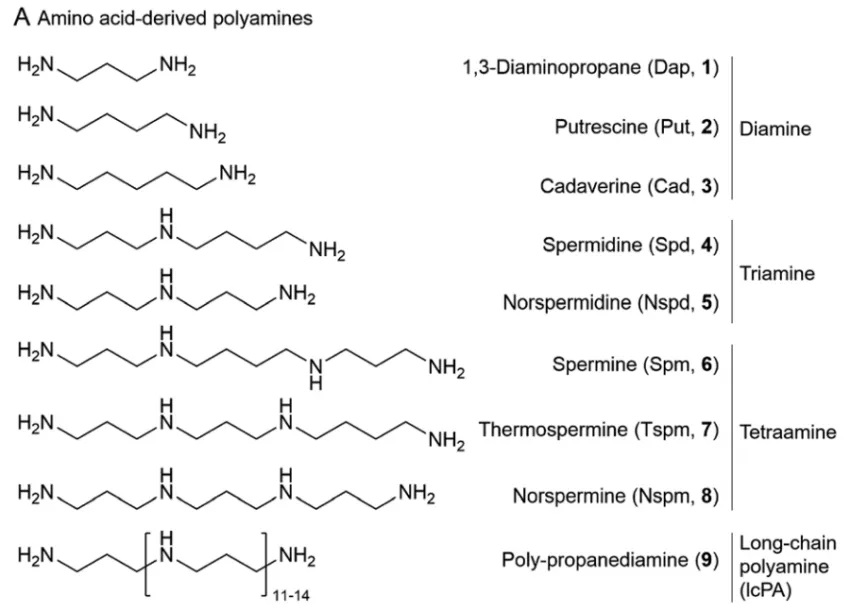
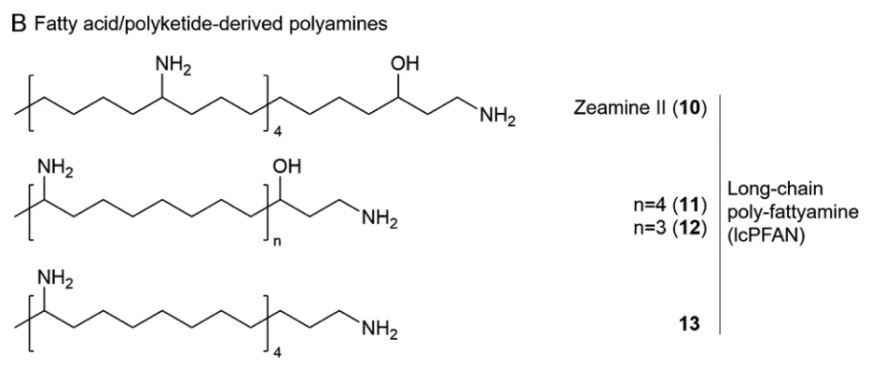
结构丰富多样的含多胺天然产物
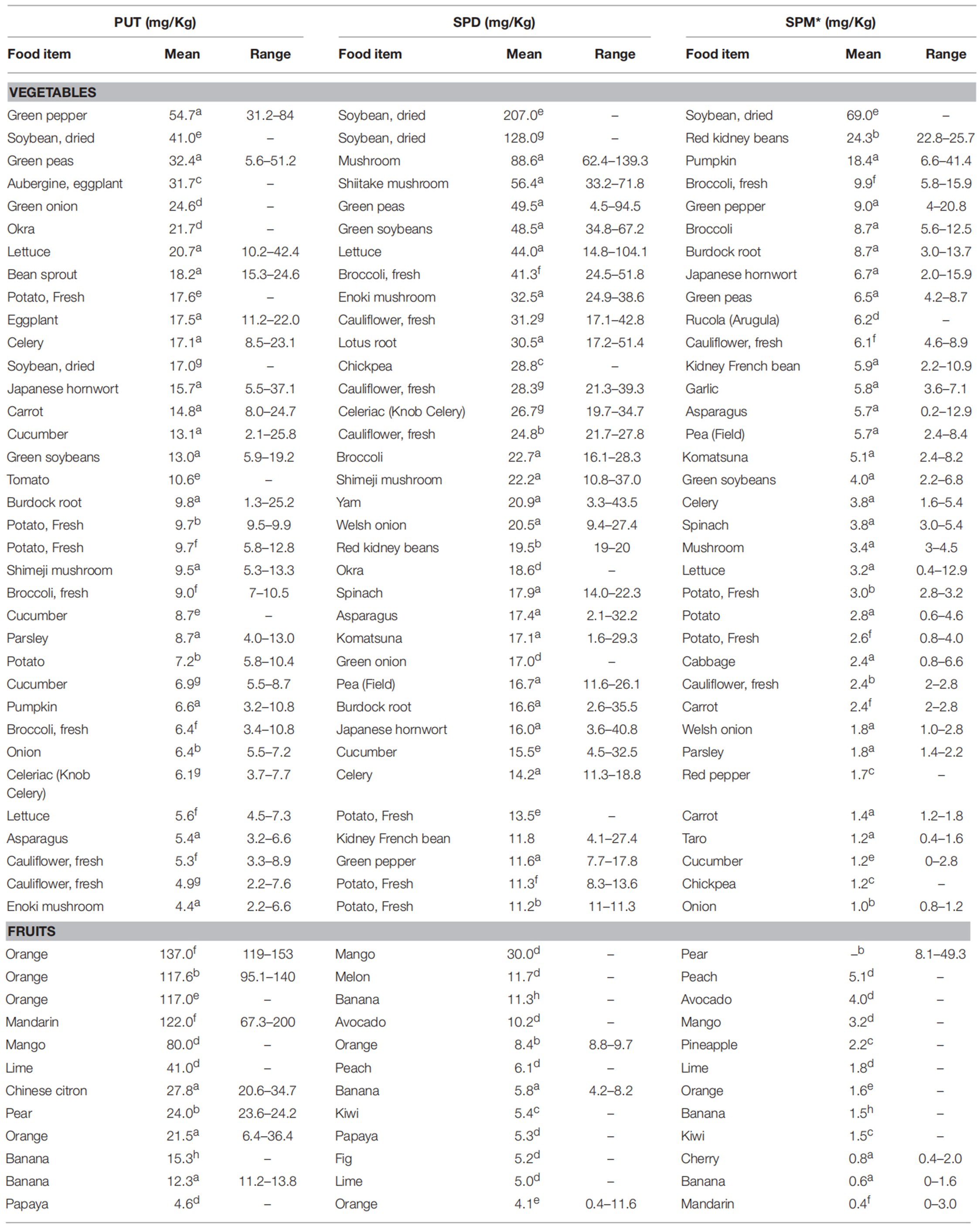
4.2 植物体内多胺含量
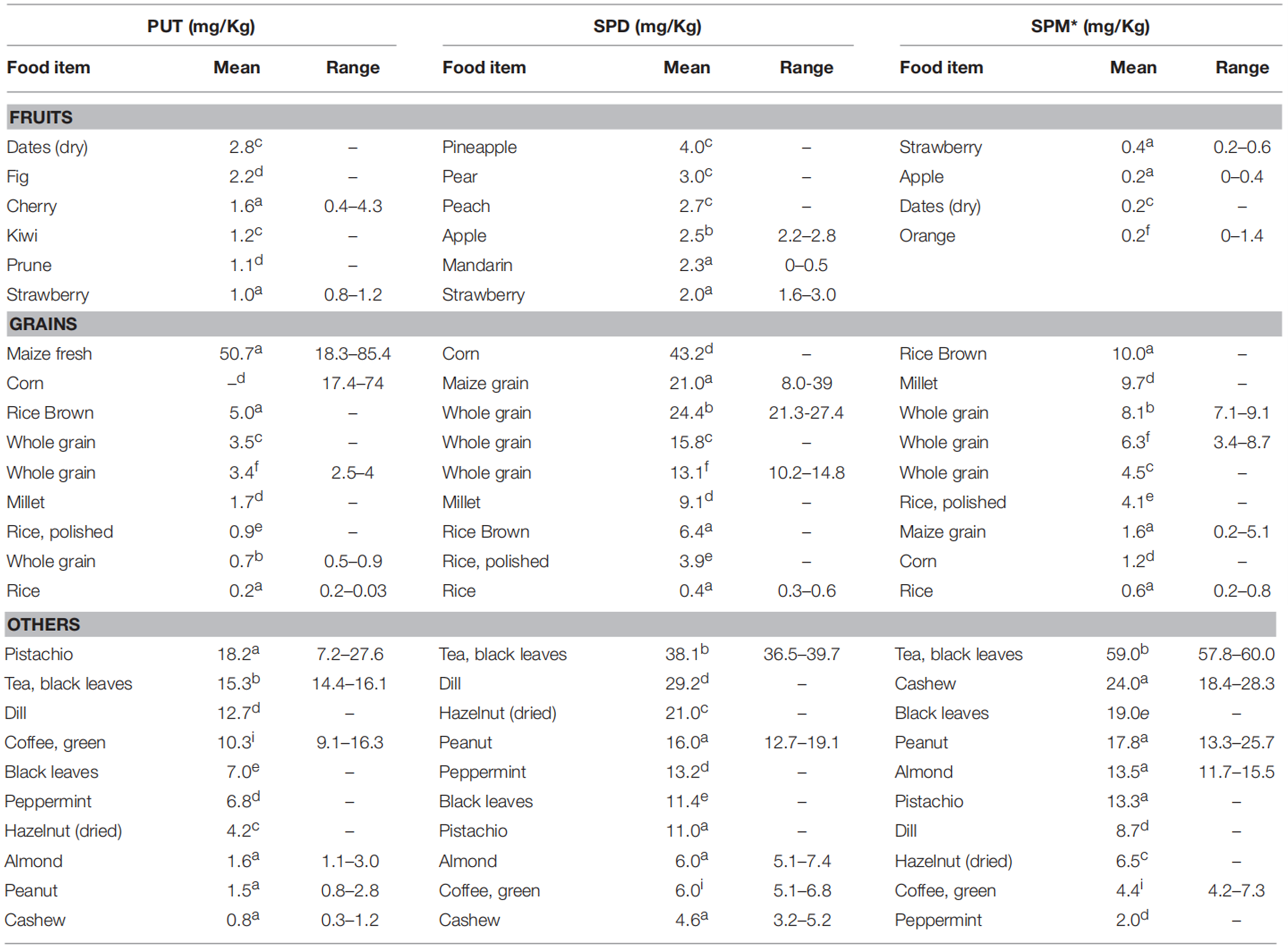
多胺广泛存在于动物和植物来源的食物中,含量较高的食物类别是谷物、豆类与大豆衍生物和动物肝脏[3]。青椒、玉米等食物中腐胺含量均在 800 nmol/g 以上;在发酵大豆、清酒酒糟、黑豆、大豆中尸胺含量超过 800 nmol/g;小麦胚芽、干蘑菇、黑豆、大豆、纳豆、青椒等食物中亚精胺含量超过 700 nmol/g[4]。成熟也可能潜在地影响亚精胺的含量,在香蕉成熟期间亚精胺含量相对稳定,几乎不受蒸煮或煎炸的影响[7]。
蔬菜、水果、谷物和其他植物性饮食中的多胺含量[33]
4.3 健康小贴士
基于科学家的研究,每天补充5-15mg亚精胺将有效延缓、甚至逆转与年龄相关的组织器官功能恶化;市场上已有亚精胺胶囊等商品可供购买;美国FDA于2023年12月13日批准将DFMO(多胺合成的阻断剂)应用于高危神经母细胞瘤治疗。
综合研究结果,绘谱君贴心的整理了常见食物中的亚精胺含量,祝屏幕前的各位,长寿健康,福寿绵长!
绘谱帮你测:新品发布
随着多胺代谢物被各大顶级学术期刊陆续报道,其延缓衰老、抗肿瘤免疫等作用日益显著,针对多胺及相关代谢通路,麦特绘谱开发了针对性靶向代谢组学产品,助力临床研究。
麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000、Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章300+篇,累计影响因子3000+,平均IF>10,包括Science, Nature, Cell Metabolism ,Immunity, Gut, Hepatology, Microbiome等顶级期刊。
References
[1]Polyamines, metabolites and metabolomics. Acta Physiologica, 2020.
[2]Polyamine-containing natural products: structure, bioactivity, and biosynthesis. Natural Product Reports, 2023.
[3]Polyamines in food.Frontiers in Nutrition, 2019.
[4]Decrease in polyamines with aging and their ingestionfrom food and drink. Journal of Biochemistry, 2006.
[5]Contentsof biologically active polyamines in chicken meat , liv-er , heart and skin after slaughter and their changes during meat storage and cooking. Food Chemistry, 2009.
[6]Changes in the content of biologically active polyaminesduring pork loin storage and culinary treatments. European Food Research and Technology, 2008.
[7]Bioactive amines changes during the ripening and thermal processes of bananas and plantains. Food Chemistry, 2019.
[8]Nutritional Aspects of Spermidine. Annual Review of Nutrition, 2020.
[9]多胺的生理功能及其作用机理研究进展. 动物营养学报,2022.
[10]Spermidine :a physiological autophagy induceracting as an anti-aging vitamin in humans?. Autophagy, 2019.
[11]Modulation of cellu-lar function by polyamines. The International Journal of Biochemistry &Cell Biology, 2010.
[12]Functions of polyamines in mammals. Journal of Biological Chemistry, 2016.
[13]Polyamines in cancer: integrating organismal metabolism and antitumour immunity. Nature Reviews Cancer, 2022.
[14]Polyamines and Kynurenines at the Intersection of Immune Modulation. Trends in Immunology, 2020.
[15]The uptake of glutamine and release of arginine, citrulline and proline by the small intestine of developing pigs. Journal Of Nutrition, 1994.
[16]The underappreciated diversity of bile acid modifications. Cell, 2024.
[17]De novo synthesis and salvage pathway coordinately regulate polyamine homeostasis and determine T cell proliferation and function. Science Advances, 2020.
[18]A bacterial spermidine biosynthetic pathway via carboxyaminopropylagmatine. Science Advances, 2023.
[19]Short-Term Fasting Induces Profound Neuronal Autophagy. Autophagy, 2010.
[20]Spermidine promotes human hair growth and is a novel modulator of human epithelial stem cell functions. PloS one, 2011.
[21]A spermidine-based nutritional supplement prolongs the anagen phase of hair follicles in humans: a randomized, placebo-controlled, double-blind study. Dermatology practical & conceptual, 2017.
[22]Novel Aspects of Age-Protection by Spermidine Supplementation Are Associated with Preserved Telomere Length. GeroScience, 2021.
[23]Autophagy and Aging. Advances in Experimental Medicine and Biology, 2015.
[24]Polyamines in Aging and Disease. Aging (Albany NY), 2011.
[25]Alternative Uses for Co-Products: Harnessing the Potential of Valuable Compounds from Meat Processing Chains. Meat Science, 2017.
[26]Bioactive Compounds in Meat. Meat Biotechnology, 2021.
[27]Inwardly Rectifying Potassium Channels: Their Structure, Function, and Physiological Roles. Physiological Reviews, 2010.
[28]Effects of Polyamines on the Binding of [3H]MK-801 to the N-Methyl-D-Aspartate Receptor: Pharmacological Evidence for the Existence of a Polyamine Recognition Site. Molecular Pharmacology, 1989.
[29]多胺对动物肠道稳态的调控作用及可能机制. 动物营养学报, 2016.
[30]Macrophage Metabolism of Apoptotic Cell-Derived Arginine Promotes Continual Efferocytosis and Resolution of Injury. Cell Metabolism, 2020.
[31]The transcription factor Myc controls metabolic reprogramming upon T lymphocyte activation. Immunity, 2011.
[32]L-Arginine Modulates T Cell Metabolism and Enhances Survival and Anti-tumor Activity. Cell, 2016.
[33]Polyamines: Bio-Molecules with Diverse Functions in Plant and Human Health and Disease. Frontiers in Chemistry, 2018.
[34]Dysregulation of multiple metabolic networks related to brain transmethylation and polyamine pathways in Alzheimer disease: A targeted metabolomic and transcriptomic study. PLOS Medicine, 2020.
[35]Polyamines: Bio-Molecules with Diverse Functions in Plant and Human Health and Disease. Frontiers in Chemistry, 2018.
[36]Polyamines Control eIF5A Hypusination, TFEB Translation, and Autophagy to Reverse B Cell Senescence. Molecular Cell, 2019.
[37]Circadian Clock Control by Polyamine Levels through a Mechanism that Declines with Age. Cell Metabolism, 2015.
[38]Hallmarks of cardiovascular ageing. Nature Reviews Cardiology, 2023.
[39]Polyamine metabolite spermidine rejuvenates oocyte quality by enhancing mitophagy during female reproductive aging. Nature Aging, 2023.
[40]Increased polyamine concentrations in the urine of human cancer patients. nature new biology, 1971.
[41]Catalytic irreversible inhibition of mammalian ornithine decarboxylase (E.C.4.1.1.17) by substrate and product analogs. Journal of the American Chemical Society, 1978.
[42]ODC1 is a critical determinant of MYCN oncogenesis and a therapeutic target in neuroblastoma. Cancer Research, 2008.
[43]CHAF1A Blocks Neuronal Differentiation and Promotes Neuroblastoma Oncogenesis via Metabolic Reprogramming. Advanced Science, 2021.
[44]Eflornithine as Postimmunotherapy Maintenance in High-Risk Neuroblastoma: Externally Controlled, Propensity Score-Matched Survival Outcome Comparisons. Journal Of Clinical Oncology, 2024.
[45]Polyamines in cancer: integrating organismal metabolism and antitumour immunity. Nature Reviews Cancer, 2022.
[46]Polyamine pathway activity promotes cysteine essentiality in cancer cells. Nature Metabolism, 2020.
[47]Ornithine aminotransferase supports polyamine synthesis in pancreatic cancer. Nature, 2023.
[48]Polyamine metabolism controls B-to-Z DNA transition to orchestrate DNA sensor cGAS activity. Immunity, 2023.
[49]Metabolic modeling of single Th17 cells reveals regulators of autoimmunity. Cell, 2021.
[50]Polyamine metabolism is a central determinant of helper T cell lineage fidelity. Cell, 2021.
[51]De novo synthesis and salvage pathway coordinately regulate polyamine homeostasis and determine T cell proliferation and function. Science Advances, 2020.
[52]Dietary spermidine improves cognitive function. Cell Reports,2021.
[53]eIF5A hypusination, boosted by dietary spermidine, protects from premature brain aging and mitochondrial dysfunction. Cell Reports,2021.
[54]Angiocrine polyamine production regulates adiposity. Nature Metabolism, 2022.
[55]Metabolic support by macrophages sustains colonic epithelial homeostasis. Cell metabolism, 2023.
[56]Mechanisms of spermidine-induced autophagy and geroprotection. Nature Aging, 2022.
[57]Cell-cell metabolite exchange creates a pro-survival metabolic environment that extends lifespan. Cell, 2023.
[58]Targeting IGF1R signaling enhances the sensitivity of cisplatin by inhibiting proline and arginine metabolism in oesophageal squamous cell carcinoma under hypoxia. Journal of Experimental & Clinical Cancer Research, 2023.
[59]Gasdermin D deficiency in vascular smooth muscle cellsameliorates abdominal aortic aneurysm through reducing putrescine synthesis. Advanced Science, 2022.
[60]Astrocytic urea cycle detoxifies AB-derived ammoniawhile impairing memory in Alzheimer’s disease. Cell Metabolism, 2022.
[61]High-affinity olfactory receptor for the death-associated odor cadaverine. PNAS, 2013.
[62]Spermine Is a Natural Suppressor of AR Signaling in Castration-Resistant Prostate Cancer. Cell Reports, 2023.
[63]Activation of polyamine catabolism promotes glutamine metabolism and creates a targetable vulnerability in lung cancer. PNAS, 2024.
END


