文献解读
客户案例 | IF 30+!一击入魂!Cell子刊揭示拟杆菌丙酸生物合成的关键酶MCM改善结肠炎!
短链脂肪酸(SCFA)在肠道内由菌群发酵膳食纤维产生,丙酸是一种主要的 SCFA,对宿主生理具有促进健康的作用,丙酸介导的免疫和代谢信号传导与多种慢性炎症性疾病和代谢紊乱有关,包括胃肠道炎症性疾病、结直肠癌、2 型糖尿病、肥胖症和多发性硬化症。多形拟杆菌(Bacteroides thetaiotaomicron, BT),作为人体肠道内的主要丙酸产生菌,是研究和调节人体肠道丙酸水平的一类潜在共生菌。但其生化途径和具体功能仍待研究。
来自上海交通大学医学院附属瑞金医院刘瑞欣、王计秋、王卫庆、宁光等团队,鉴定出拟杆菌中参与丙酸生物合成的关键酶——甲基丙二酰-辅酶A变位酶(MCM),并证明其可促进肠道杯状细胞分化和粘液分泌,从而缓解结肠炎症,维持肠道稳态,相关研究成果发表于Cell Host & Microbe(IF 30.3)。(麦特绘谱为本研究提供短链脂肪酸检测服务)

研究材料
BT 野生型(BT WT)
scpA-mutA 突变株(BT △scpA-mutA)
无菌GF小鼠
LS 174T 细胞系
肠道类器官组织模型
DSS诱导的小鼠急性结肠炎模型
研究方法
靶向代谢组测短链脂肪酸
单细胞转录组测序
实时荧光定量PCR检测
免疫荧光
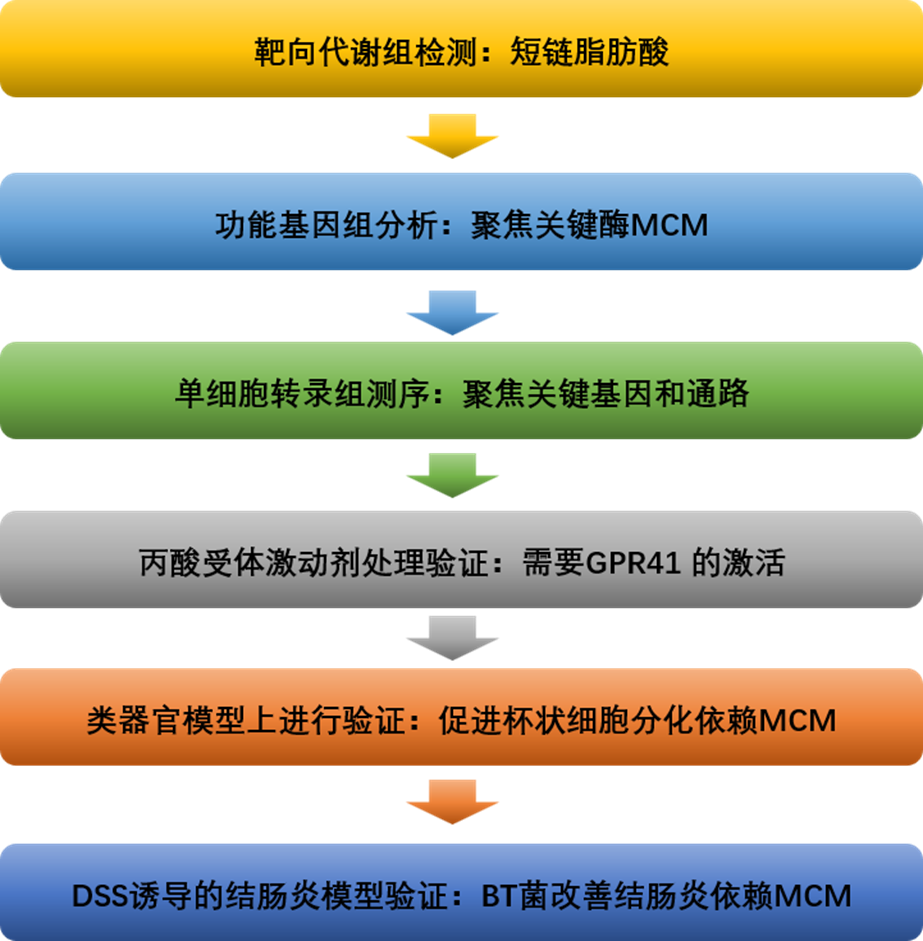
研究路线
本研究是研究某一特定菌的完整思路:通过野生菌体外培养、体内定植,基因组分析聚焦关键酶MCM;随后构建基因突变菌,代谢组检测,单细胞转录组测序,类器官模型验证, 动物模型验证,以及激动剂处理,全面揭示作用机制。
1.代谢组学检测短链脂肪酸
为了证实长期以来提出的关于拟杆菌是丙酸生成者的观点,首先将 BT(一种代表性拟杆菌)培养在脑心浸液(BHI)培养基中,并通过液相色谱-质谱法(LC-MS)检测丙酸。在培养 24 小时内,检测到丙酸浓度不断增加,而在纯培养基对照中未检测到丙酸,表明 BT菌在体外产生丙酸。随后进行了功能基因组分析,借助序列比对鉴定出BT菌负责丙酸合成的关键酶甲基丙二酰-辅酶A变位酶(MCM)及其编码基因,并通过基因编辑构建缺失MCM的BT突变菌(BT△scpA-mutA)。
接着,通过靶向代谢组学分析并比较了三种菌株(BT 野生型(BT WT)、scpA-mutA 突变株(BT △scpA-mutA)和 BT △scpA-mutA 互补菌株)在接种 24 小时后的 SCFA 含量。结果显示,BT △scpA-mutA组的细菌裂解液和上清液中均未检测到丙酸,而BT WT组检测到丙酸;且用 scpA-mutA 基因对 BT △scpA-mutA菌进行互补则恢复了产生丙酸的能力。在体内实验中,用 BT WT 株系或 BT △scpA-mutA株系对抗生素(ABXs)处理过的小鼠进行体内定植。与预期一致,BT WT 组小鼠的粪便丙酸水平在定殖后 4 天显著升高,而BT △scpA-mutA组的粪便丙酸水平则显著降低,与PBS 对照组相当。总之,BT在体外和体内产生丙酸均需要 MCM酶活性(图1)。
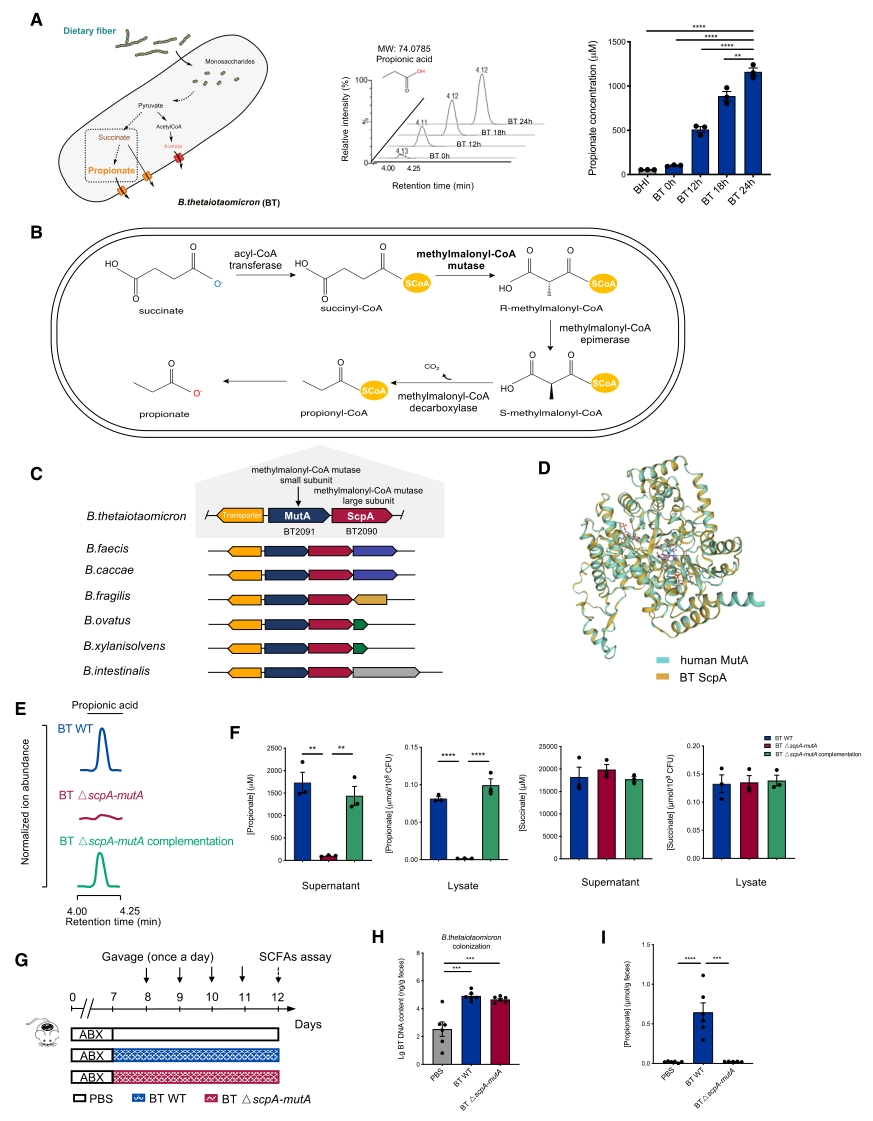
图1. BT菌的MCM基因缺失导致体外和体内丙酸降低
2. 单细胞转录组测序聚焦基因和通路
为论证BT MCM对宿主的影响,研究人员借助无菌小鼠单菌定植模型(BT WT定植组 和 BT △scpA-mutA定植组以及PBS对照组)对结肠组织单细胞转录组测序,通过聚类将单细胞图谱划分为7个亚群。差异表达分析表明,与对照组相比,BT WT 组的肠上皮细胞中231个基因上调,339个基因下调;且Muc2、Fcgbp等与机体防御相关的基因表达,以及与细胞连接组装、细胞黏附调节等相关的通路均显著上调,而BT △scpA-mutA突变菌株对应基因和通路则变化不显著。总之,BT WT 可加强上皮细胞的细胞连接和黏附调节,而这依赖BT MCM 的活性(图2)。
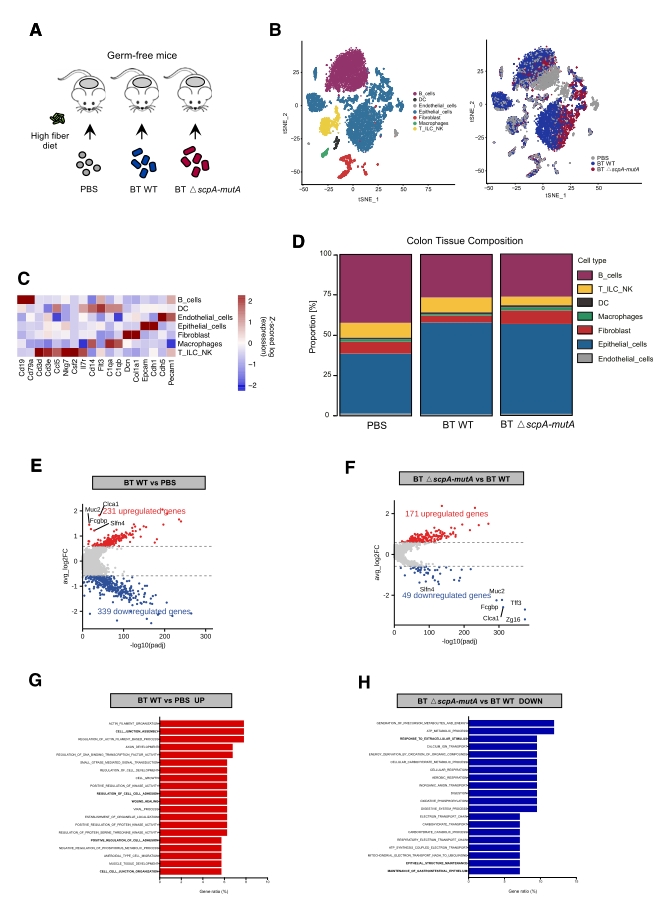
图2 . BT及突变菌的体内定植导致结肠上皮的组成和功能改变
进一步分析发现,BT WT菌定植小鼠的结肠杯状细胞数目占比、黏蛋白分泌水平显著增加,结肠杯状细胞亚群的分化程度也更趋成熟,编码粘液层主要成分的muc2、tff3、fcgbp和clca1的基因在BT WT组中表达显著上调。而在BT △scpA-mutA组中则无此效应。此外,BT WT 组结肠中与杯状细胞相关的转录因子(TF):muc2和spdef的mRNA表达水平也显著升高。总之,BT促进杯状细胞的分化和粘液的形成,而这种效应需要BT MCM的活性(图3)。
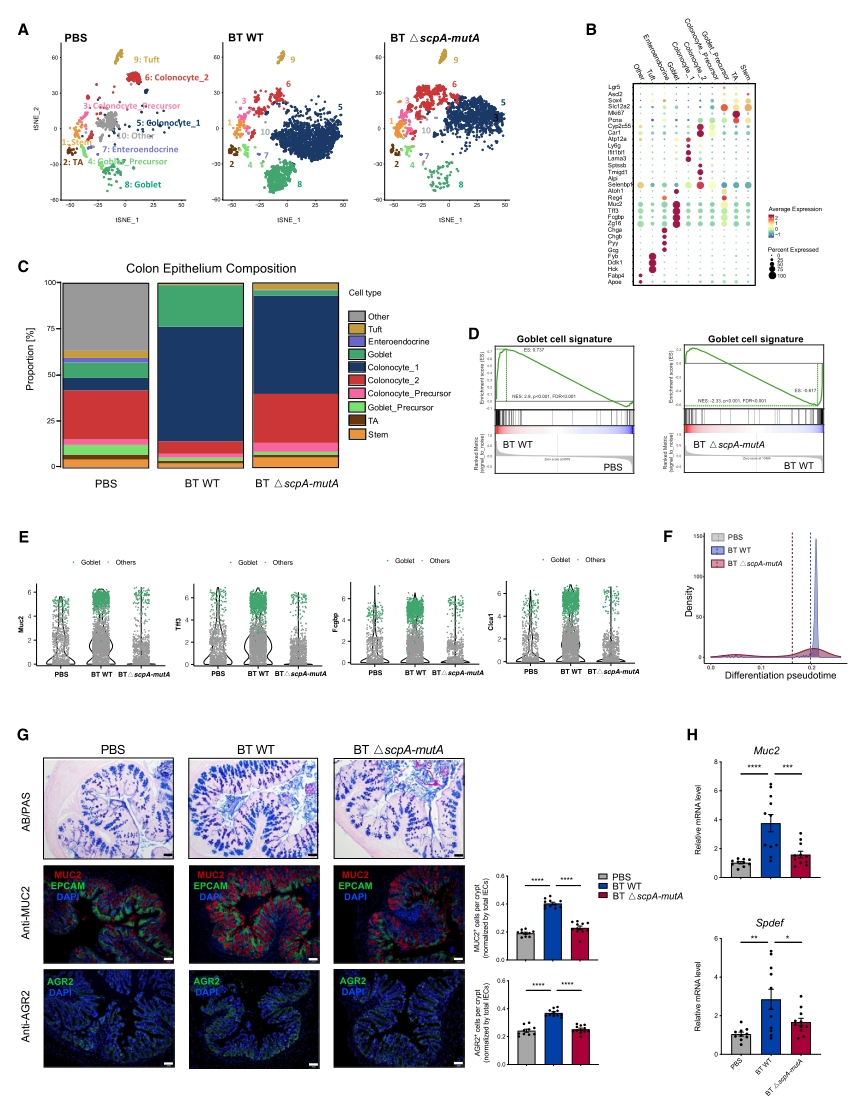
图3. BT菌促进杯状细胞分化和粘液分泌,且取决于MCM的活性
为了确定BT MCM介导的丙酸生物合成如何促进了杯状细胞数量的增加,随后探究了杯状细胞的分化轨迹,即从转运扩增细胞(TA)周围的干细胞开始,逐渐分化成杯状前体细胞和成熟的杯状细胞。接着,对三组干细胞进行单细胞调控网络推断和聚类(SCENIC)转录调控子分析,结果显示,在 WT BT组中,几种常见 TFs 的活性显著上调,包括spdef、klf4、hnf4a、nfat5、creb3l1、xbp1和 ehf,这些都是肠杯状细胞分化、成熟和发育所必需的。此外,BT WT培养上清能诱导klf4、spdef、creb3l1、hnf4a和nfat5以及上消化道细胞末端分化有关的上消化道细胞特异性标记基因,如muc2、muc1和fcgbp的表达,而BT △scpAmutA组上清则失去此诱导功能。丙酸也以剂量依赖的方式诱导这些基因的表达。这表明,MCM酶是BT诱导上皮细胞分化关键TFs表达的必要条件。
3. 丙酸受体激动剂处理验证
已报道丙酸是通过与G蛋白偶联受体GPR43和GPR41结合或抑制组蛋白去乙酰化酶(HDAC)来发挥其功能的。为了确定丙酸调控杯状细胞发育的基本途径,将常用的杯状细胞模型LS 174T细胞系分别与GPR41激动剂AR420626、GPR43激动剂4-CMTB和HDAC抑制剂TSA孵育。结果显示,只有AR420626能够模拟BT WT上清液和丙酸的作用,增强LS 174T细胞中Spdef、Klf4等与杯状细胞分化相关的转录因子以及Muc2、Fcgbp等杯状细胞功能基因的表达。推测GPR41激活可能是BT MCM活性介导的丙酸产生作用于杯状细胞分化的潜在途径(图4)。
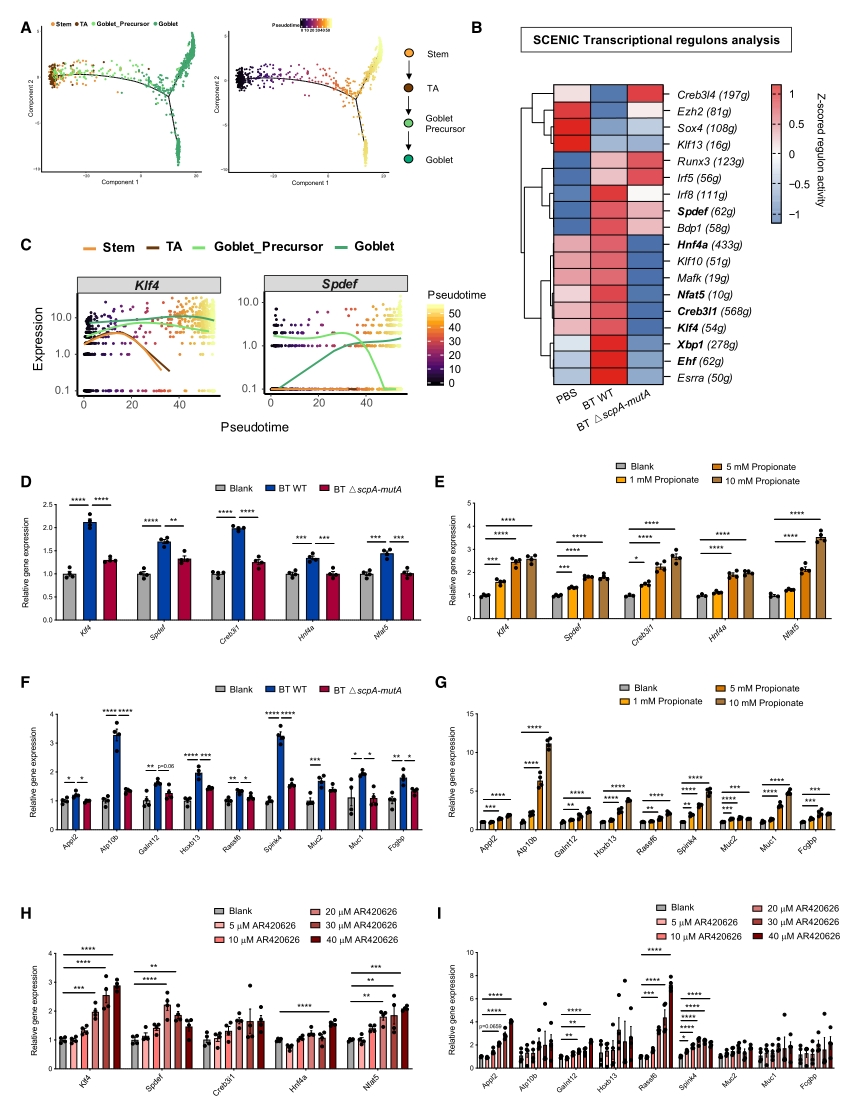
图4. BT MCM介导的丙酸生成和丙酸受体GPR41激活诱导上皮细胞分化
4. 类器官模型验证
为了进一步证实BT MCM-丙酸-GPR41轴对肠道上皮细胞分化的作用,研究人员培养了WT和Gpr41-/-小鼠的肠道类器官组织,并用BT上清或丙酸处理。结果显示,用BT WT组上清,而非BT △scpA-mutA组上清处理可诱导肠管细胞分化,在用丙酸刺激的肠道类器官组织中也观察到了这种促进作用。此外,在用BT WT上清或丙酸培养的肠道类器官组织中,MUC2的表达也被显著诱导,但在用BT △scpA-mutA组上清处理的器官组织中未被诱导,证实了BT MCM和丙酸对杯状细胞分化的促进作用。且这种作用在Gpr41-/-小鼠的肠道类器官组织中被大大削弱(图5)。
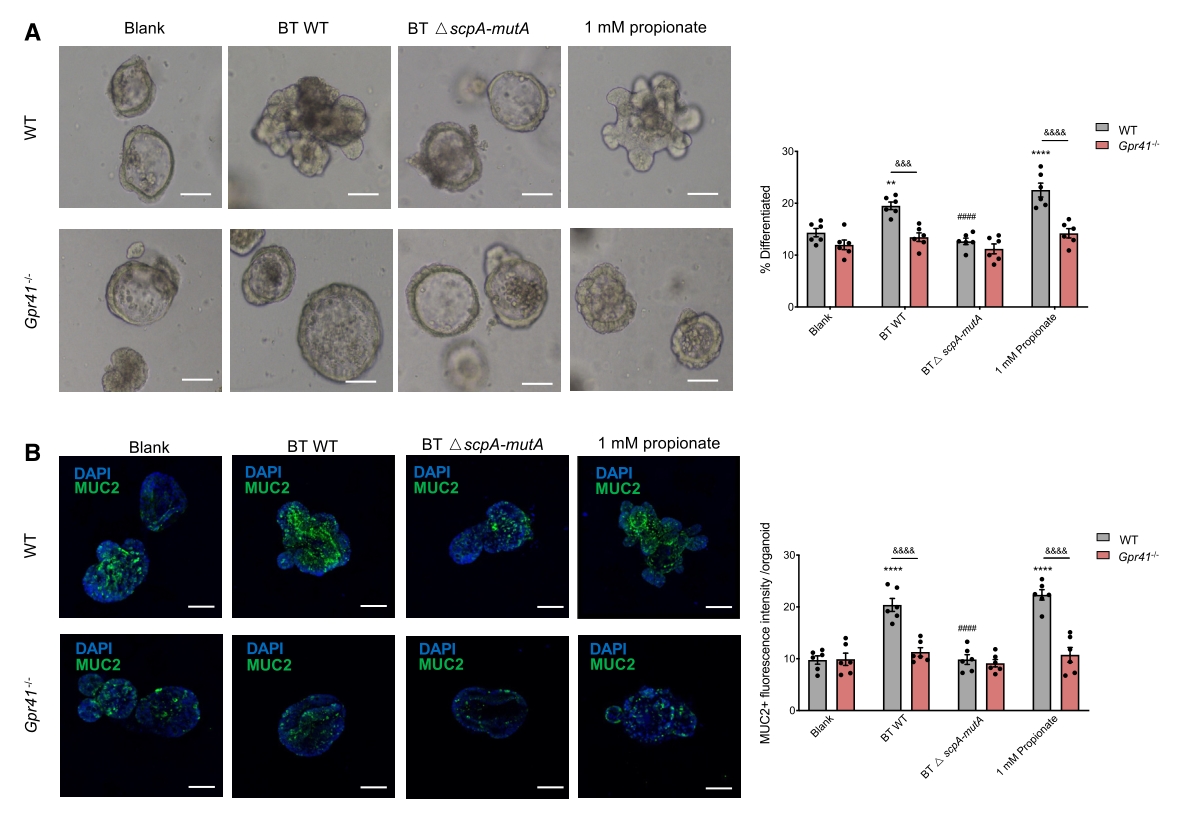
图5. BT MCM介导的丙酸生成可部分通过GPR41诱导肠组织细胞分化
5. DSS诱导的结肠炎模型验证
葡聚糖硫酸钠盐(DSS)通过损害肠上皮完整性和黏膜屏障稳态可诱导小鼠结肠炎。在DSS诱导的小鼠急性结肠炎模型中,BT WT处理的DSS小鼠体重下降不显著,显著缓解小鼠的结肠炎症状,增加肠道杯状细胞数目;修复黏膜屏障功能。而BT △scpA-mutA处理则无此保护功能,但补充丙酸可恢复保护功能。此外,对人群宏基因组数据的分析发现,与健康对照组相比,IBD患者肠道宏基因组中BT MCM同系物的相对丰度和出现频率均显著降低,表明BT MCM基因与人类IBD呈负相关,提示BT MCM可参与调节人类IBD的发生(图6)。
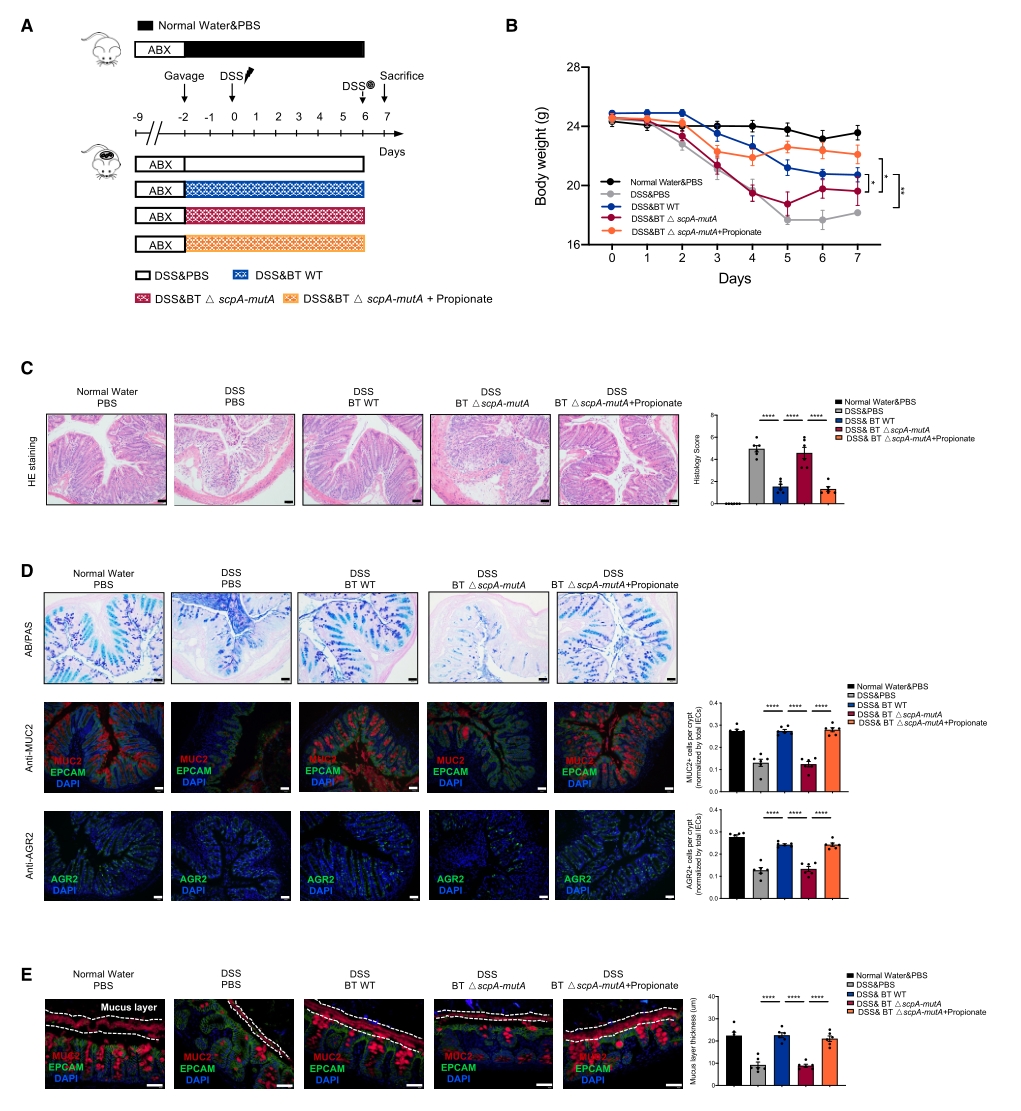
图6. BT MCM介导的丙酸生成可缓解DSS诱导的小鼠结肠炎
6. 小结
本研究通过代谢组检测、单细胞测序、类器官模型等手段,鉴定并功能验证了肠道多形拟杆菌中负责丙酸合成的关键酶MCM,证明BT MCM介导的丙酸合成通过GPR41促进宿主肠道杯状细胞分化、黏液分泌,并可缓解DSS诱导的小鼠急性结肠炎症状,为炎症性肠病等肠道屏障损伤相关疾病的预防治疗提供了新的靶标和途径。
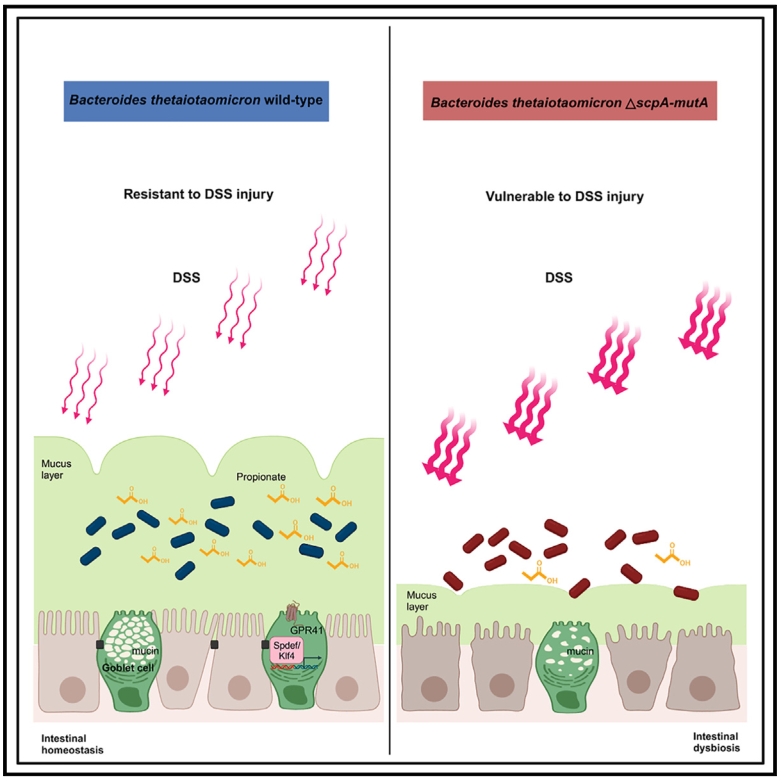
研究小结
参考文献
Bacteroides methylmalonyl-CoA mutase produces propionate that promotes intestinal goblet cell differentiation and homeostasis. Cell Host and Microbe. 2023.

绘谱帮你测
麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。针对胃肠道炎症性疾病、结直肠癌、2 型糖尿病、肥胖症和多发性硬化症等多种慢性炎症性疾病,麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章300+篇,累计影响因子3000+,平均IF> 10,包括Science, Nature, Cell Metabolism,Immunity, Gut, Hepatology, Microbiome等顶级期刊。


