文献解读
Nature Communications | 氨基酸异常摄取促进肿瘤免疫逃逸
骨肉瘤是最常见的原发性骨恶性肿瘤,目前标准化的治疗方案为根治性手术联合新辅助及辅助化疗。尽管化疗提高了总体生存率,但骨肉瘤患者的临床预后仍不理想。化疗耐药和免疫逃避已成为骨肉瘤治疗的主要挑战,寻找更有效的策略是提高患者生存率的首要工作。

2022年10月23日,浙江大学医学院的叶招明团队在国际知名期刊Nature Communications上正式发表了题为“Metabolic control of CD47 expression through LAT2-mediated amino acid uptake promotes tumor immune evasion”的研究性文章。团队发现CD47在骨肉瘤中因化疗而上调,并与患者死亡率相关。从机制上讲,化疗促进巨噬细胞分泌白细胞介素 (IL)−18,致肿瘤细胞中 LAT2 (L-type amino acid transporter 2) 表达上调,从而增强肿瘤免疫设想的谷氨酰胺(Gln)和亮氨酸(Leu)摄取以及 mTOR 活性依赖的CD47表达。
背景介绍:L型氨基酸转运体(LATs)是中性氨基酸(如谷氨酰胺和亮氨酸)的主要的不依赖钠离子的运输系统。到目前为止,已经发现了四种LATs (LAT1、LAT2、LAT3和LAT4)。
化疗诱导CD47上调,导致患者预后不良
免疫组化分析表明,骨肉瘤患者化疗后CD47(免疫检查点)蛋白水平显著增加。在四种常用化疗药物中,顺铂和阿霉素组骨肉瘤中 CD47 mRNA 和蛋白水平明显上调;并通过流式细胞术进行了验证。临床评估发现,化疗前后CD47高表达的患者总生存期(OS)和无病生存期(DFS)都更差,表明化疗会诱导骨肉瘤细胞的CD47 上调,导致预后不良。
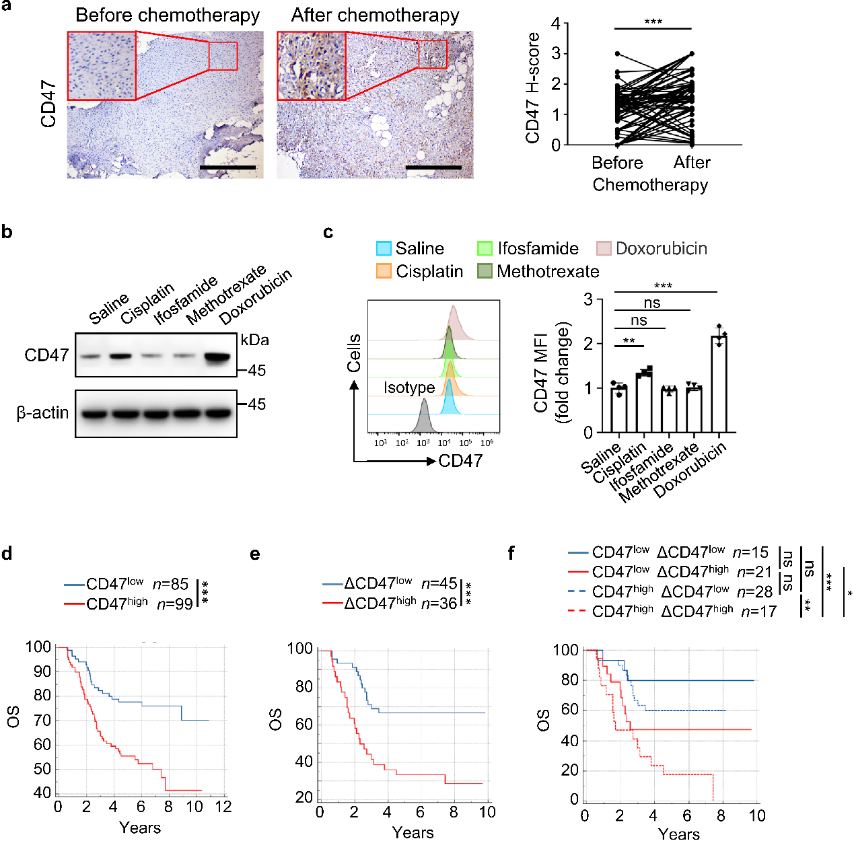
图1. 骨肉瘤化疗诱导CD47上调,这与患者预后不良相关
骨肉瘤中阿霉素诱导的CD47上调依赖于肿瘤相关巨噬细胞的激活
团队使用阿霉素进行处理,发现处理时间、处理剂量以及骨肉瘤细胞系都不能影响CD47的表达,表明阿霉素诱导的CD47上调依赖于肿瘤微环境。流式细胞术分析表明,阿霉素处理上调肿瘤抑制巨噬细胞 (M1)标记物MHC-II、iNOS和CD86,并下调选择性激活的肿瘤促进巨噬细胞 (M2)标记物Arg1和CD206。RT-PCR证实M1标记物Nos2、Cd80和Cd86表达增强, M2标记物Arg1和Cd206表达降低。这些结果表明,阿霉素处理可激活M1型巨噬细胞(引起免疫促进)。
GEO分析表明CD47表达与M1标记CD80表达、M1 丰度呈正相关;在有效治疗的骨肉瘤队列中,CD47高表达患者同样表现出较高的M1丰度。通过氯膦酸盐脂质体(Clod)耗尽巨噬细胞,结合IHC 染色和流式细胞术证实CD47表达有所降低,说明巨噬细胞对CD47的高表达是必需的。在两种肿瘤细胞与巨噬细胞共存体系中,阿霉素处理导致相似的CD47上调水平,表明巨噬细胞分泌的可溶性因子具有重要作用。团队以二甲基亚砜 (DMSO)和阿霉素处理构建细胞培养体系,发现只有阿霉素处理后才能在HOS(人骨肉瘤细胞)、SJSA-1和U-2 OS细胞中检测到CD47表达的明显诱导;伴随巨噬细胞吞噬作用抑制,添加CD47抗体后可消除这种抑制,并显著增强吞噬作用。上述结果表明,阿霉素与骨肉瘤细胞因子结合激活巨噬细胞致其分泌可溶性因子上调CD47表达,从而抑制巨噬细胞的吞噬作用。
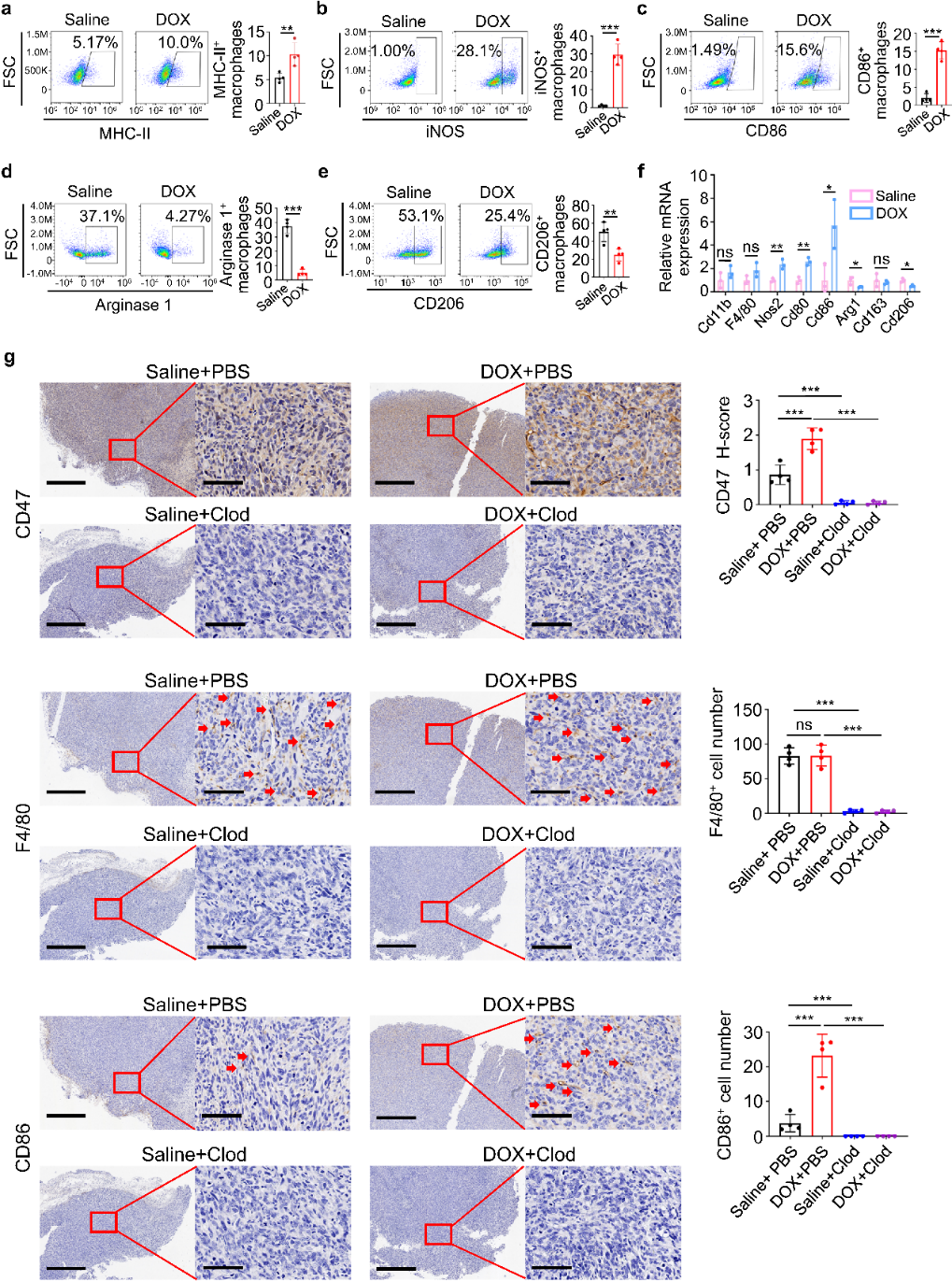
图2. 骨肉瘤中阿霉素诱导的CD47上调依赖于肿瘤相关巨噬细胞的激活
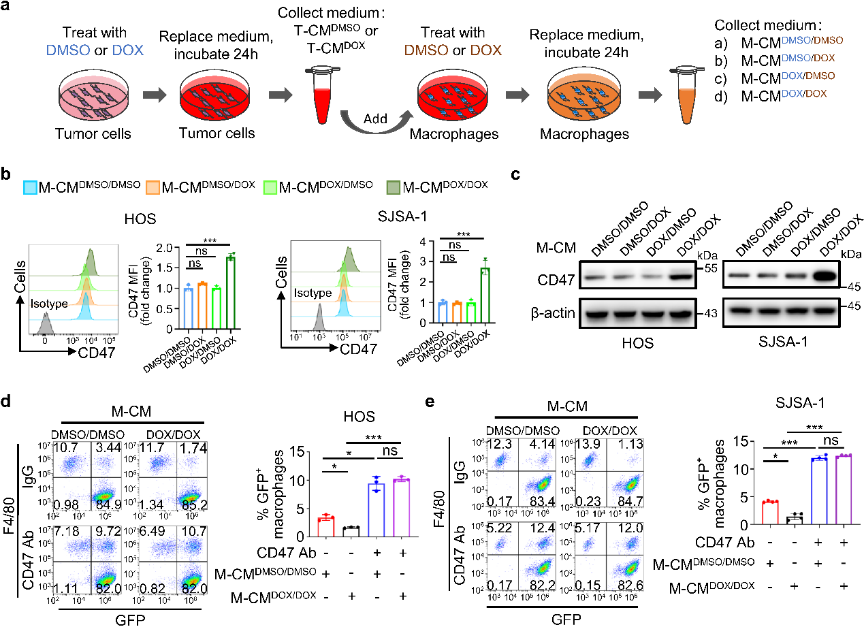
图3. 阿霉素诱导的巨噬细胞分泌因子促进骨肉瘤CD47表达,从而抑制巨噬细胞吞噬作用
巨噬细胞分泌的IL-18诱导骨肉瘤细胞中CD47的表达
基于GSEA和KEGG分析,细胞因子量M-CMDOX/DOX分析显示IL-1ra和IL-18的量升高;然而只有IL-18处理HOS或SJSA-1细胞才能诱导CD47 mRNA和蛋白的上调,伴随细胞吞噬作用的抑制,使用CD47抗体后可逆转该过程。与此一致,阿霉素诱导的IL-18上调可被Clod介导的巨噬细胞消耗所消除。同时,骨肉瘤细胞系中IL18R1的mRNA水平显著增高,显示相比于正常骨细胞其对IL-18更敏感。这些结果表明,阿霉素诱导的巨噬细胞活化增加了IL-18分泌,导致骨肉瘤细胞CD47表达上升。
将天然拮抗剂IL-18BP加入到M-CMDOX/DOX后,其与IL-18的亲和力显著高于IL-18R,能明显降低CD47表达并恢复巨噬细胞对HOS细胞的吞噬作用;IL18消除也具有类似效果。肿瘤组织(HOS 来源)分析表明,阿霉素可增加巨噬细胞M1极性活化、IL-18分泌和CD47表达;瘤内注射IL-18BP大大降低了CD47表达;联合阿霉素治疗后更是显著增加巨噬细胞浸润,激活了M1极性的巨噬细胞并抑制肿瘤生长。敲低IL18R1也有相似效果。这些结果表明,阿霉素增强的M1巨噬细胞活化增加了IL-18分泌和CD47表达,导致巨噬细胞的吞噬作用被抑制。随后团队就这一结论在临床数据上进行了确认。
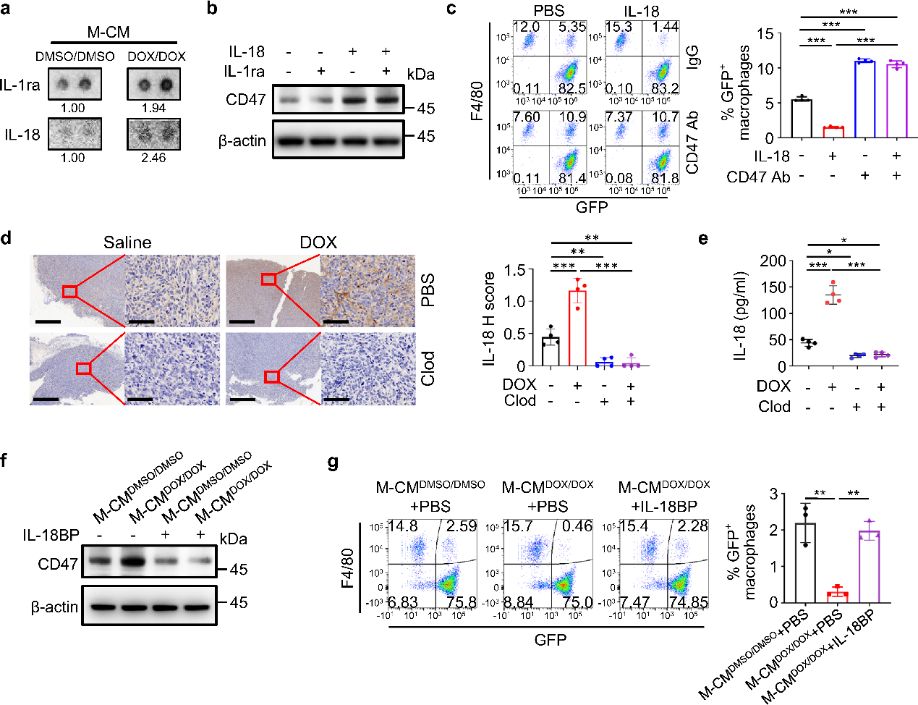
图4. 巨噬细胞分泌的IL-18诱导骨肉瘤细胞中CD47的表达
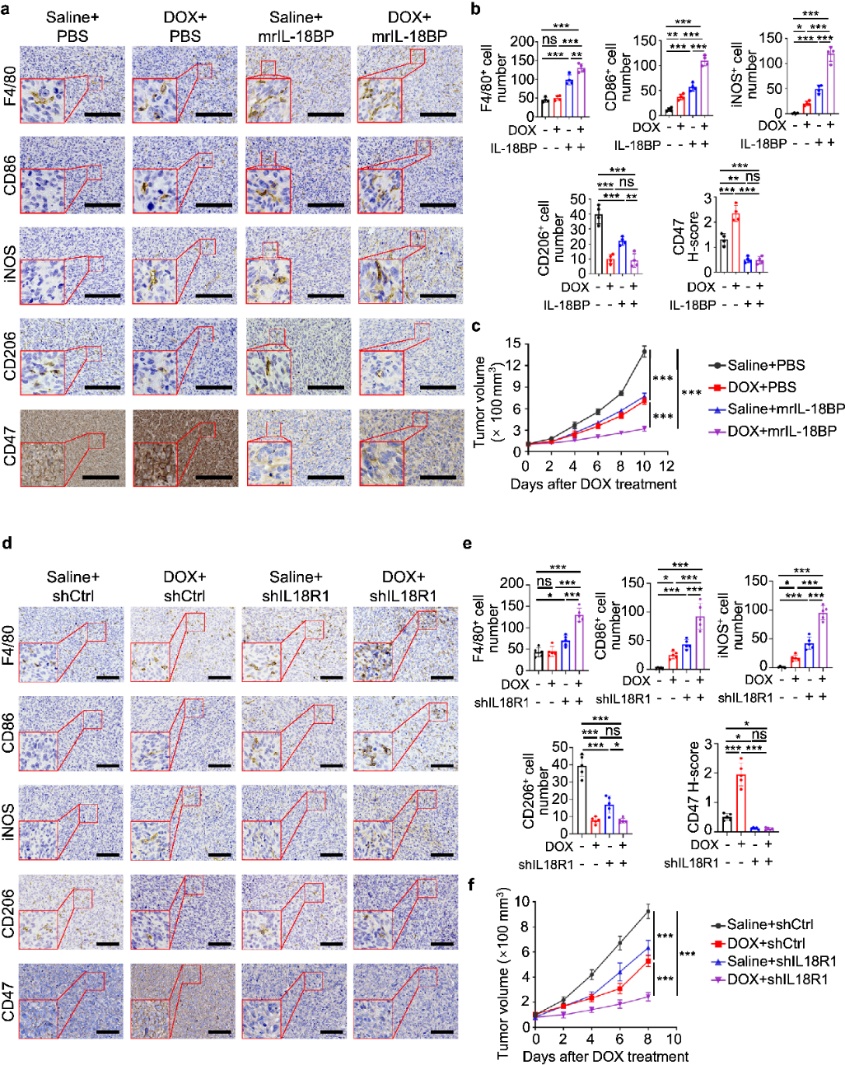
图5. IL-18 阻断使骨肉瘤对阿霉素处理敏感
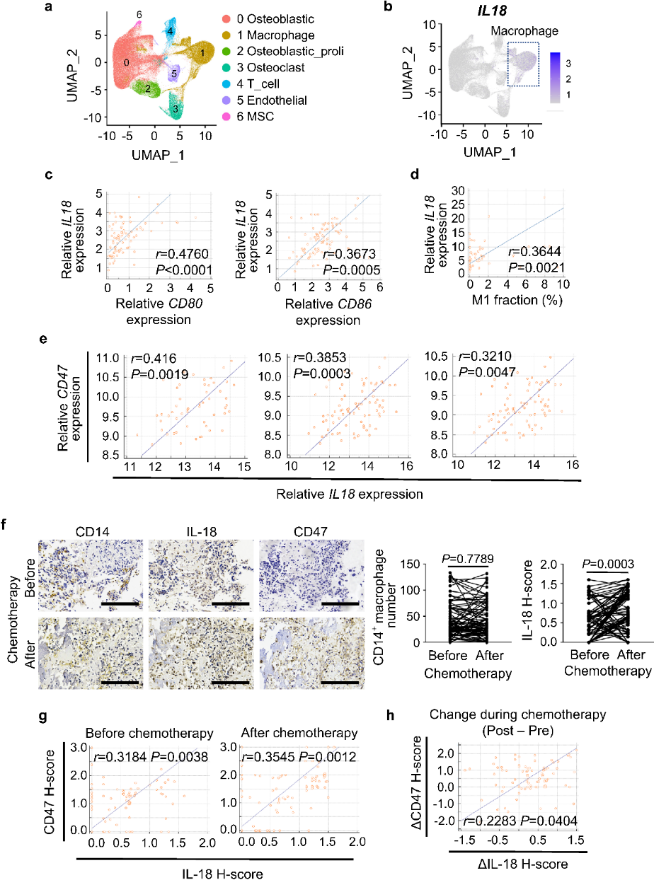
图6. 骨肉瘤患者中IL-18表达与CD47表达呈正相关
氨基酸转运蛋白LAT2介导的氨基酸摄取对于骨肉瘤细胞中IL-18诱导的CD47表达是必需的
基于数据库和文献报道,团队使用IL-18处理 HOS细胞,发现 LAT2的mRNA和蛋白表达显著上调,4F2HC的mRNA表达增加;通过LAT2基因沉默或特异性抑制剂(BCH)均能显著降低IL-18诱导的CD47表达、消除巨噬细胞吞噬作用。这些结果表明,LAT2参于IL-18上调CD47表达以及对巨噬细胞吞噬作用的抑制过程。IHC分析显示,骨肉瘤患者化疗后LAT2 表达显著增加,表现出较差的总生存率和无病生存率。同时,化疗增加的LAT2表达量与IL-18、CD47表达变化呈正相关。使用UPLC-MS/MS对氨基酸进行定量检测,发现IL-18处理导致HOS细胞中的氨基酸明显增加,在LAT2沉默后减少。IL-18和氨基酸对CD47的上调都是必不可少的。
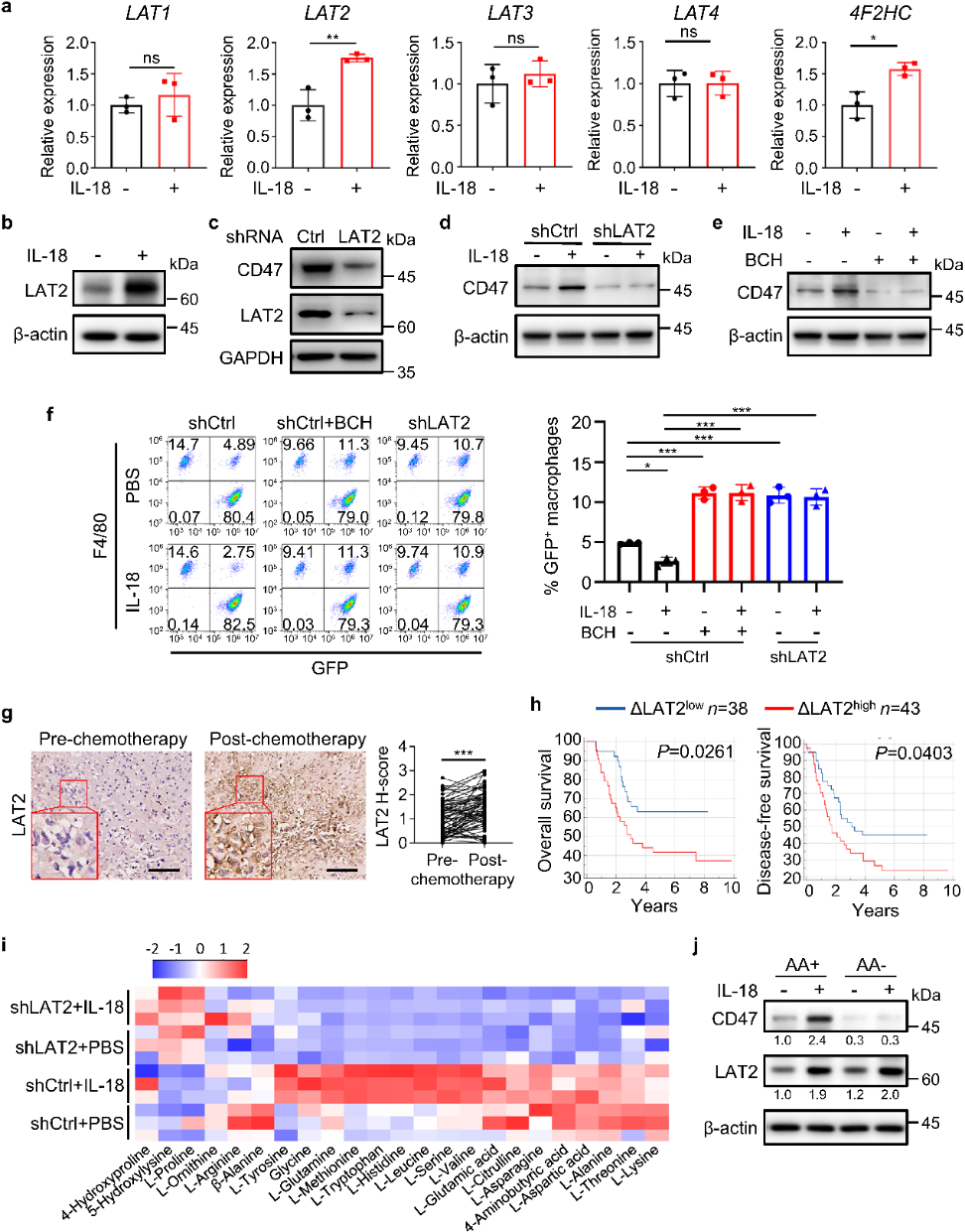
图7. LAT2介导的氨基酸摄取对骨肉瘤细胞中IL-18诱导的CD47表达是必需的
IL-18增强和LAT2介导的Gln和Leu摄取通过激活mTORC1/c-Myc轴促进CD47表达
团队发现,培养基中剥夺Gln或Leu会抑制IL-18诱导的CD47表达,并减轻IL-18诱导的吞噬作用抑制;补充后可消除抑制,并且增加了mTORC1底物S6K磷酸化和c-Myc (一种原癌基因,激活后的C-myc基因会大量表达myc蛋白,能够促进细胞恶性转变) 表达水平,使用IL-18处理也观察到该现象。使用mTORC1或c-Myc抑制剂处理后能显著降低IL-18诱导的CD47表达,消除巨噬细胞的吞噬抑制。相反,c-Myc过表达诱导CD47的表达并减少HOS细胞的吞噬作用。这些结果表明,IL-18增强的Gln和Leu摄取激活mTORC1/c-Myc轴——是IL-18诱导CD47表达和巨噬细胞吞噬抑制所必需的。
即使IL-18存在,LAT2耗竭也能阻断Gln和Leu诱导的CD47表达,降低mTORC1激活和c-Myc表达。c-Myc过表达能克服LAT2的影响,诱导CD47表达并减少HOS细胞的吞噬作用。这些结果表明,LAT2 介导的Gln和Leu摄取对于IL-18诱导的mTORC1激活和CD47上调的c-Myc表达是必不可少的。
c-Myc耗竭降低了肿瘤组织中基础和阿霉素诱导的CD47表达。与阿霉素处理或单独去除MYC相比,将MYC去除与阿霉素处理相结合抑制肿瘤生长更明显,巨噬细胞浸润增加,并增强M1表型巨噬细胞的活化。这些数据表明c-Myc抑制使骨肉瘤对阿霉素处理敏感。
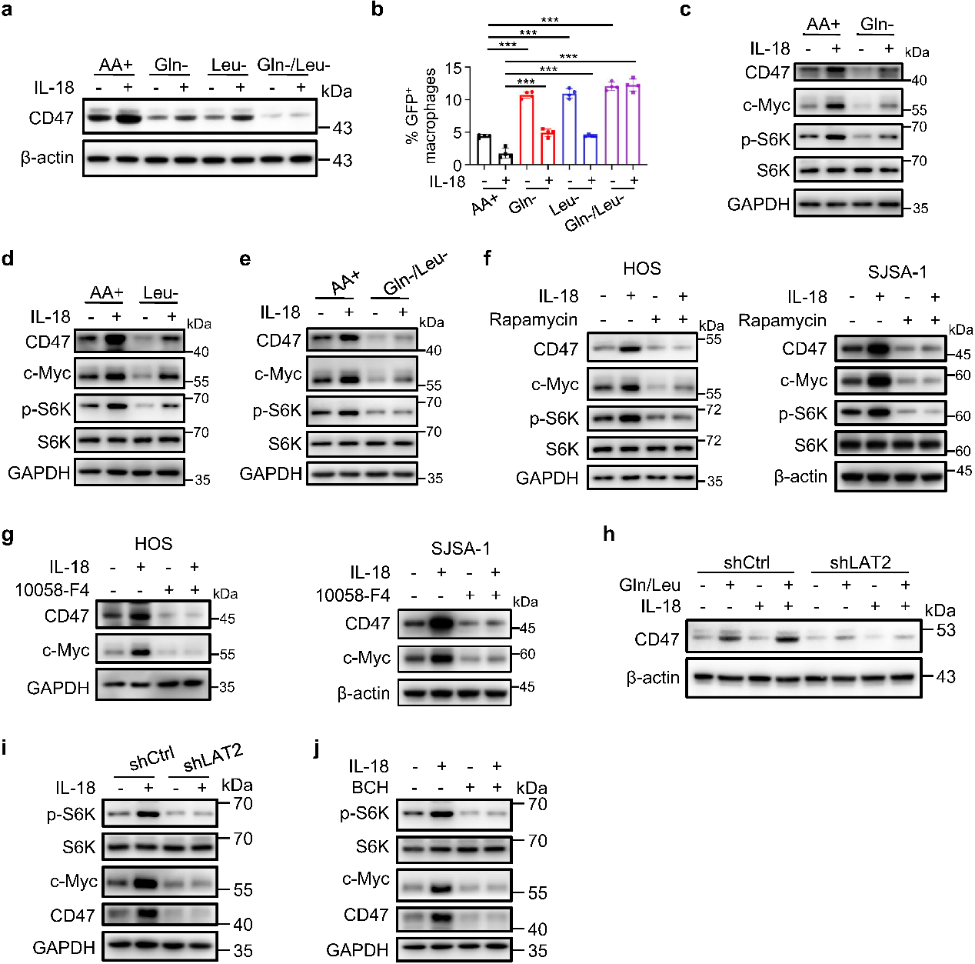
图8. IL-18增强和LAT2介导的Gln和Leu摄取通过激活mTORC1/c-Myc轴促进CD47表达
LAT2抑制使骨肉瘤对阿霉素敏感
团队将LAT2耗尽的HOS细胞注射到裸鼠体内并用阿霉素处理,观察到肿瘤基础和阿霉素诱导的CD47表达降低。LAT2去除与阿霉素处理的联合对肿瘤抑制更明显,巨噬细胞浸润增加,M1表型巨噬细胞活化增强。使用Clod消耗巨噬细胞则降低了联合治疗的功效。通过BCH的联合治疗得到与上述一致的结果。这些数据表明,抑制LAT2通过增加巨噬细胞的吞噬作用使骨肉瘤对阿霉素处理敏感。BCH处理引起的CD47蛋白下降与CD47抗体相当,两者表现出相似的肿瘤生长抑制。阿霉素和CD47抗体的联合,与阿霉素和BCH联合治疗,这两者对骨肉瘤的抗癌作用相当。
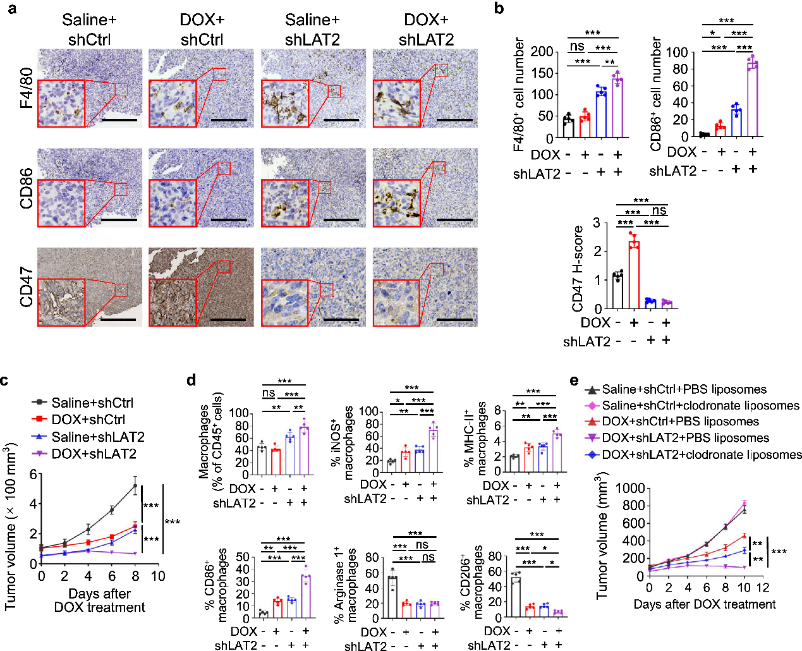
图9. LAT2缺失使骨肉瘤对阿霉素处理敏感
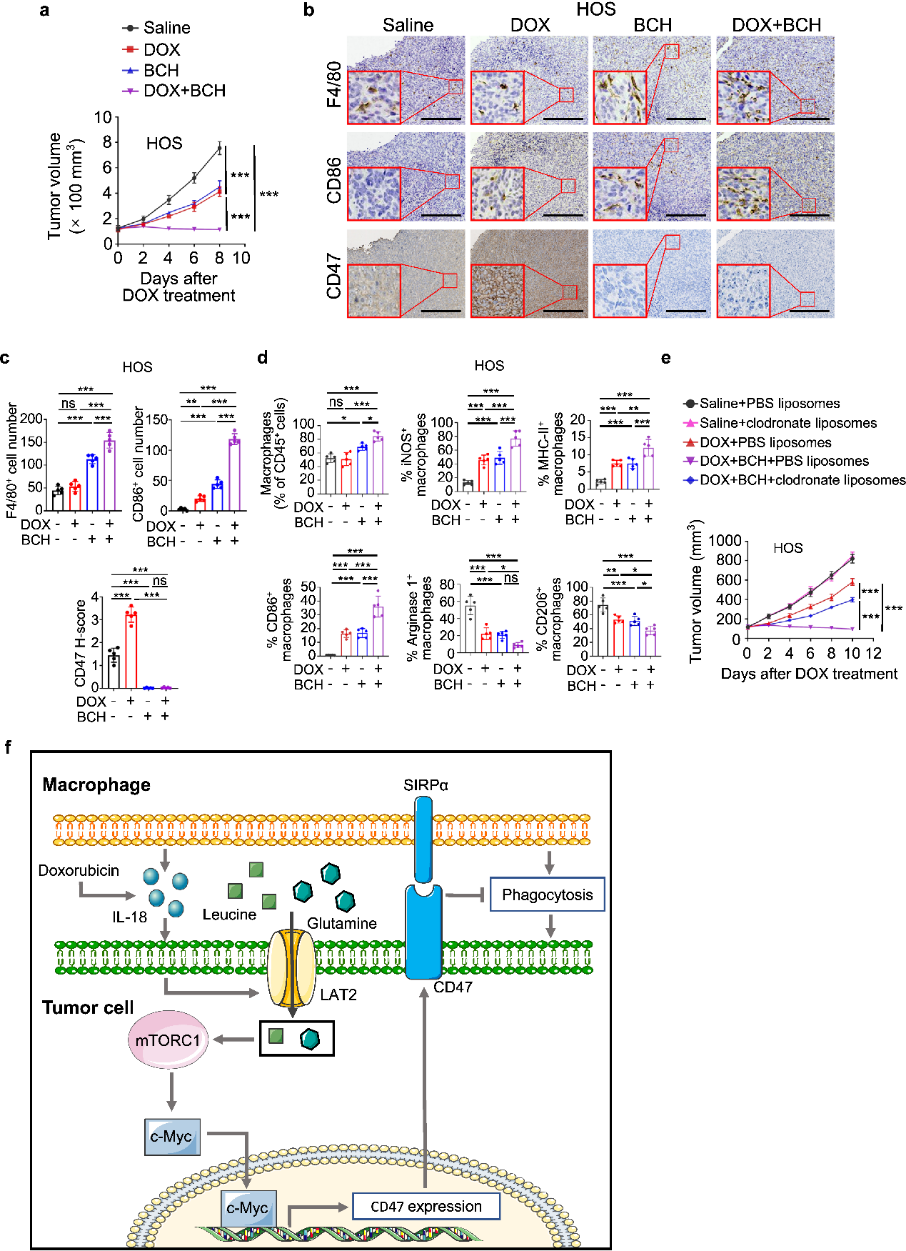
图10. BCH使骨肉瘤对阿霉素处理敏感
小结
越来越多的证据表明肿瘤氨基酸代谢和癌症免疫之间存在相互关联。该研究结合靶向代谢组学,观察到骨肉瘤细胞的巨噬细胞吞噬作用随Gln和Leu的缺乏而增加,揭示了氨基酸在巨噬细胞介导的肿瘤免疫中的作用。本研究充分利用开源数据和实验结果,证实了化疗的潜在副作用:化疗激活肿瘤相关巨噬细胞分泌IL-18,诱导骨肉瘤细胞LAT2表达及对Gln和Leu的摄取,激活mTORC1/c-Myc信号传导并表达CD47,导致针对骨肉瘤细胞的巨噬细胞吞噬作用受到抑制,并致骨肉瘤患者不良预后。该研究再次强调了免疫细胞在获得性化疗耐药中的作用。此外,考虑到临床已有的CD47靶向治疗策略会引起贫血症状,该研究还提出了新的治疗策略——通过抑制LAT2减少CD47表达,并强调了BCH等LAT2小分子抑制剂在消除CD47介导的肿瘤逃逸方面的潜力。
参考文献
Metabolic control of CD47 expression through LAT2-mediated amino acid uptake promotes tumor immune evasion. Nature Communications. 2022.
请扫描二维码阅读原文

绘谱帮你测
在许多癌症中,氨基酸的摄取和代谢异常上调,以满足肿瘤细胞快速生长和增殖的需求。通过靶向代谢组学,本研究观察到氨基酸的异常累积,并在随后的实验中确认了谷氨酰胺和亮氨酸的重要性。针对氨基酸谱,麦特绘谱支持42种相关物质的绝对定量检测(LC-MS/MS),可与其它指标进行联合分析。
此外,以全定量靶向代谢组学技术为核心,以代谢组学与转化医学疾病研究领域为方向,麦特绘谱深耕多年累积了全球独有技术Q1000、Q300、Q200和各类小分子代谢物单独检测方法共20多套;同时,还有菌群16S测序、宏基因组学、转录组学和蛋白质组学等多组学,及联合分析在内的全套解决方案。优选的检测技术、全面的数据报告及专业的售后探讨,助您科研探索之路不断创新和突破。详情请咨询绘谱热线400-867-2686,获取详细资料!
·END·
往期回顾
1. 客户案例 | npj Parkinson’s Dis:帕金森患者血浆氨基酸紊乱与肠道菌群变化相关
2. Nature Reviews | 靶向肿瘤代谢的精准治疗
3. Cell Metabolism | 异亮氨酸和缬氨酸介导支链氨基酸的不良代谢效应
5. Cell Metabolism | 氨基酸如何支持免疫(下)
6. Cell Metabolism | 氨基酸如何支持免疫(上)



