文献解读
客户案例 | PNAS:β-arrestin 1在介导胃癌细胞代谢和增殖中的双重作用
β-Arrestin 1(ARRB1)被认为是G蛋白偶联受体(GPCR)信号传导的关键负调控因子,通过与激活和磷酸化的GPCR形式结合,导致信号脱敏和受体内化。在过去的十年中,研究发现ARRB1本身也作为一个信号传感器,通过作为各种信号通路的适配器蛋白,可以与不同的相互作用蛋白结合,发挥不同的生理功能。
ARRB1参与了多种癌症的增殖、侵袭,或通过适应于具有不同组织的癌症的不同机制转移,同时也观察到ARRB1对肿瘤抑制效果,体现出了双重作用。胃癌(GC)在全球范围内是第五常见的癌症,也是第四常见的癌症死亡原因,但ARRB1在GC中的确切功能尚不清楚。
2022年9月,北京大学肿瘤医院吴健民研究员团队、季加孚教授团队合作在国际学术期刊Proc Natl Acad Sci USA (PNAS)上发表题为“Dual roles of β-arrestin 1 in mediating cell metabolism and proliferation in gastric cancer”的论文,该研究通过临床队列、细胞功能和分子机制的综合分析,揭示了ARRB1在介导胃癌细胞代谢和增殖中的时空依赖作用,提示重新激活PKM2可能是胃癌患者的一种有前途的治疗策略。(麦特绘谱提供Q300全定量代谢组检测服务)

胃癌中ARRB1的表达与作用
研究人员首先通过胃癌(GC)临床样本(171例石蜡包埋胃癌标本和54对正常标本)研究发现,ARRB1 在肿瘤组织中的表达水平显著高于正常组织,并且ARRB1的高表达与胃癌患者的不良预后呈显著正相关。
为了评估ARRB1在GC中的功能,研究人员进一步利用5种患者来源的胃癌类器官模型进行功能研究,发现降低ARRB1表达可显著抑制胃癌类器官的增殖能力,这种降低在恢复ARRB1的表达后重新升高,表明ARRB1在GC中具有促进增殖的作用。进一步在类器官培养(7d)过程中,观察到ARRB1在不同时间点亚细胞定位的变化,从初期易位到细胞核中(从分离类器官再生开始),后期则大多定位于细胞质。
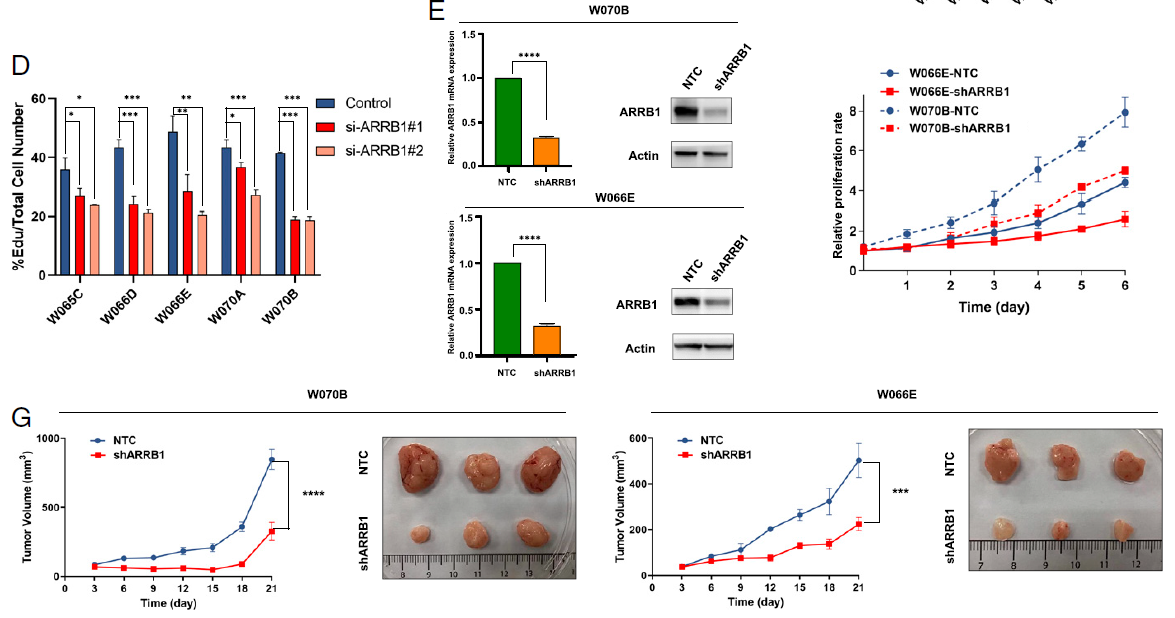
图1. ARRB1的敲低抑制了胃癌的增殖
ARRB1重编程GC细胞代谢
由于ARRB1的高水平表达与代谢相关通路基因的失调相关,研究人员进一步探讨了ARRB1在GC代谢中的作用。结果显示,在5个类器官模型中,ARRB1表达量较高的类器官显示基础糖酵解速率增加,而基础线粒体呼吸速率降低;此外,ARRB1基因敲低(shARRB1)导致糖酵解能力显著下降,并进一步通过靶向代谢组学分析(Q300全定量代谢组)证实其中糖酵解中间产物显著减少,TCA循环中间产物增加,而磷酸戊糖途径的代谢产物下调尤为显著;另外,shARRB1还导致NADP/NADPH比值升高。在GC中,ARRB1对能量代谢的调控可能独立于E2F1的调控。结果表明,细胞质ARRB1可以诱导GC中从线粒体氧化磷酸化到糖酵解的代谢重编程,以提供更多中间产物用于生物合成,来支持肿瘤细胞增殖的需求。
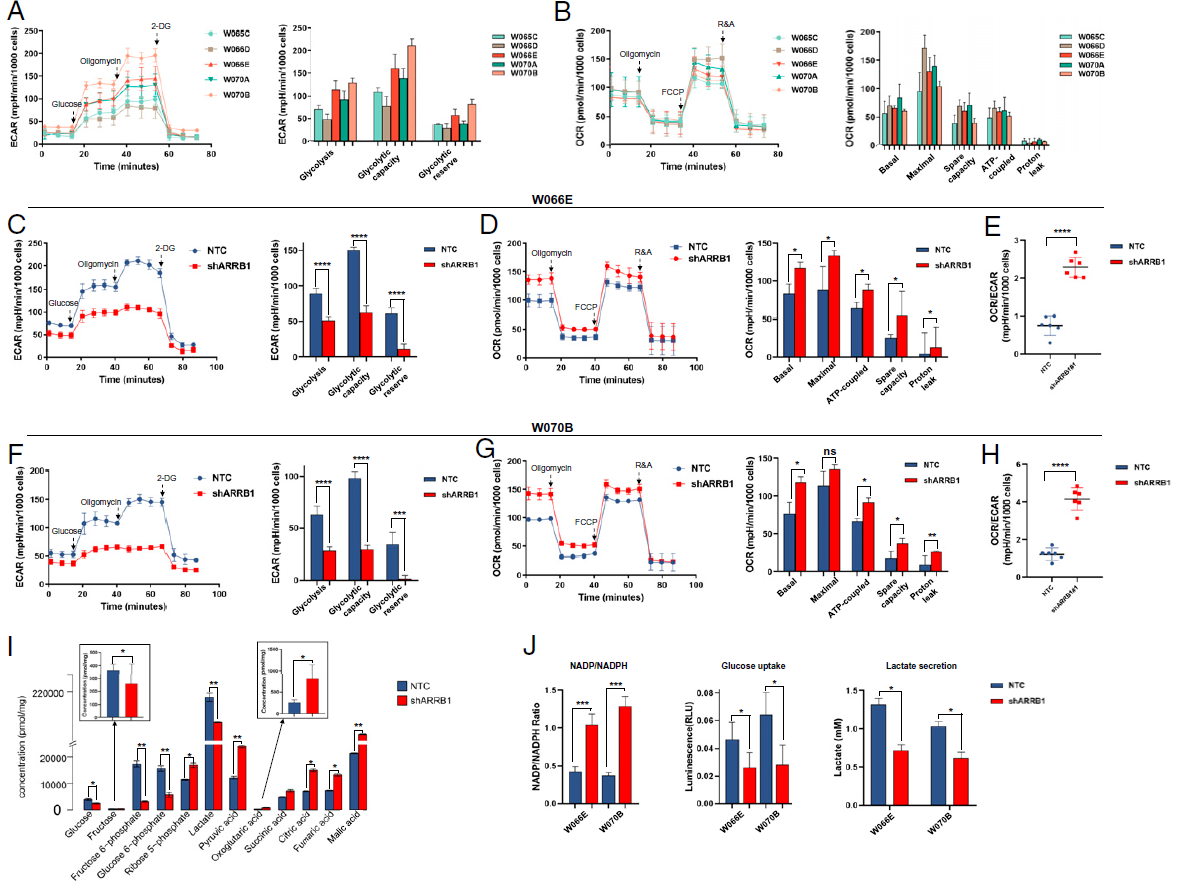
图2. ARRB1促进GC类器官糖酵解
ARRB1与PKM2相互作用,降低丙酮酸激酶活性
外近年研究表明,ARRB1 还有着独立的、作为多功能支架蛋白的作用,并且在不同组织来源的肿瘤中发挥了特异的功能,这些组织特异性的功能主要依赖于其结合的互作蛋白。为揭示ARRB1介导GC代谢重编程的作用机制,研究人员通过免疫共沉淀(co-IP)偶联质谱分析发现多个ARRB1的互作蛋白,其中PKM2是肿瘤代谢调节的关键酶,它通过将磷酸从磷酸烯醇式丙酮酸转移到ADP,产生ATP和丙酮酸,从而催化糖酵解的最后一步,调控着肿瘤细胞进行合成代谢或分解代谢的流向。研究人员通过coIP-WB、蛋白互作ELISA、邻位连接技术PLA等多重手段验证了ARRB1和PKM2的互作关系,并发现敲降ARRB1可显著恢复PKM2的激酶活性。
随后,类器官多个正交分析证明了ARRB1与PKM2的内源性相互作用,重新抑制PKM2显著恢复了ARRB1敲低的类器官的糖酵解能力,ARRB1与PKM2的结合通过干扰PKM2的单体-二聚体-四聚体平衡来降低其激酶活性,从而促进葡萄糖通量进入糖酵解,同时证实了在ARRB1和PKM2之间可能存在多个结合位点。
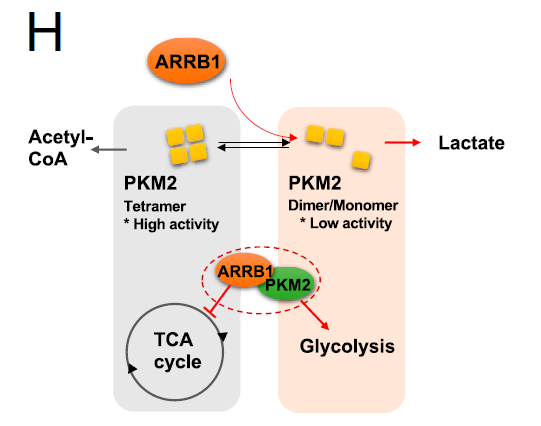
图3. ARRB1作为PKM2刺激代谢重编程的主要调节器
ARRB1高表达类器官对PKM2激活处理更为敏感
考虑到PKM2主要在增殖细胞中表达,特别是在迄今为止研究的肿瘤中。因此,研究人员探究了激活PKM2在GC中的治疗潜力。综合类器官和荷瘤小鼠模型的药敏实验发现,PKM2 激动剂DASA-58可有效消除ARRB1 对 PKM2 活性的抑制,并对肿瘤增殖有显著的抑制作用,特别是ARRB1 高表达的肿瘤对 PKM2 激动剂更加敏感。
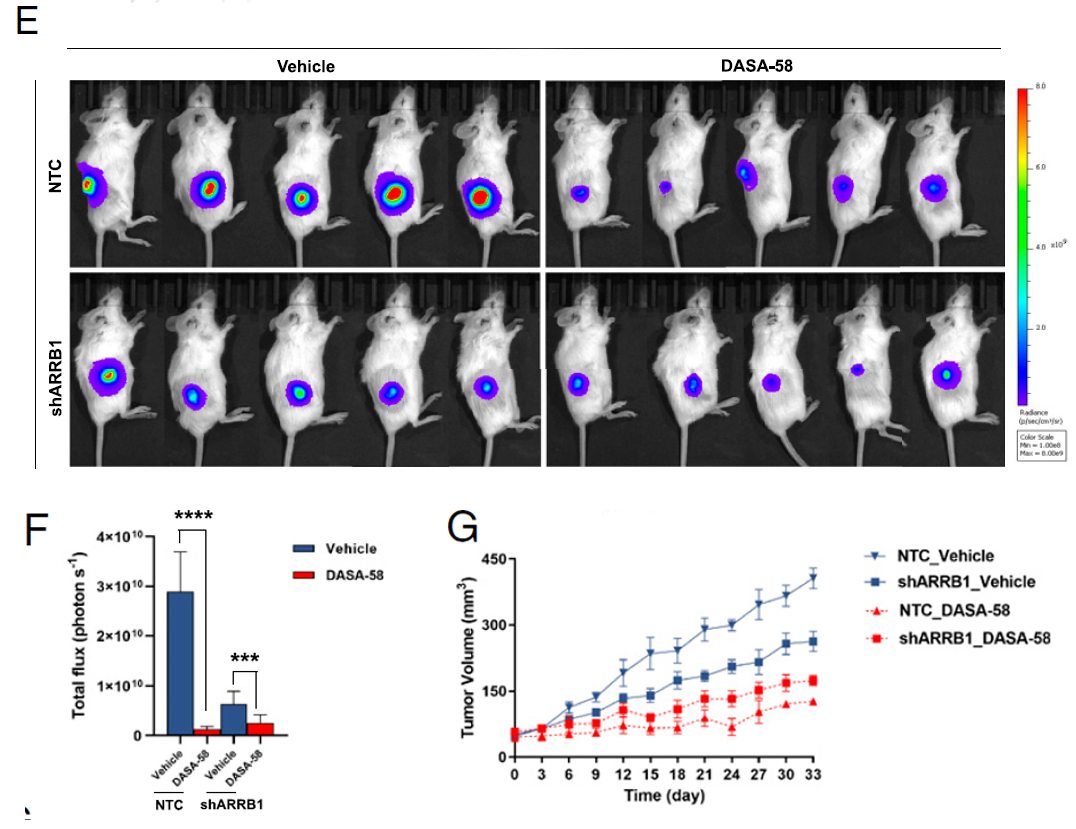
图4. 激活PKM2是ARRB1高表达胃癌的潜在治疗策略
小结
综上,本研究揭示了ARRB1在肿瘤代谢重编程中的调控作用和相关机制,并提示增强PKM2激酶活性可有效抑制ARRB1高表达导致的肿瘤细胞过度增殖,为进一步研究胃癌中复杂的ARRB1介导的信号通路提供了依据,并有助于靶向肿瘤代谢脆弱性的治疗策略的发展。
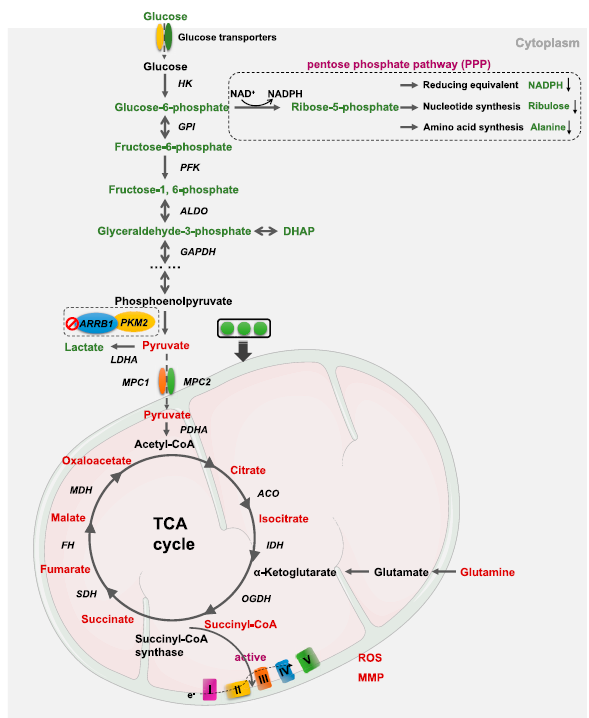
图5. ARRB1介导的胃癌细胞中糖酵解途径和TCA循环代谢产物改变
参考文献
Yu H, Wang M, Zhang T, et al., Dual roles of β-arrestin 1 in mediating cell metabolism and proliferation in gastric cancer. PNAS. 2022.
请扫描二维码阅读原文

绘谱帮你测
近年来,检测关注糖酵解途径和TCA循环的代谢变化已成为肿瘤及代谢性疾病机制研究的热门方向,本公司开发的经典Q300和代谢流技术手段可精确捕捉到这些代谢途径中所有小分子产物的细微改变。上述研究中靶向代谢组学是由我们提供的Q300全定量代谢组技术。目前Q300技术已助力客户在Gut、Advanced Science、Diabetes Care、Nature Communications、PNAS等期刊发表近60篇SCI文章,平均IF>9分。
麦特绘谱专注于代谢组学与转化医学疾病研究领域,拥有成熟的代谢组学检测平台,以全定量靶向代谢组学技术为核心,包括全球独有技术Q600、Q300、Q200和各类小分子代谢物单独检测方法共20+套,兼顾非靶和广靶。同时还有菌群16S测序、宏基因组学、转录组学和蛋白质组学等多组学及联合分析等全套解决方案。独家的检测技术、全面的数据报告及专业科研级别的售后探讨,助您科研探索之路不断创新和突破。欢迎联系获取详细资料!
往期推荐
1. 美好向新 | 2022麦特绘谱高分项目文章大丰收,2023“兔”飞猛进
2. 客户案例 | ISME Journal (IF=11): 以基因组为中心研究奶牛胆汁酸代谢微生物群及相关饮食诱导的功能影响
4. 客户案例 | NC:肠肝轴再添实证!这种戒酒药物可通过调节肠道菌群改善非酒精性脂肪性肝炎
6. 客户案例 | Microbiology Spectrum:李后开等发现肠菌降解不饱和脂肪酸,或与冠心病的形成相关



