文献解读
Nature Metabolism | 肠道粪副拟杆菌增强BCAAs分解代谢预防心血管损伤
心血管疾病(CVD) 每年在全世界造成约1700多万人死亡,动脉粥样硬化是CVD的主要原因,其发病机制复杂,缺乏针对性的治疗药物和手段。近年来,肠道菌群及其代谢物在心血管疾病中的关键作用正逐渐被探索和阐明,某些肠道微生物衍生的代谢物显示出抵抗或促进动脉粥样硬化的作用,中科院微生物所刘宏伟和刘双江团队发现口服灵芝萜类衍生物(GMD)能通过提高肠道共生菌–粪副拟杆菌(Parabacteroides merdaede)的水平,增强肠道支链氨基酸(BCAAs)分解代谢,并调节动脉斑块中BCAAs激活的mTORC1通路,从而改善由高脂饮食(HFD)诱导的ApoE−/−小鼠的动脉粥样硬化,相关研究成果发表于《Nature Metabolism》。

GMD处理有效缓解高脂喂养的ApoE−/−小鼠动脉粥样硬化
将高脂喂养(HFD)的ApoE−/−小鼠分组并分别口服GMD (5 mg/kg或10 mg/kg)、阿托伐他汀(10 mg/kg)或空白对照9周;并以正常饲料喂养的C57BL/6J小鼠作为对照,结果显示,与模型组ApoE−/−小鼠相比相比,GMD治疗后,总胆固醇水平(TC),低密度脂蛋白胆固醇(LDL- c),总甘油三酯(T-TG)和游离脂肪酸(FFA)均显著降低。快速蛋白液相色谱(FPLC)对血浆脂蛋白组分分析发现,对照组中,极低密度脂蛋白(VLDL)、中密度脂蛋白(IDL)和LDL组分中,甘油三酯增加,而GMD或阿托伐他汀治疗显著降低这三组中的甘油三酯含量。已报道,氧化低密度脂蛋白(ox-LDL)及其最终产物丙二醛(MDA)、高敏c反应蛋白(hs-CRP)和脂多糖(LPS)的产生与动脉粥样硬化的进展相关。与对照组相比,GMD处理组小鼠血浆ox-LDL和MDA水平、hs-CRP和LPS水平显著降低,血浆中肿瘤坏死因子(TNF)-α和白细胞介素(IL)-1β的水平也显著降低。用多普勒超声检测主动脉弓分支和心脏流出道的血流和厚度,发现与对照组相比,GMD处理组的上述指标有显著改善。而且,与HFD喂养的ApoE−/−小鼠相比, GMD(10 mg/kg)处理的主动脉根部病变和总主动脉病变面积显著减少,GMD能有效降低坏死核心区域,增加主动脉斑块胶原蛋白含量。综上,GMD具有良好的抗动脉粥样硬化疗效(图1)。
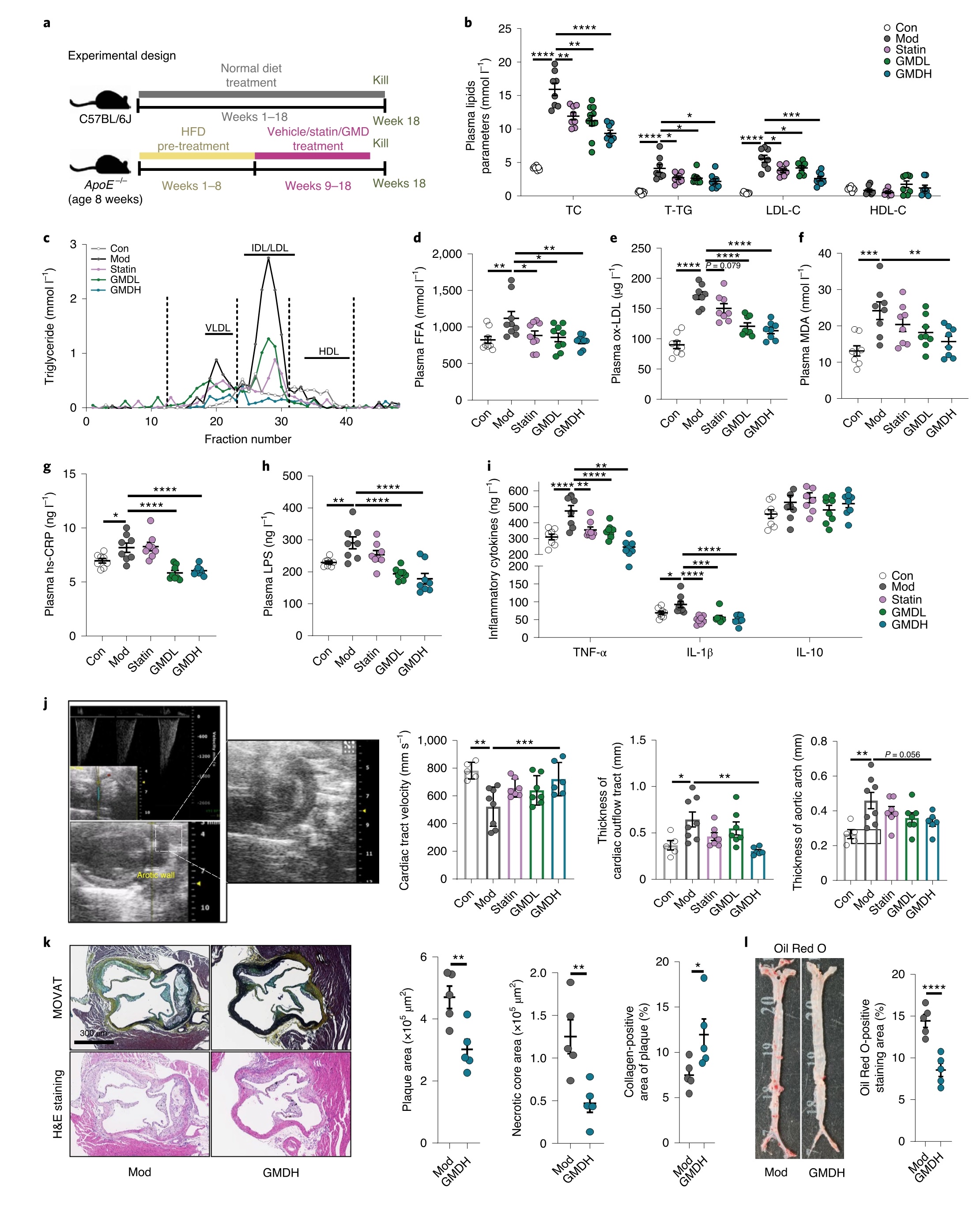
图1 | GMD处理的HFD-ApoE−/−小鼠动脉粥样硬化减少
GMD调节HFD喂养的ApoE−/−小鼠肠道菌群
收集小鼠粪便样本进行16S rRNA测序分析,结果显示, GMD处理组和对照组的α-多样性无显著差异;而β-多样性分析显示肠道菌群的组成和丰度存在显著差异;LEfSe分析显示,模型中组中Deferribacteraceae科、Desulfovibrionaceae科、Ruminiclostridium属、Bilophila属、Anaerotruncus属、Oscillibacter属和Helicobacter bilis种显著富集,而在GMD处理组中,Tannerellaceae科、Akkermansiaceae科、Parabacteroides属、Akkermansia属、Roseburia属和Parabacteroides merdaede种, Bacteroides acidifaciens种和Bacteroides种显著富集。通过PICRUSt2预测KEGG通路的相对丰度,并通过LEfSe确定GMD治疗后的功能变化,结果显示,GMD处理组中BCAA降解和氨基酸代谢通路显著富集。相似度百分比(SIMPER)分析量化了显著变化的前8个物种对两组差异的贡献,结果显示,经GMD处理后,粪副拟杆菌(P. merdae)丰度升高420倍,并被确定为GMD诱导肠道菌群变化最大的因素。通过共现网络、桑基图和热图分析证实,肠道菌群在粪副拟杆菌属中富集(图2)。
作者比较了公开的中国CVD队列和健康队列的肠道宏基因组数据集,结果显示,与健康对照者相比,中国队列中CVD患者的粪副拟杆菌显著降低。此外,一项基于欧洲的CVD队列分析显示,与健康对照组相比,CVD患者中粪副拟杆菌丰度降低,而BCAAs水平升高;而他汀类药物治疗并未改变肠道中粪副拟杆菌的丰度。
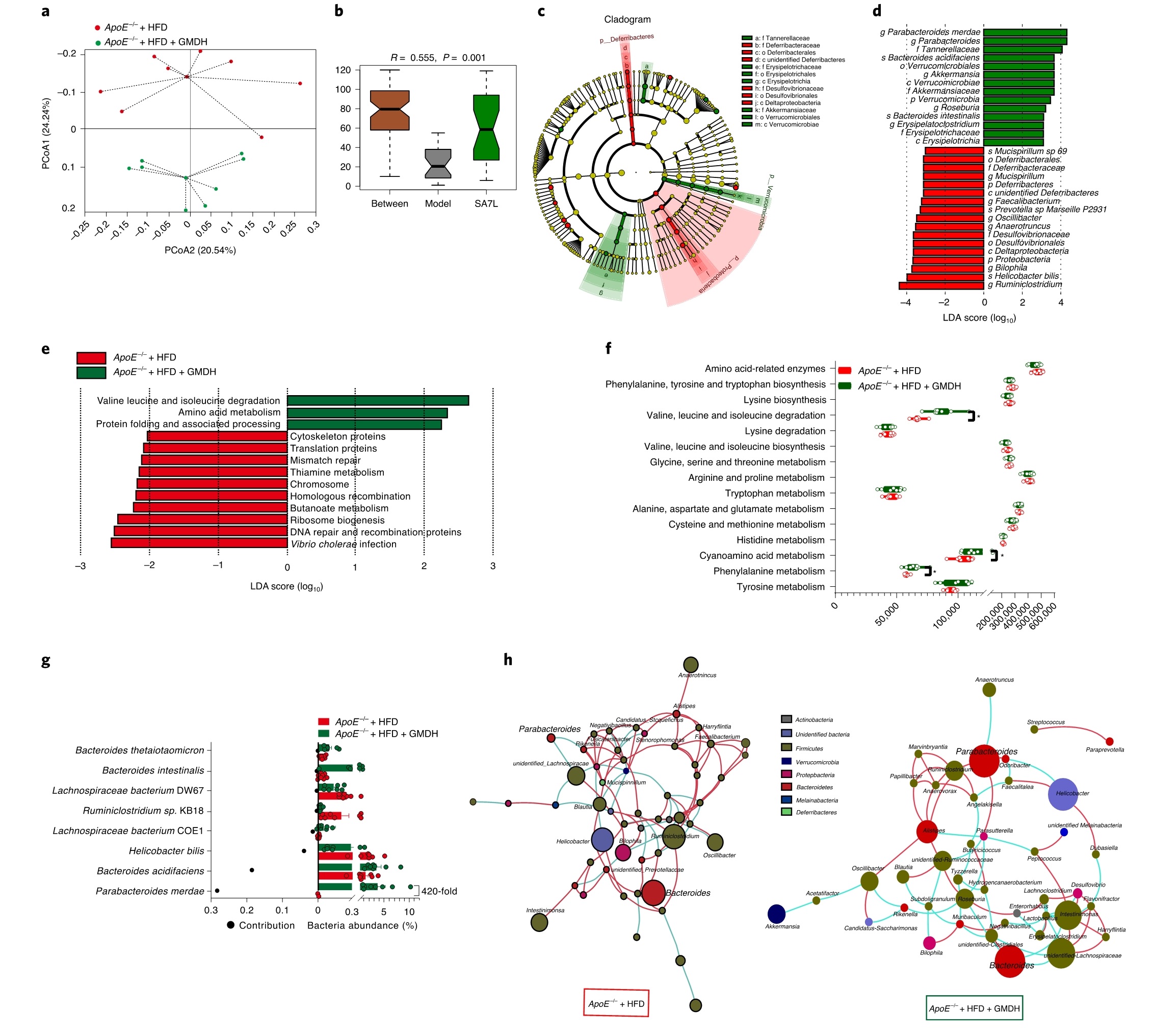
图2 | GMD介导HFD喂养的ApoE−/−小鼠肠道菌群变化
粪副拟杆菌可减弱ApoE−/−小鼠的动脉粥样硬化病变
将粪副拟杆菌活菌、热灭活的粪副拟杆菌或PBS灌胃给HFD喂养的ApoE−/−小鼠4周。结果显示,粪副拟杆菌显著改善了ApoE−/−小鼠的动脉粥样硬化迹象,导致HFD诱导的体重增加显著降低,血浆TC、T-TG和LDL-C的水平显著降低;主动脉根病变面积、主动脉斑块区域脂肪沉积、坏死核心区域显著降低,主动脉斑块胶原蛋白水平显著升;血浆LPS、ox-LDL、hs-CRP和肝脏脂肪变性水平降低。而热灭活的粪副拟杆菌对体重增加、高脂血症和病变面积无影响,仅hs-CRP略有降低。qPCR测定粪副拟杆菌肠道定植量,结果显示,ApoE−/−小鼠粪便中粪副拟杆菌的相对丰度显著增加。粪副拟杆菌处理组和模型组α-多样性无显著差异;β-多样性分析提示在属和种水平上两组存在显著差异,与GMD的结果一致。粪副拟杆菌定植显著增加了HFD的ApoE−/−小鼠中Akkermansia和Parabacteroides的丰度,并增强了PICRUSt2预测的与缬氨酸、亮氨酸和异亮氨酸(支链氨基酸,BCAAs)降解有关的通路(图3),并进一步在广谱抗生素治疗的ApoE−/−小鼠中验证,发现肠道共生菌P. merdae对ApoE−/−小鼠动脉粥样硬化的保护作用,从而验证了来自人肠道的P. merdae有望作为下一代益生菌的潜力。
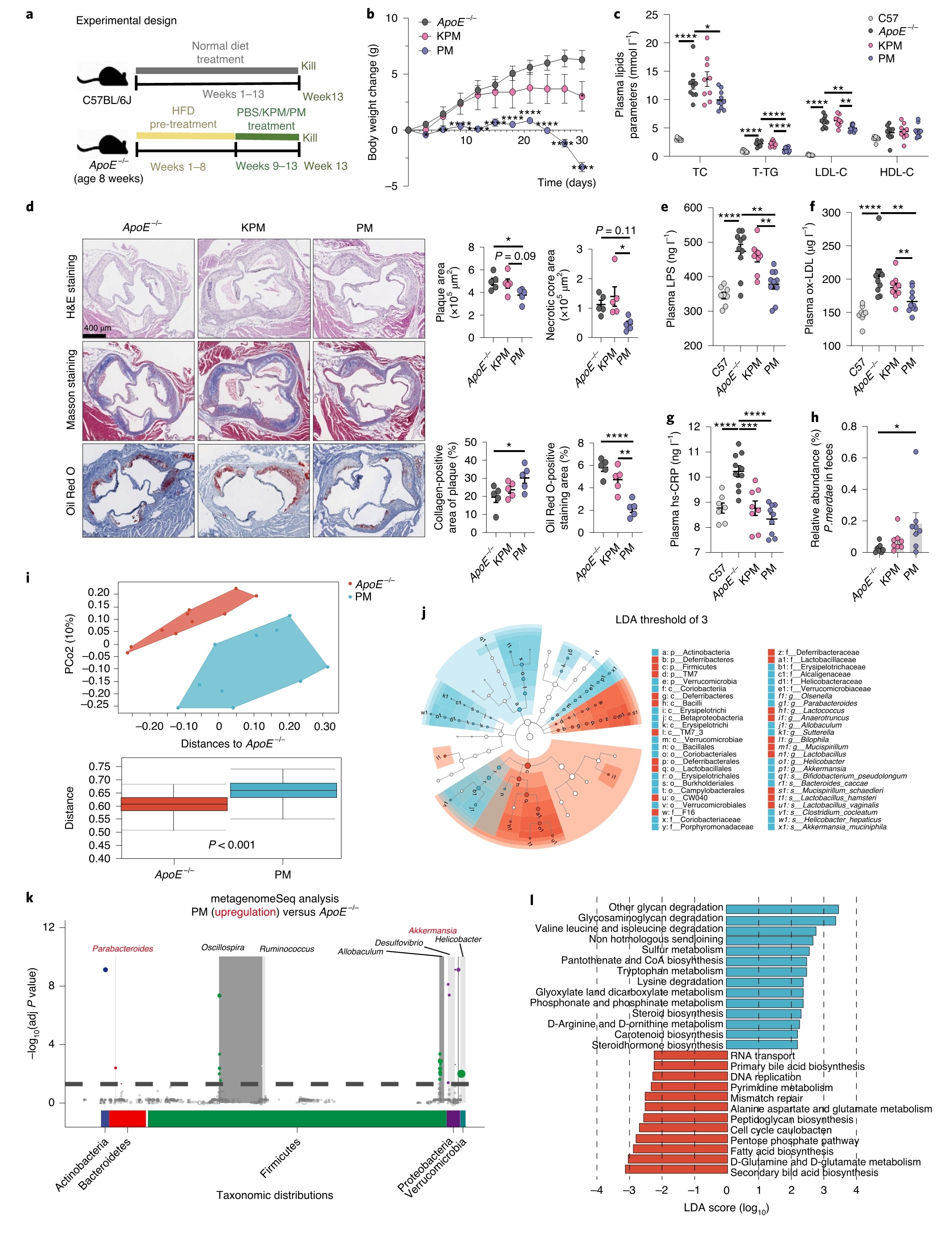
图3 | 粪副拟杆菌灌胃减少动脉粥样硬化斑块形成
粪副拟杆菌对肠道中BCAAs的降解
BCAAs可以在肠道中转化为支链短链脂肪酸(BSCFAs)。对GMD或粪副拟杆菌处理的HFD喂养的ApoE−/−小鼠进行BCAAs和SCFAs的靶向代谢组检测。结果显示,GMD或粪副拟杆菌处理后,粪便BSCFAs(包括异丁酸、异戊酸和2-甲基丁酸)显著增加,粪便和血浆中BCAAs减少,表明GMD和粪副拟杆菌对肠道中BCAA降解的影响。为了证实粪副拟杆菌对BCAAs的分解能力,对粪副拟杆菌进行体外培养,检测培养后的BSCFAs水平,结果显示,在孵育24小时后检测到异丁酸、异戊酸和2-甲基丁酸,验证了粪副拟杆菌将BCAAs转化为BSCFAs的能力。
为了确定粪副拟杆菌中BCAAs相关的代谢途径,进行泛基因组分析以识别已知和假定的基因。已报道,在梭状芽孢杆菌中,porA基因可催化BCAAs转化为BSCFAs,该基因被用作查询序列,从粪副拟杆菌基因组中鉴定出一个porA同源基因。此外,分析中国动脉粥样硬化CVD队列肠道菌群中porA同源基因的丰度,结果表明,与健康对照者相比,动脉粥样硬化患者的肠道菌群中的粪副拟杆菌和porA基因显著减少,且porA基因丰度与粪副拟杆菌的相对丰度呈正相关。随后,构建敲除porA的粪副拟杆菌突变株(PMΔPorA),靶向代谢检测结果表明,敲除porA后,BCAAs无法转化为BSCFAs(图4)。
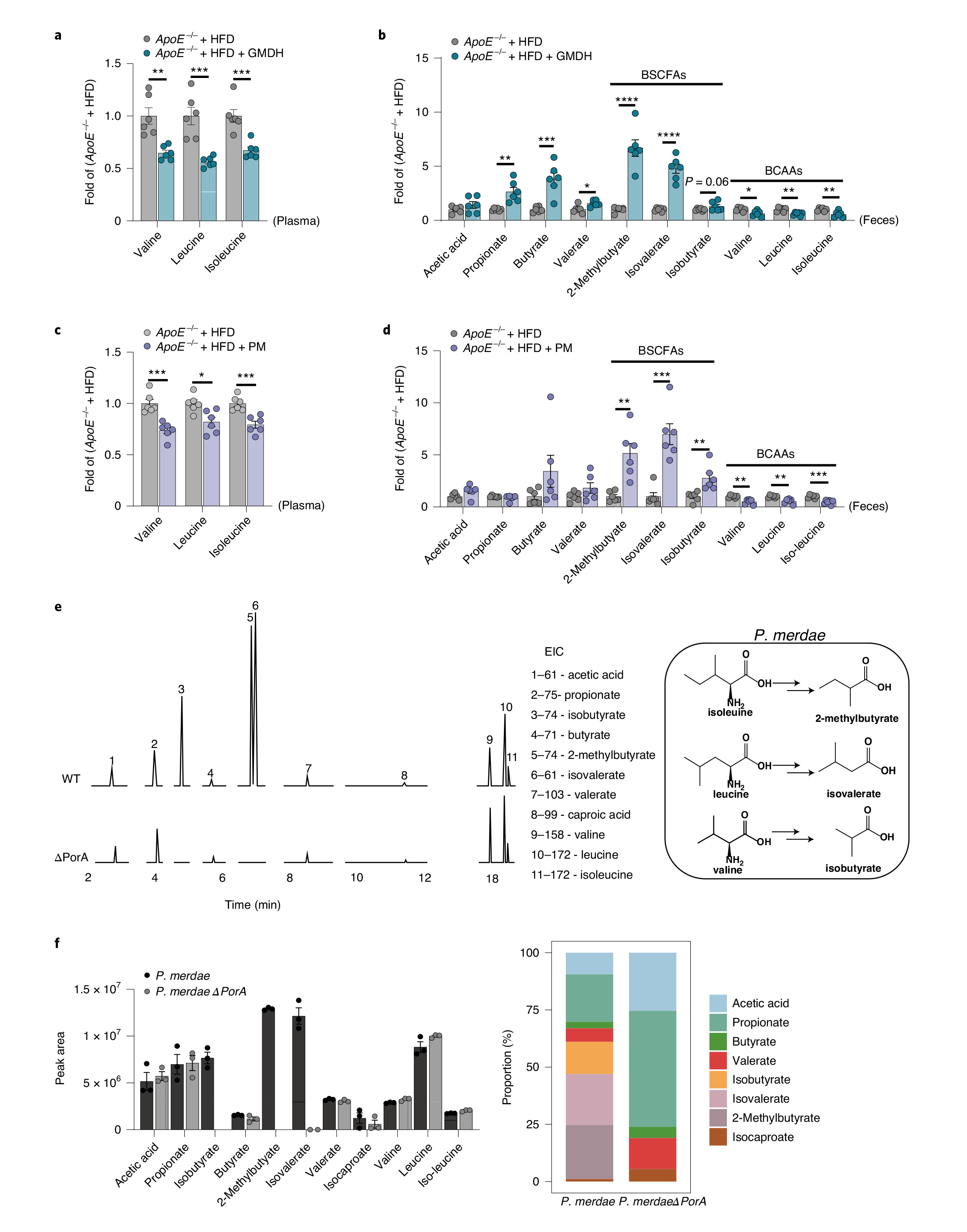
图4 | 粪副拟杆菌促进肠道BCAAs分解代谢
将PMΔPorA菌株或野生型菌株(PMWT)接种给HFD喂养的ApoE−/−小鼠,以探究porA基因依赖的BCAA降解是否影响粪副拟杆菌的抗动脉粥样硬化作用。在porA基因的缺失不影响粪副拟杆菌定植能力情况下,与接种野生对照组相比,接种敲除porA的粪副拟杆菌的小鼠的血浆和粪便BCAAs水平显著升高,且主动脉根病变面积、斑块脂肪沉积、体重增加、血浆脂质(TC、T-TG和LDL-C)、LPS、ox-LDL、hs-CRP、TNF-α、IL-1β和IL-6均未改善。提示粪副拟杆菌在治疗肥胖相关动脉粥样硬化方面的潜力,表明porA调节的肠道BCAAs分解代谢是粪副拟杆菌抗动脉粥样硬化作用的潜在机制(图5)。
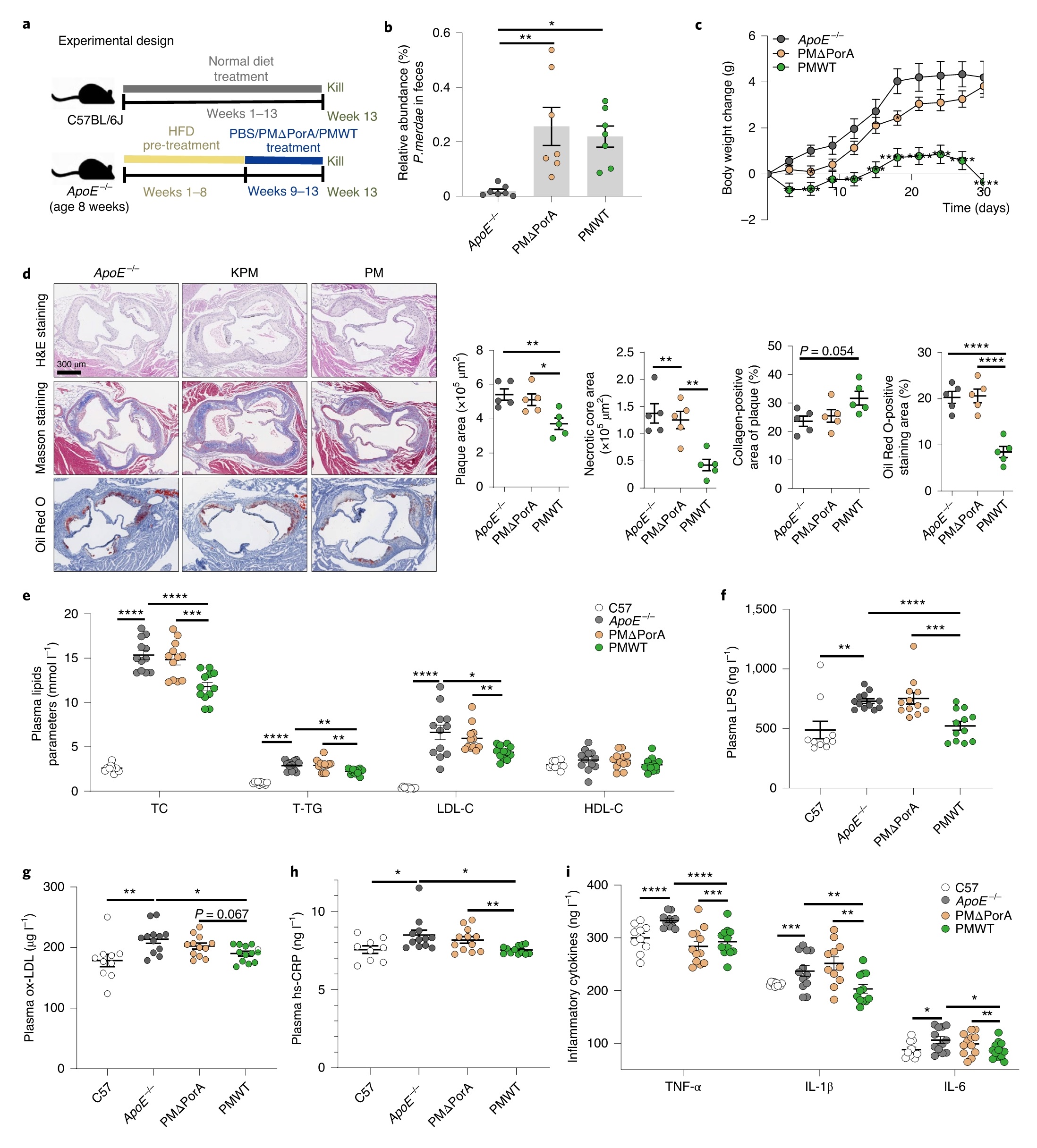
图5 | 粪副拟杆菌增强BCAAs降解可减弱动脉粥样硬化斑块的形成
粪副拟杆菌对mTORC1信号通路的抑制作用
肥胖、胰岛素抵抗和循环BCAAs与动脉粥样硬化进展呈正相关。血糖及葡萄糖耐量结果显示,HFD喂养的ApoE−/−小鼠接种野生型粪副拟杆菌后,高血糖和葡萄糖耐量显著改善,而接种敲除porA的突变粪副拟杆菌则未能改善血糖。
已报道,高蛋白饮食会促进动脉粥样硬化和病变,同时伴有循环亮氨酸水平的增加和斑块巨噬细胞中mTORC1信号的激活。通过免疫荧光染色PMΔPorA或PMWT处理的小鼠主动脉根,比较动脉粥样硬化斑块巨噬细胞中mTORC1通路的激活,其中下游靶核糖体蛋白S6 的磷酸化标志着mTORC1的激活。结果显示,与接种野生型粪副拟杆菌小鼠相比,接种敲除porA的粪副拟杆菌的小鼠组的斑块S6的磷酸化(pS6)显著增加,mTORC1通路激活增强。为了排除已报道的其他mTORC1诱导剂(如精氨酸或谷氨酸)的影响,靶向代谢组检测17种血浆氨基酸的水平,结果显示,在PMΔPorA和PMWT处理的小鼠之间,除BCAAs外的其他氨基酸水平均无差异。因此,BCAAs激活的mTORC1通路的调控有助于粪副拟杆菌抗动脉粥样硬化的功效(图6)。
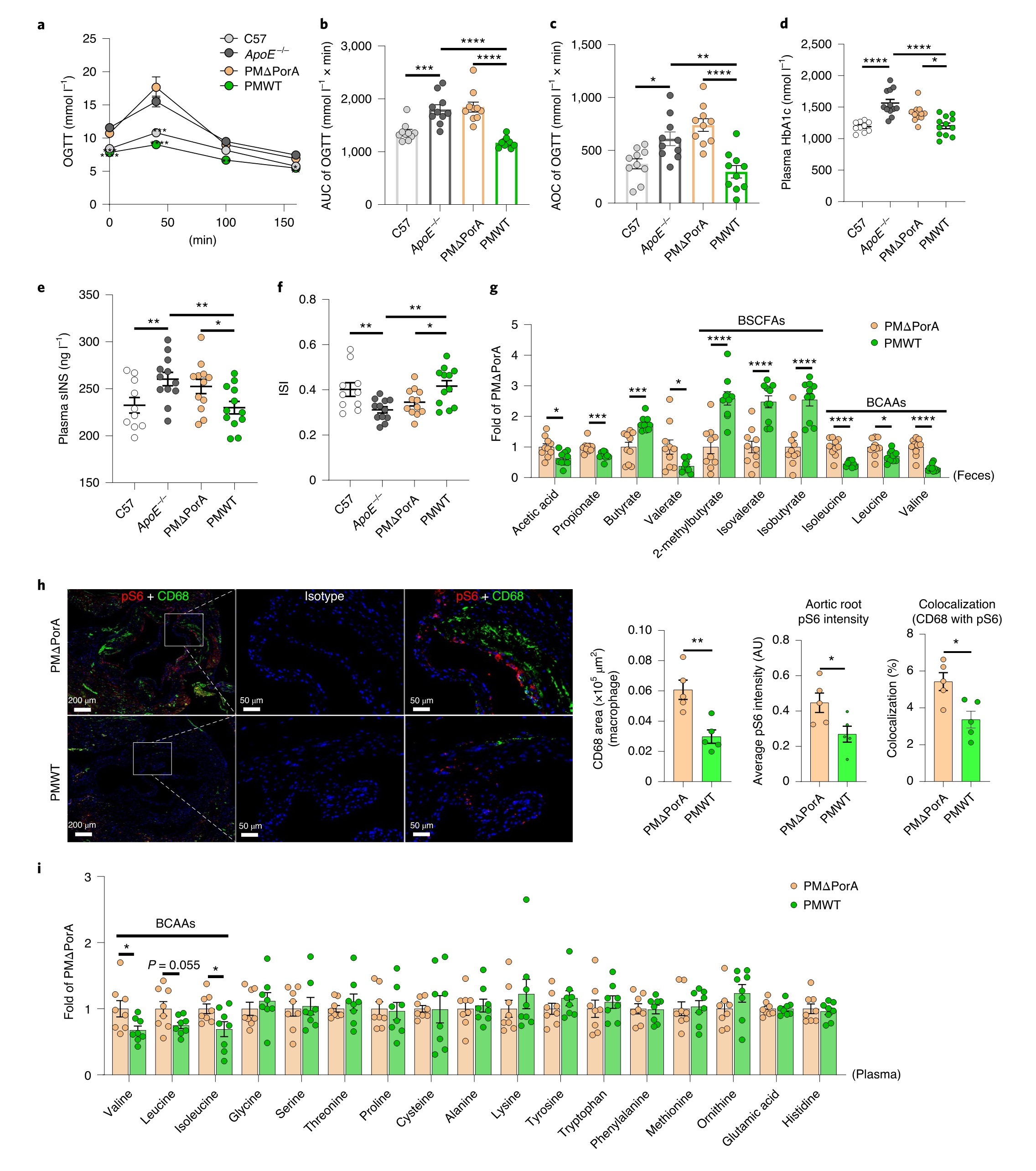
图6 | 粪副拟杆菌降解肠道BCAAs调节mTORC1信号
GMD和粪副拟杆菌对HCD喂养的ApoE−/−小鼠的影响
为了扩大GMD和粪副拟杆菌的应用,进一步研究GMD和粪副拟杆菌在高胆固醇饲料(HCD)喂养的ApoE−/−小鼠模型中的作用。结果表明,GMD在HCD喂养的ApoE−/−小鼠中的抗动脉粥样硬化作用远弱于HFD喂养的ApoE−/−小鼠,且粪副拟杆菌活菌灌胃HCD喂养小鼠则无治疗作用,推测HFD喂养的ApoE−/−小鼠与HCD喂养的ApoE−/−小鼠在病理和生理上的差异,特别是在肥胖、血浆BCAAs和胰岛素抵抗方面的差异,可能决定了GMD和粪副拟杆菌抗动脉粥样硬化的疗效。GMD和肠道共生的粪副拟杆菌能有效缓解肥胖相关动脉粥样硬化小鼠模型中的动脉粥样硬化病变,人肠道P. merdae被认为是预防CVD的潜在益生菌。
小结
GMD是以从几种灵芝蘑菇中分离得到的灵芝霉素I为基础合成的美萜衍生物,本研究中,通过给HFD喂养的ApoE−/−小鼠口服GMD或粪副拟杆菌活菌可以减少动脉粥样硬化病变,增强肠道BCAAs降解。BCAAs的降解是由粪副拟杆菌中表达的porA基因介导的。敲除粪副拟杆菌的porA基因则减弱其降解BCAAs的能力,导致对动脉粥样硬化无效;机制上,粪副拟杆菌通过促进BSAAs的微生物降解调节动脉斑块中BCAAs激活的mTORC1通路,发挥因果性抗动脉粥样硬化作用。本研究揭示了GMD和肠道共生菌粪副拟杆菌对肥胖相关性动脉粥样硬化的治疗作用,并揭示了肠道菌群驱动的BCAAs分解代谢在维持机体心血管健康方面的重要作用。
参考文献
Gut Parabacteroides merdae protects against cardiovascular damage by enhancing branched-chain amino acid catabolism. Nature Metabolism. 2022.
请扫描二维码阅读原文

绘谱帮你测
本研究通过口服GMD或活粪副拟杆菌、构建基因敲除等干预手段,通过16S测序、支链氨基酸和短链脂肪酸、17种氨基酸的靶向代谢组检测等,揭示GMD和粪副拟杆菌对肥胖相关性动脉粥样硬化的治疗作用及机制。本研究中涉及的支链氨基酸、短链脂肪酸、氨基酸检测及16s 测序等麦特绘谱均可提供相关检测方案,此外公司还拥有业内强大的Q600全定量代谢组、Q300全定量代谢组、Q200宏代谢组以及菌群相关的16S rDNA测序和宏基因组等方法,并提供代谢组学一站式整体解决方案,独家的检测技术、全面的数据报告以及专业的售后探讨,助力您的科研探索之路不断创新和突破。详情欢迎咨询麦特绘谱热线400-867-2686,获取详细资料!
往期推荐
1. 客户案例 | 中药篇(五):从代谢组学角度探究三七总皂苷联合阿司匹林对心血管疾病的治疗作用
2. 客户案例 | NC:西湖大学团队发现饮茶或可降低慢性失眠带来的心血管代谢病风险
3. Nature Medicine | 大队列揭示心脏代谢疾病的菌群和代谢特征
4. Nature Medicine | 肠道菌群、饮食和遗传对人体血浆代谢物的影响
5. Protein & Cell | 肠道菌群及其代谢物在代谢性疾病中的作用



