文献解读
Microbiome | 多组学分析揭示减重手术中肠道微生物如何调节机体代谢

目前,减重手术仍是治疗肥胖及相关并发症的重要外科手段。然而,手术本身带来的损伤以及其不可逆转的特点限制了减肥手术的应用。揭示手术干预机制,实现高效、低侵入性的抗肥胖策略,是当今相关研究的一大挑战。来自德国波恩大学医学中心Wiebke Kristin Fenske团队使用减重手术、肠道微生物移植等动物模型,通过多组学技术探索肠道微生物的功能及代谢特点变化。研究结果显示,在减重手术(Roux-en-Y式)后,肠道微生物代谢特征发生改变,肠腔内及循环中的牛磺酸结合型胆汁酸(T-CBAs)增加。这些T-CBAs通过肠道中的FXR(Farnesoid X receptor)和靶器官中的TGR5(G-protein-coupled bile acid receptor)作用于肠道及机体的多种细胞,最终诱导脂肪产热及代谢改善。相关成果发表于《Microbiome》。
一、肠道菌群耗竭可减弱Roux-en-Y减重手术对高脂饮食诱导肥胖模型的治疗效果
为了研究肠道微生物在减重手术中发挥的具体作用。作者首先在高脂饮食诱导的肥胖大鼠(HF-DIO大鼠)中实施Roux-en-Y减重手术(Roux-en-Y gastric bypass,RYGB),其中一组使用广谱抗生素耗竭其肠道微生物。为模拟自由选择饮食情况,术后大鼠同时提供了高脂及正常两种不同饮食。肠道菌群耗竭可显著降低RYGB治疗效果。抗生素处理组大鼠体重增长是对照组的三倍,并且其增长主要体现在脂肪组织中。同时,抗生素处理组饮食模式更偏向于高脂饮食,日常摄入及吸收的能量更多。抗生素处理后,大鼠代谢能力也有一定受损,表现为血糖调节能力下降,胰岛素敏感性受损,血脂升高,肝脏发生脂肪变性,促炎因子(如Ifng、Tnfα等)表达升高。
已有研究证明,肠道微生物在脂肪组织产热的调控中起到重要作用。因此,作者探索了RYGB后肠道微生物变化和脂肪组织产热之间的联系。肠道菌群耗竭后,大鼠的棕色脂肪组织(BAT)发生白色化,脂肪细胞中的脂滴累积增加。同时,BAT中重要的产热蛋白——解偶联蛋白1(UCP1)在抗生素处理组中表达降低。在寒冷刺激下,相比对照组小鼠,抗生素处理组产热能力下降,体温下降的幅度也更大。此外,采用不同实验组大鼠血清刺激脂肪细胞,结果发现,RYGB术后大鼠血清可以显著增强脂肪细胞线粒体呼吸能力,而抗生素处理则削弱了这一刺激。这些结果提示了肠道微生物在减重手术中起到重要作用。
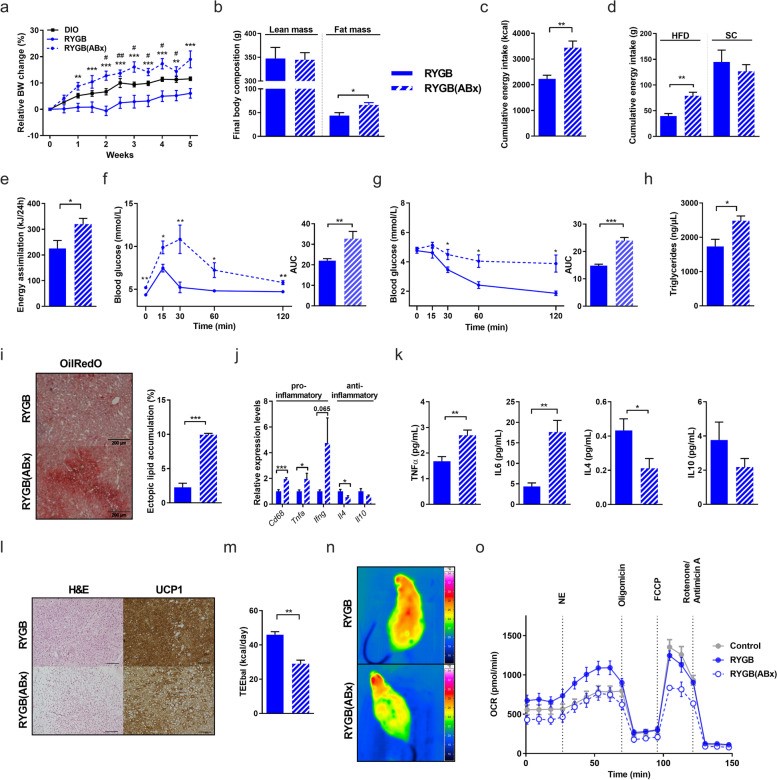
(图1)
二、RYGB术后大鼠粪菌移植可缓解HF-DIO大鼠表型
为了进一步验证肠道微生物在减重手术中发挥的重要作用,作者将RYGB术后大鼠的肠道微生物移植(FMT)到了HF-DIO大鼠中。粪菌移植后,RYGB-FMT大鼠体重增长减缓,饮食方式也更偏向于正常饮食。尽管RYGB-FMT大鼠每日能量总摄入没有变化,但其食物能量吸收效率降低了。相应的,其代谢能力也得到了系统性改善,胰岛素敏感性升高,胰岛肥大比例降低以及血脂水平下降。
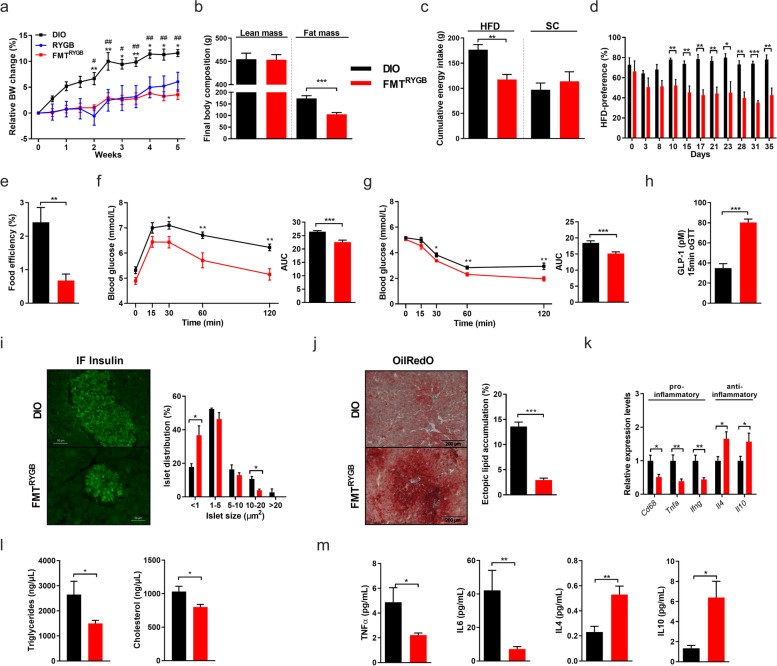
(图2)
作者进一步探究了此过程中脂肪组织的变化。RYGB-FMT大鼠白色脂肪组织(WAT)中的脂肪细胞缩小,并且参与脂肪产热、脂解相关过程的基因表达上升。RYGB-FMT大鼠WAT向抗炎状态发生转变,细胞外间质重塑及组织纤维变性也有所减少。除WAT外,RYGB-FMT大鼠BAT也有激活。其BAT内UCP1的表达上升,脂滴含量减低。BAT中脂肪产热及脂解相关基因表达上升,脂肪细胞的线粒体体积变大、嵴增多,组织纤维变性显著减少,血清甘油水平也有一定程度的上升。此外,RYGB-FMT大鼠具有更强的脂肪产热能力及冷耐受能力。体外试验中,RYGB-FMT大鼠血清处理棕色脂肪细胞,同样发现其也可以上调细胞的代谢能力。这些结果进一步佐证了肠道微生物与脂肪组织之间的交流是减重手术治疗肥胖的关键机制。
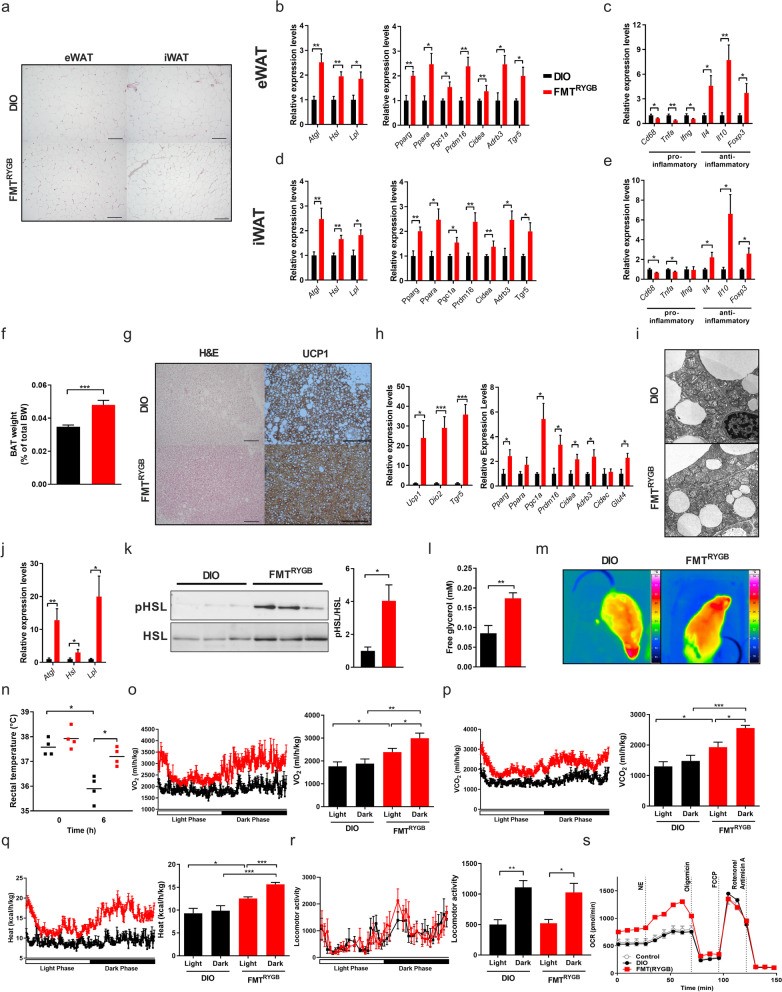
(图3)
二、多组学技术揭示,减重手术或RYGB-FMT调控牛磺酸代谢及肠道胆汁酸受体的活性
作者首先采用16S rRNA技术分析了减重手术及粪菌移植对肠道菌群构成的影响。结肠内容物结果表明,除抗生素处理组之外,无论是RYGB或是RYGB-FMT,都无法改善HF-DIO大鼠的肠道菌群多样性。尽管在属的水平,RYGB-FMT大鼠中的Deferribacteres(脱铁杆菌属)十分丰富,但在其他菌群上,与HF-DIO大鼠并没有差别。因此,作者认为并非是某种细菌,而是几类菌群在代谢方面的集体改变,引发了下游信号的传导。
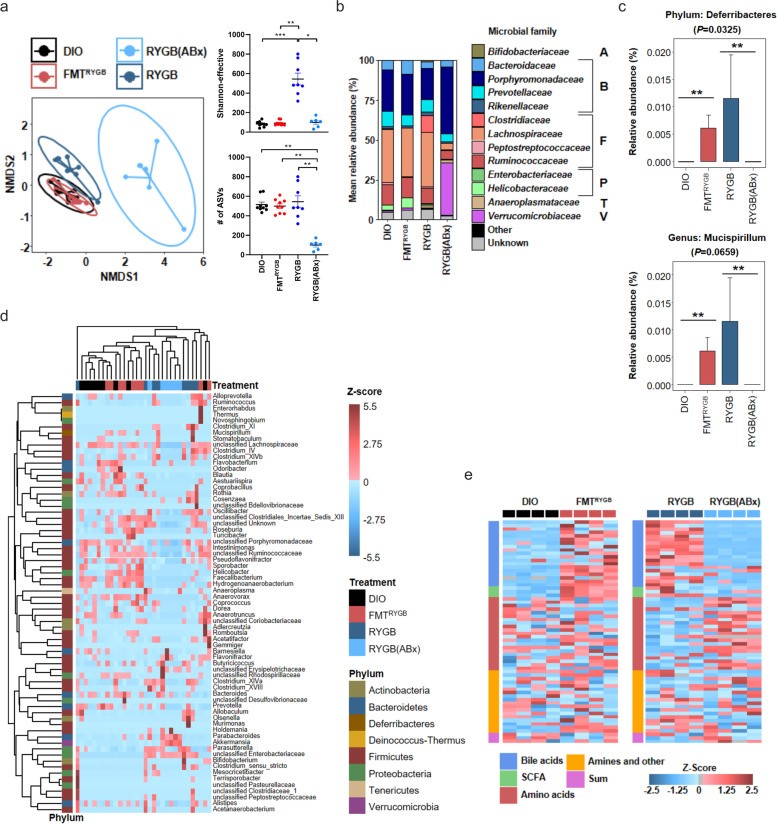
(图4)
微生物的代谢产物,是宿主-微生物通讯的关键介质。因此,为了探究这一过程中代谢产物的变化,作者对门静脉血浆及盲肠内容物进行代谢组学分析。通过对比分析,从差异代谢物中聚焦到几种胆汁酸(BAs)。已有研究发现,BA是一种重要的代谢调节剂,主要参与葡萄糖、脂质等代谢过程的调控。FXR及TGR5是其主要受体。在RYGB粪菌移植大鼠的门静脉血浆及盲肠内容物中,牛磺酸结合型胆汁酸(T-CBA)水平升高。同时,在回肠FXR-FGF19信号轴激活下,回肠中BAs重吸收相关基因表达上升,但循环中具有细胞毒性的BAs水平下降。同时还伴随着TGR5系统性表达上调。靶向定量技术检测到在门静脉血浆及盲肠中牛磺酸水平上调。与此一致,肝脏中牛磺酸合成及转运相关基因也一并上调。这些结果证明,RYGB或其粪菌移植通过影响宿主牛磺酸及胆汁酸代谢激活下游信号从而进行代谢调控。
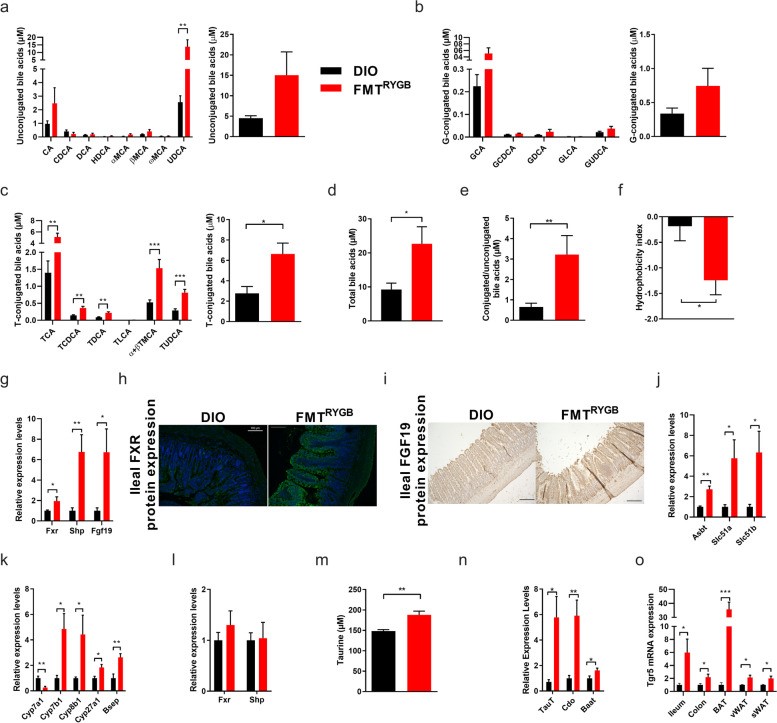
(图5)
为了更好的理解微生物代谢功能的变化,作者对盲肠内容物进行了宏蛋白质组学分析。结果发现,尽管RYGB术后肠道菌群变化不大,其蛋白质功能发生了极大改变。利用KEGG分析,作者发现这些蛋白质主要富集在142条通路上,其中“无机离子转运与代谢”,“核糖体合成”,“染色体及相关蛋白”通路存在显著性改变(p<0.05)。此外,作者发现胆盐水解酶(BSH)——将T-CBA代谢为牛磺酸和BAs的关键酶——在RYGB及RYGB-FMT组中的丰度大大下降。这与之前的发现一致。并且,分析结果显示BSH的变化与Turicibacter, Romboutsia, Intestimonas三个菌属密切相关。
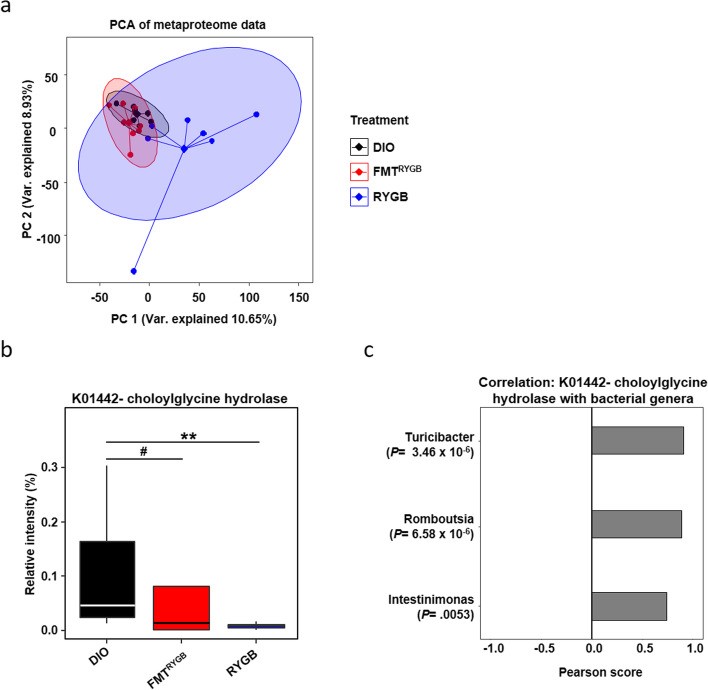
(图6)
四、FXR及TGR5在激活脂肪组织产热及改善代谢能力中起关键作用
目前研究结果证明RYGB粪菌移植通过激活肠道FXR调节系统BA信号,从而改善代谢健康。由此,作者使用FXR抑制剂Gly-MCA(Glycine-ß-muricholic acid)灌胃给RYGB-FMT小鼠后,发现该抑制剂逆转了FMT的治疗作用。虽然口服给予Gly-MCA并不会影响肝脏FXR信号传导,其仍然减弱了RYGB-FMT对肝脏脂肪变性的治疗作用。这提示,小肠内FXR,而非肝脏内的FXR信号传导至关重要。此外,Gly-MCA给药显著降低了iBAT和WAT中脂肪产热以及脂解基因的表达,并且小鼠的冷耐受能力下降。
本研究中发现胆汁酸的改变可以诱导FXR5系统性激活,于是,在高脂饮食喂养的Tgr5-/-小鼠中进行RYGB大鼠肠道微生物移植时,RYGB-FMT并不能诱导产热增加,以及代谢状况的改善。这些结果表明,FXR及TGR5在RYGB粪菌移植中减轻肥胖中代谢紊乱发挥关键作用。
小结
本研究通过多组学手段,阐明了减重手术前后肠道微生物的变化,并探索了其影响肥胖及相关代谢特征的机制。通过相关实验证实减重手术通过肠道微生物调节牛磺酸代谢及BAs信号进而激活下游脂肪组织产热、改善机体葡萄糖的潜在机制。该项工作凸显了肠道微生物与宿主之间的“交流”在调控机体能量代谢状态中的重要性,为肥胖的临床治疗,以及代谢障碍的管理方案提供了新思路。
参考文献
Functional changes of the gastric bypass microbiota reactivate thermogenic adipose tissue and systemic glucose control via intestinal FXR-TGR5 crosstalk in diet-induced obesity. Microbiome. 2022.
请扫描二维码阅读原文

绘谱帮你测
麦特绘谱拥有业内强大的Q600全定量代谢组、Q300全定量代谢组、Q200宏代谢组以及菌群相关的16S rDNA测序和宏基因组等方法,可提供代谢组学一站式整体解决方案,独家的检测技术、全面的数据报告以及专业的售后探讨,助力您的科研探索之路不断创新和突破。详情欢迎咨询麦特绘谱热线400-867-2686,获取详细资料!
往期推荐
1. Nature Reviews Endocrinology | 肠道微生物代谢产物对肥胖、NAFLD和T2DM的影响
2. Nature全新方法绘制肠道微生物代谢谱,再加速菌群-宿主共代谢研究进程
3. 『珍藏版』Cell Metab综述 | 非酒精性脂肪肝基于肠道微生物组的个性化医疗的最新概念,机遇和挑战
4. Nature Reviews Endocrinology | 肠道微生物代谢产物对肥胖、NAFLD和T2DM的影响
5. 客户案例 | 甘草酸二铵通过调节肠道菌群-结合型胆汁酸-FXR信号通路改善肥胖
6. Nature Communications | 肠道菌群代谢饮食中的PUFA提高宿主肥胖抵抗力
7. Cell Metabolism | 肥胖个体中肠道菌群会影响记忆功能



