文献解读
Gastroenterology | 饮食干预下的儿童克罗恩病的粪便代谢组改变
炎症性肠病(IBD)包括溃疡性结肠炎(ulcerative colitis,UC)、克罗恩病(Crohn’s disease,CD)和未定型结肠炎(indeterminate colitis,IC)。其中,CD是一种慢性多因素疾病,遗传、环境、肠道菌群和免疫系统相互作用导致疾病发展。全世界儿童CD发病率的增加与饮食转向西化饮食有关,后者反过来会导致肠道菌群改变、肠道免疫和代谢紊乱。为了避免皮质类固醇(成人CD的常用药)在生长发育的关键阶段产生不良影响,儿科胃肠病学家将营养治疗定位为诱导轻度至中度疾病缓解的首选。前期的随机对照试验 (RCT) 研究发现,两种不同的营养治疗——CD排除饮食+部分肠内营养(CDED+PEN)和完全肠内营养(EEN)均能诱导儿童CD的轻度至中度的的缓解,且CDED+PEN耐受性更好,能够维持缓解症状。来自荷兰阿姆斯特丹大学的Van Limbergen J.E.团队通过粪便代谢组学揭示了CDED+PEN和EEN诱导的粪便代谢物变化及其与症状缓解的关系,相关研究成果发表于《Gastroenterology》。

实验设计
这是一项比较CDED+PEN和EEN的前瞻性随机试验,在第0周、第6周和第12周对自轻度至中度小儿CD患者的80份粪便样本进行粪便代谢组检测,,同时进行宏基因组的KO分析,研究参与特定代谢通路的不同功能基因丰度。根据缓解 (W06_rem)、无缓解 (W06_nr)、持续缓解 (W12_sr)和非持续缓解 (W12_nsr)的临床结果和两种营养治疗类型(CDED+PEN、EEN)对数据进行分析。对于CDED+PEN:W0、W06和W12分别为n=16、17和9。对于EEN:W0、W06和W12分别为n=15、14、9。一些患者由于无法耐受或开始另一种治疗(主要影响EEN组的分析)而离开研究,因此标注每位患者的样本ID以跟踪纵向收集的样本和未纵向收集的样本。
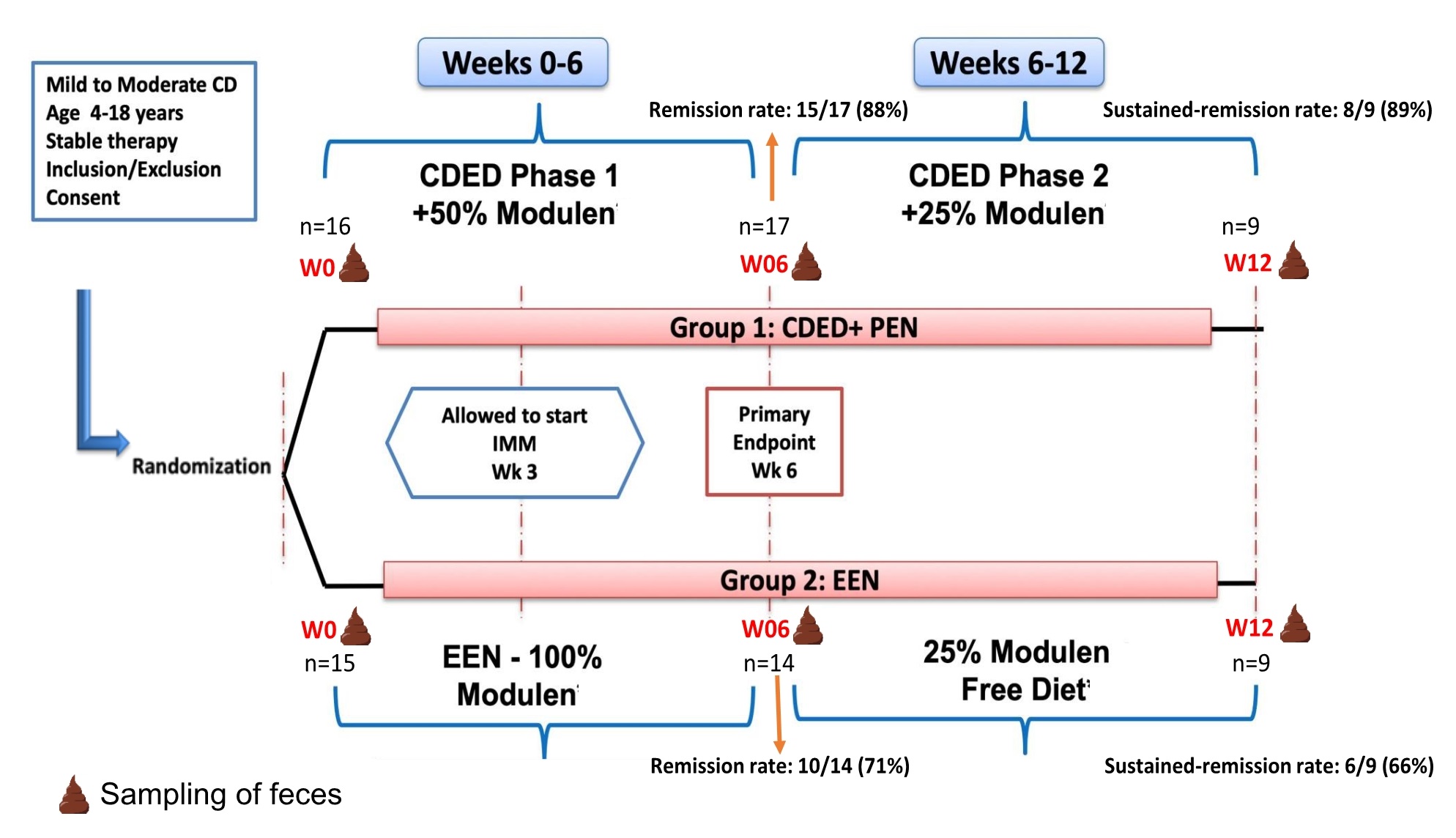
图1. 实验流程图
营养治疗引起的代谢物改变(CDED+PEN和EEN)
PLS-DA分析显示,基线样本(W0)和W06的饮食诱导缓解组或W12的持续缓解组之间存在显著分离。在分析中包括的216种代谢物中,W0组与W06_rem组之间有20种代谢物显著改变,W0组与W12_sr组之间有16种代谢物的显著改变。热图展示了W0组与W06_rem组间差异显著的前20种代谢物,包括嘌呤的关键成分(如三磷酸鸟苷、次黄嘌呤、腺嘌呤和IDP)和脂质代谢,以及氨基酸的衍生物。与W0组相比,W06_rem组和W12_sr组均显示N-α-乙酰精氨酸和维生素K2增加以及犬尿氨酸和N-乙酰腐胺减少。此外,通路分析显示甘油磷脂代谢、嘌呤代谢和精氨酸以及脯氨酸代谢的持续变化。与W0组相比,W06_rem组和W12_sr组均显示甘油磷脂代谢显著富集,其中4种代谢物显著减少。在W06_rem组中,鞘脂代谢影响最显著,反映Cer(d18:1/24:1(15Z))和Cer(d18:1/18:1(11Z))等神经酰胺的显著减少(图2)。
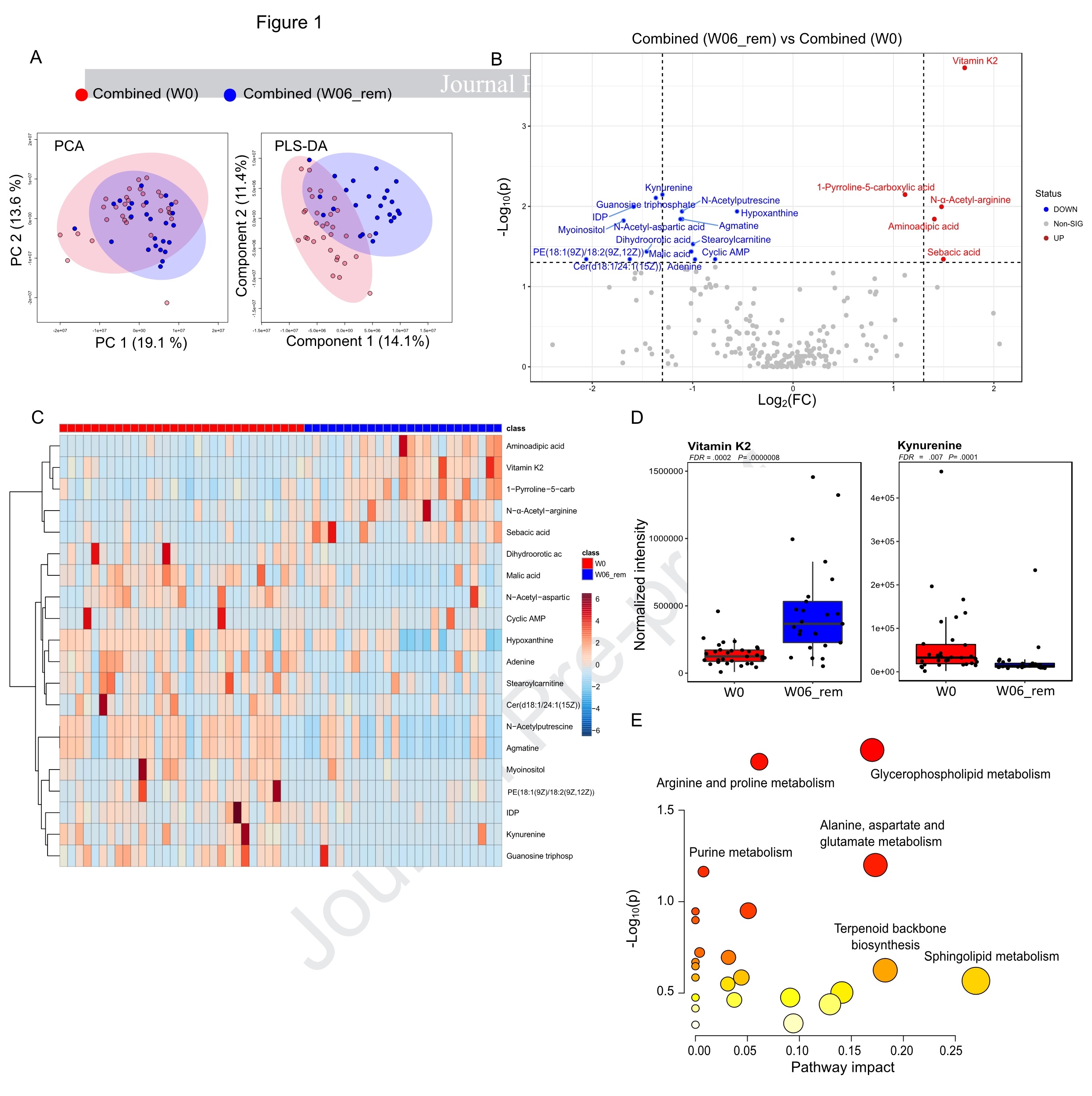
图2. W06时营养治疗(CDED+PEN 和 EEN)诱导的儿童CD缓解与脂质代谢和犬尿氨酸水平降低以及维生素 K2 增加有关
CDED+PEN诱导持续缓解中的代谢特征
分析CDED+PEN诱导和持续缓解对代谢物的影响:使用设置倍数改变大于2.5的阈值将基线(W0)与W06_rem和W12_sr进行了比较。与W0相比,就倍数变化而言,犬尿氨酸的减少和N-α乙酰精氨酸的增加再次显示为W06_rem和W12_sr最显著的变化,且它们是FDR校正后唯一表现出显著变化的代谢物。随后通过比较W0 vs W06_rem vs W12_sr,探讨了CDED+PEN诱导的代谢物随时间的变化,进而确定在诱导和维持缓解期间表现出最强持续变化的代谢物。CDED+PEN诱导和持续缓解与N-α-乙酰精氨酸和维生素K2的强烈持续增加以及犬尿氨酸、苹果酸、精胺、N-乙酰腐胺和嘌呤的持续减少有关。烟酰胺(维生素B3)的增加仅与W12_sr相关。通路分析表明柠檬酸循环、丙酮酸、嘌呤和色氨酸代谢以及丙氨酸、天冬氨酸和谷氨酸代谢的富集。并且,琥珀酸合成的一些主要底物(参与柠檬酸循环和丙酮酸代谢),例如苹果酸和富马酸,在CDED+PEN诱导的缓解组中减少。通过设置倍数改变大于4的阈值比较W0与W06_rem和W12_sr,结果显示,只有W06_rem而非W12_sr显示出统计学上的显著变化,其中有20种代谢物的变化与W06_rem显著相关(图3)。
EEN诱导和持续缓解中的代谢特征
同时,通过比较W0 vs W06_rem vs W12_sr,探究EEN诱导的代谢物随时间的变化。虽然EEN诱导了一些代谢物(如N-乙酰腐胺、精胺和24,25-二氢羊毛甾醇)的持续变化,但W12_sr的其他代谢物恢复到与基线相当的水平,如氨基己二酸和次黄嘌呤,这表明,与CDED+PEN相比,在W06时EEN诱导的缓解中的代谢变化在W12_sr样本中并未持续。通路分析表明,亚油酸代谢、甘油磷脂代谢和花生四烯酸代谢存在差异。在W06_rem组中,鞘脂代谢影响最显著,这反映在一些IBD相关神经酰胺如Cer(d18:1/24:1(15Z)和Cer(d18:1/18:1(11Z)的显著减少。
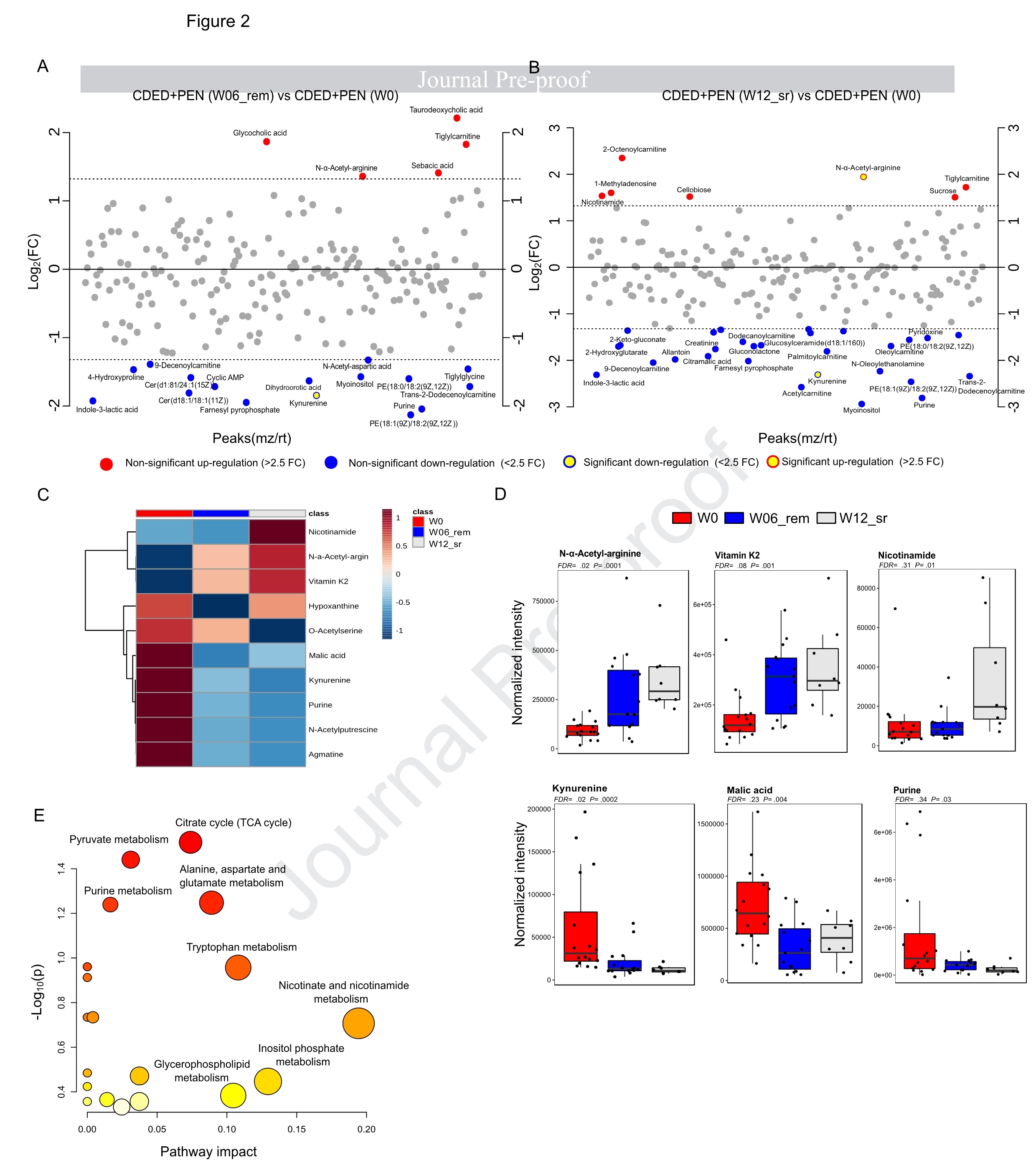
图3. CDED+PEN诱导的缓解在W12持续缓解
EEN治疗后无反应组的代谢特征
结果表明,30%(4/14)的EEN患者在第6周未达到缓解。通过设置倍数改变大于4的阈值或FDR校正比较W06_rem与W06_nr,结果显示两组间代谢特征显著不同。与W06_nr相比,W06_rem的4种代谢物(3-苯乳酸、次黄嘌呤、葡萄糖酸内酯和AICAR)显著减少。与W06_rem不同,当比较基线(W0)与W06_nr时,无显著改变。虽然W06_nr的一些代谢物与基线相当,例如次黄嘌呤、24,25-二氢羊毛甾醇、15S-HETE、葡萄糖酸内酯、1-甲基烟酰胺和AICAR,但其他代谢物显示出部分改变,例如维生素K2和1-吡咯啉-5-羧酸。这表明,EEN诱导的缓解可能与EEN无反应者未表现出的某些代谢物水平变化有关。受影响最大的通路鞘脂代谢的变化反映了这一点,与EEN_W0相比,神经酰胺在EEN_W06_rem组显著减少,但在EEN_W06_nr组则未改变。与W06_rem相比,W06_nr中的嘌呤和嘧啶代谢显著富集。W0、W12_sr和W12_nsr之间的前10种差异显著代谢物的热图显示维生素K2和SM(d18:1/16:0)在W12_nsr中反弹至治疗前水平(图4)。
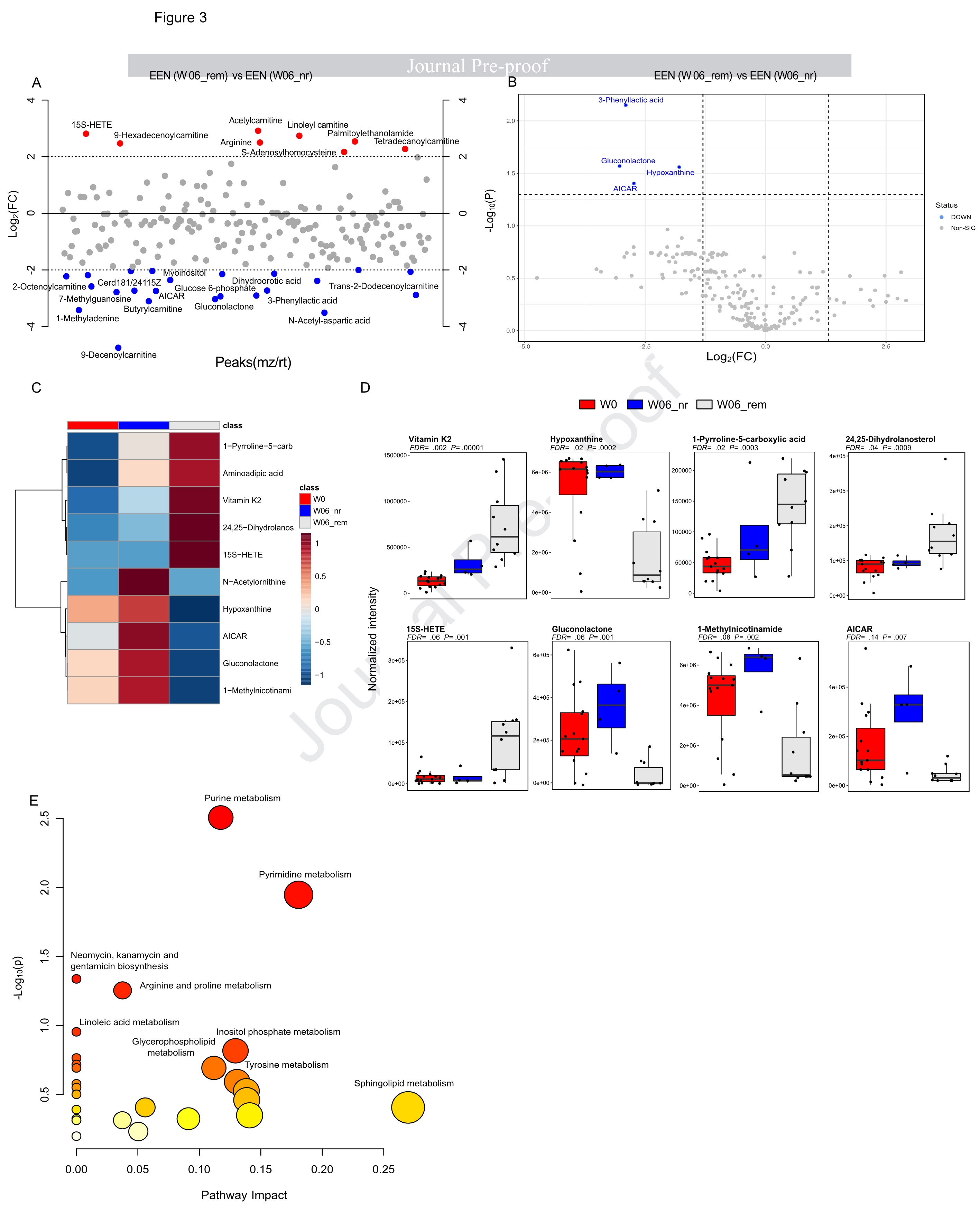
图4. EEN在W06时未达到缓解的患者显示出与W0相同的代谢物水平
CDED+PEN和EEN的代谢特征差异
在基线时,CDED+PEN和EEN的代谢物没有显著差异,表明研究的随机性很好。然而,在营养治疗6周后,PCA和PSL-DA显示CDED+PEN和EEN诱导的缓解存在显著分离,表明两种治疗诱导缓解的代谢特征不同。通过设置倍数改变大于4的阈值比较CDED+PEN W06_rem与EEN W06_rem。结果显示,与EEN相比,CDED+PEN中17种代谢物增加,2种代谢物减少。其中7种代谢物存在显著差异。CDED+PEN和EEN诱导的缓解显示出独特的代谢特征。虽然,与基线相比EEN W06_rem组中的甲氧基色胺、纤维二糖和Cer(d18:1/24:1(15Z))、Cer(d18:1/18:0)和Cer(d18:1/1:60)等神经酰胺水平降低,但它们在CDED+PEN W06_rem中无变化。与EEN W06组相比,CDED+PEN组的组氨醇水平增加。通路分析表明,一些富集通路存在差异,例如嘌呤、嘧啶和鞘脂代谢。这些通路在EEN中降低。在第12周,CDED+PEN和EEN持续缓解组的某些代谢物水平存在差异,且与神经递质的变化有关。虽然与W0相比,EEN持续缓解组表现出3-甲氧基肾上腺素水平减少,但CDED+PEN持续缓解组中血清素水平增加(图5)。

图5. CDED+PEN缓解组和EEN缓解组的代谢物水平不同,涉及嘌呤和鞘脂代谢
与营养治疗临床结果相关的潜在生物标志物
通过随机森林分析以获得缓解诱导的潜在标志物,犬尿氨酸具有与诱导症状缓解相关的最高诊断效能。随后又靶向验证了两种营养治疗中的犬尿氨酸水平,结果显示,犬尿氨酸水平显著减少(峰面积和浓度(ng/g)一致),与两种饮食诱导和持续缓解有关。通过ROC分析获得与CDED+PEN或EEN诱导和持续缓解相关的特征。AUC大于0.8的主要以代谢物的比值居多。分别在CDED+PEN W06_rem、CDED+PEN W12_sr、EEN W06_rem和EEN W12_sr中检测到19、22、27和22个生物标志物特征。某些嘌呤相关代谢物和氨基酸之间的比值是与诱导或持续缓解相关最相关的特征。在CDED+PEN W06_rem中鸟苷/3-苯乳酸比值显示出最高的AUC(0.92),而在CDED+PENW12_sr中获得的22个特征均显示AUC为1(例如鸟苷/N-乙酰丝氨酸,2-羟基戊二酸/鸟苷、谷氨酸/三磷酸鸟苷等)。嘌呤相关代谢物和色氨酸衍生物(AhR激动剂)之间的比值作为EEN W06_rem中的生物标志物特征诊断效能最强:三磷酸鸟苷/吲哚、三磷酸鸟苷/色氨酸和三磷酸鸟苷/吲哚-3-甲醛。当将两种治疗的数据(CDED+PEN)+(EEN)W0_rem和(CDED+PEN)+(EEN)W12_sr结合起来,结果一致(图6)。
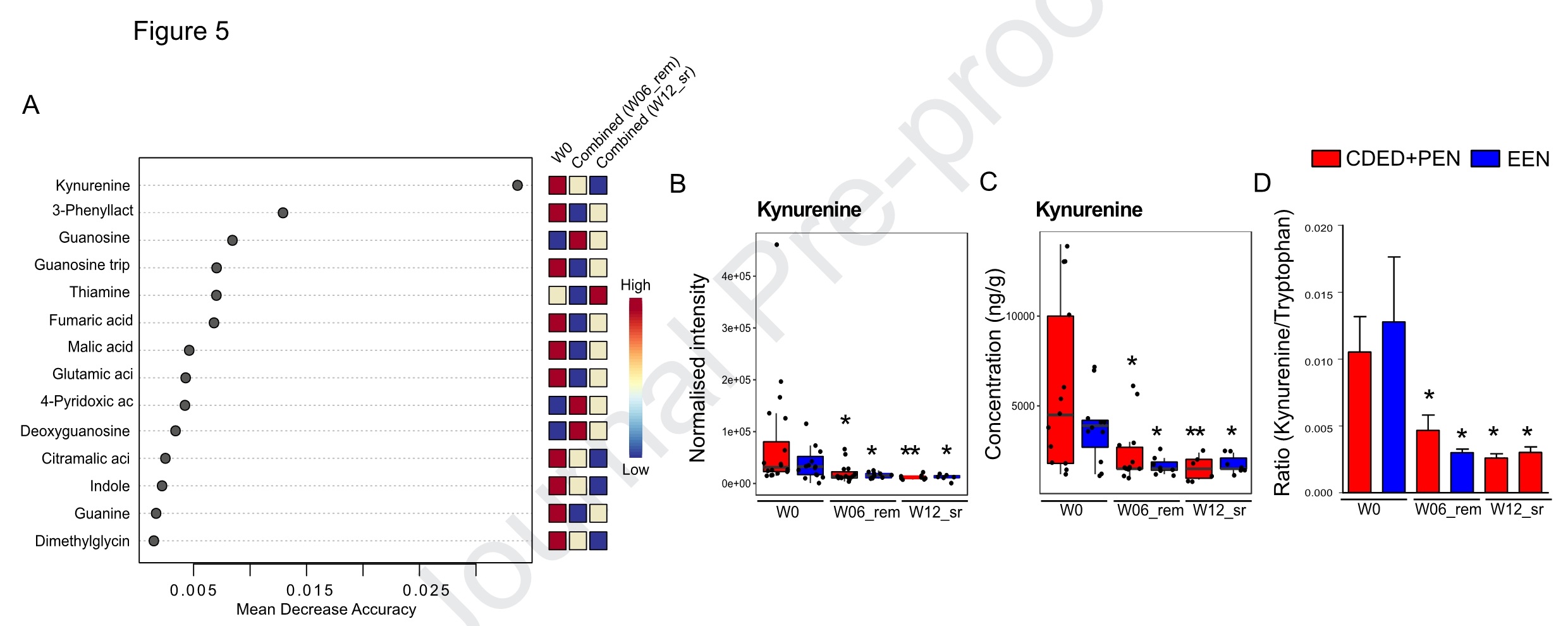
图6. 犬尿氨酸的改变与营养治疗的临床结果有关
宏基因组揭示功能丰度的潜在改变
肠道菌群的变化通常与功能基因丰度的变化有关,这有助于与临床缓解相关的代谢物谱的变化。粪便样本进行宏基因组分析,并通过KO分析研究特定通路中功能基因丰度的差异(受CDED+PEN和EEN高度影响的通路)。LefSE分析表明,W0组与W06_rem组间存在显著差异。虽然甘油磷脂代谢通路中的一些KO_ID表现出显著差异(如K01126、K00759),但嘌呤代谢通路的KO数量最多,有17个KO在W0组和W06_rem组之间显著不同(图7)。
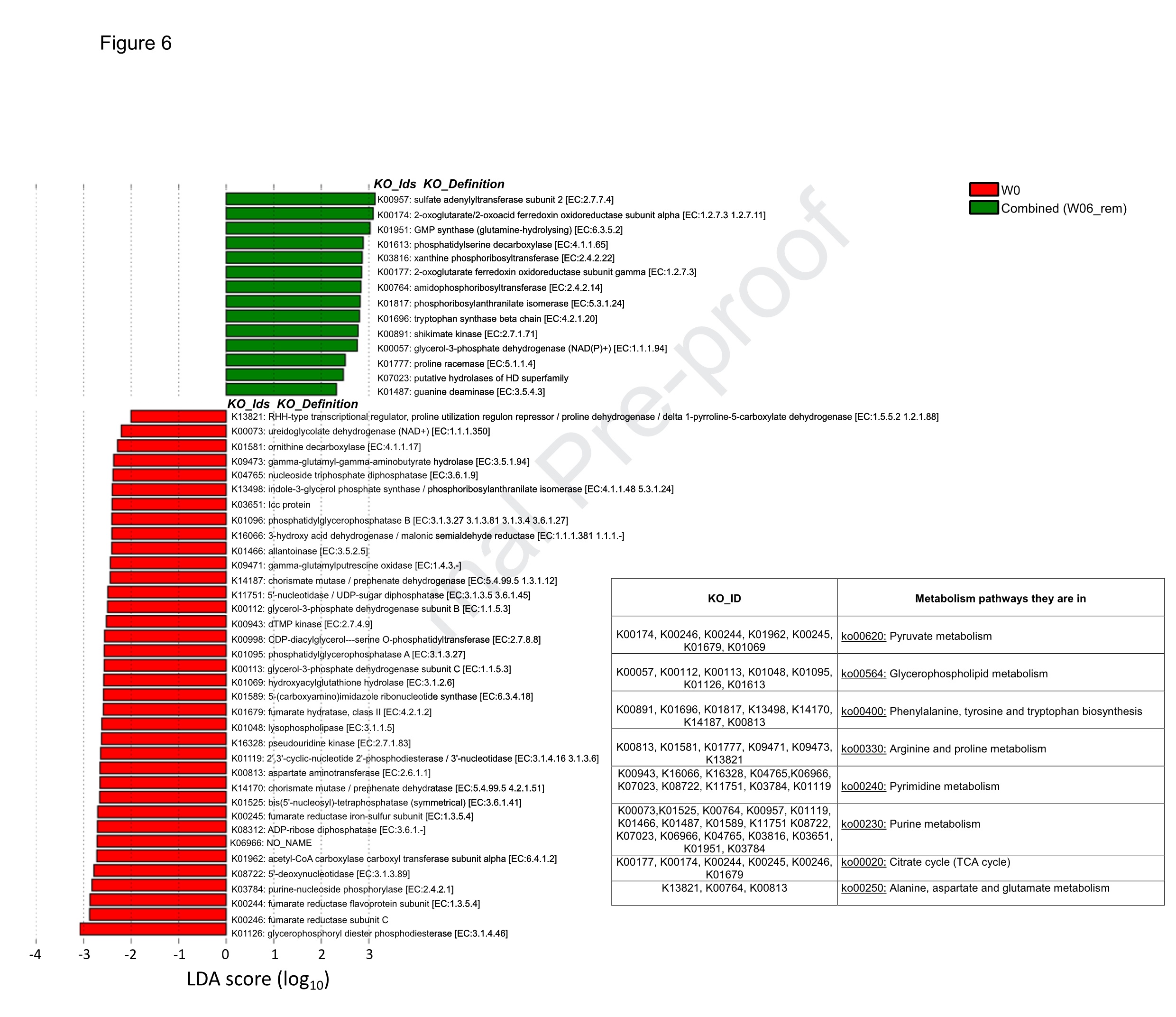
图7. 宏基因组的KO分析揭示与缓解相关的基因丰度改变
小结
本研究通过两种不同的营养治疗——CDED+PEN和EEN,对轻度至中度小儿CD患者进行治疗,并收集第0周、第6周和第12周的80份粪便样本进行代谢组学分析,揭示了IBD相关代谢通路变化与CDED+PEN和EEN的临床结果密切相关,例如犬尿氨酸、神经酰胺、嘌呤代谢、维生素、氨基酸和琥珀酸合成。CDED+PEN(而非EEN)的持续缓解与代谢物的持续变化有关。本研究揭示了肠道失调的纠正和相关的代谢组变化可能是调控营养治疗引起的缓解的关键机制。

图8. 研究小结
原文文献
Metabolome changes with diet-induced remission in pediatric Crohn’s disease. Gastroenterology. 2022.
请扫描二维码阅读原文

绘谱帮你测
本研究通过粪便代谢组学揭示了CDED+PEN和EEN诱导的粪便代谢物变化及其与疾病缓解的关系。粪便中微生物及各种代谢物含量丰富,已被证明与多种疾病的疾病发生发展及预后密切相关。麦特绘谱拥有业内强大的Q600全定量代谢组、Q300全定量代谢组、Q200宏代谢组以及菌群相关的16S rDNA测序和宏基因组等方法适用于包括粪便样本在内的多种生物样本分析并提供代谢组学一站式整体解决方案,独家的检测技术、全面的数据报告以及专业的售后探讨,助力您的科研探索之路不断创新和突破。详情欢迎咨询麦特绘谱热线400-867-2686,获取详细资料!



