文献解读
Nature Reviews Cancer | 肿瘤代谢最全解析
肿瘤发生和发展需要肿瘤细胞的代谢重编程。肿瘤细胞通过各种代谢途径自主改变其通量,以满足增加的生物能量和生物合成需求,并减轻肿瘤细胞增殖和存活所需的氧化应激。过去几十年,随着技术发展和应用,研究人员不仅揭示了肿瘤异质性和可塑性,同时还发现了维持肿瘤生长的新代谢途径。肿瘤微环境 (TME) 可能会出现某些营养物质耗尽,通过诱导营养物质清除机制来维持肿瘤细胞增殖,迫使肿瘤细胞适应。此外,TME中除肿瘤细胞类型代谢,还有内皮细胞、成纤维细胞和免疫细胞等,可以调节肿瘤进展。肿瘤细胞转移是死亡的主要原因,人们一直在致力于探究转移细胞如何调控代谢。利用肿瘤遗传分析对患者进行分层和/或饮食干预结合靶向代谢疗法也引起人们关注。因此,美国西北大学范伯格医学院Navdeep S. Chandel团队全面概况了肿瘤代谢领域的最新研究进展,并梳理了肿瘤代谢中尚未解决的关键问题,相关成果发表于《Nature Reviews Cancer》。

肿瘤代谢起源于 Otto Warburg研究 (Otto Warburg 因发现线粒体呼吸链复合体 IV 而获得 1931 年诺贝尔生理学或医学奖),他发现,与正常组织相比,体外癌组织切片即使在有氧情况下也可利用大量葡萄糖产生乳酸,这种现象称为有氧糖酵解或Warburg效应。20世纪90年代,人们发现参与糖酵解的乳酸脱氢酶 (LDHA) 是癌基因 MYC转录靶点,是肿瘤细胞糖酵解增加和致瘤所必需的,这为 Warburg 效应提供了分子基础。同时,还发现了磷脂酰肌醇-3-激酶(PI3K)、哺乳动物雷帕霉素靶蛋白(mTOR) 和缺氧诱导因子 (HIF)表达失调,是肿瘤生存和生长所必需的。这些途径分别通过葡萄糖转运蛋白和糖酵解酶的转录上调和磷酸化进而增加糖酵解。
本世纪初,大部分研究工作集中在为什么Warburg效应利于肿瘤生长。一种解释是,通过增加糖酵解,糖酵解中间产物可以进入合成代谢的侧通路从而维持细胞增殖所需的核苷酸、脂质和氨基酸从头合成。然而过去十年中,TCA 循环又重新成为促进肿瘤生长的一个关键的代谢中枢。尤其在肿瘤细胞中发现电子传递链(ETC)基因工程,保持ETC相关的 TCA 循环功能完整,但通过氧化磷酸化破坏ETC相关ATP 生成,体内肿瘤仍然保持生长,这表明糖酵解产生的 ATP 可以维持原发性肿瘤生长。此外,丙酮酸羧化酶 (PC),催化丙酮酸产生 TCA 循环代谢物草酰乙酸)已被证明是原发性和转移性肿瘤生长所必需的。草酰乙酸生成的天冬氨酸及天冬酰胺可限制肿瘤生长。这揭示了糖酵解和TCA循环可以通过代谢物生物合成维持肿瘤生长。
氧化代谢的结果之一是产生活性氧 (ROS),它可以促进肿瘤发生,但需要严格控制在不引起细胞死亡的水平上,即氧化还原平衡。代谢物除了其生物合成作用外,还可以作为信号分子通过调控基因表达(即肿瘤代谢物)来促进肿瘤生长。在过去几年中,该领域已从研究糖酵解和 TCA 循环的中心碳途径扩展到肿瘤生长、进展和转移所必需的多种分支代谢途径。除此之外,还有许多关键问题需要研究工作者进一步探讨,如:
1. 肿瘤模型和肿瘤患者中,如何检测肿瘤微环境(TME)中癌细胞和正常细胞的代谢异质性?
2. 与癌细胞相比,TME中非恶性细胞以及正常分化细胞的代谢和营养感知信号通路在发育、生理或不同病理过程中是如何发挥作用?
3. 为什么琥珀酸、富马酸或D/L-2-羟基戊二酸(d/l-2HG)的积累只在特定组织中发挥致瘤作用?这些代谢物如何改变基因表达?
4. 一些代谢酶如何通过催化的独立的机制驱动肿瘤进展?
5. 哪种活性氧(ROS),即超氧化物(O2-)、过氧化氢(H2O2)、羟基自由基(-OH)和脂质过氧化氢(LOOH),促进或抑制肿瘤发生和进展?相关ROS靶点是什么?
6. 组织来源、驱动突变和TME造成的体内代谢脆弱性是什么?
7. 是否存在不参与合成代谢途径的不同的代谢物可以促进转移性侵袭性细胞表型和转移性休眠?肿瘤细胞如何通过循环和淋巴系统改变其新陈代谢以维持细胞存活,最终导致肿瘤细胞远端定植?
8. 宿主机体代谢如何控制肿瘤发生和进展?不同肿瘤细胞在体内利用何种碳燃料?
9. 如何将靶向代谢途径与肿瘤遗传学、饮食和/或标准治疗(如免疫治疗)进行最佳联合?为什么目前针对代谢的有效疗法,例如5-氟尿嘧啶,对一些患者有效而对另一些患者无效?
10. 衰老是否通过细胞内和/或机体代谢变化增加癌症风险?
1.合成代谢和肿瘤生长
两个子细胞的产生需要促进细胞增殖的大分子(例如,核苷酸和脂质)。肿瘤细胞使用细胞内合成代谢途径从头合成大分子,也可以从循环系统中获取它们。这里有两个关键问题:(a)肿瘤生长的限速大分子是什么?(b) 调用哪些细胞内途径来维持体内肿瘤生长?这些过程可能取决于TME中可获得的大分子。最近两项研究揭示,在胰腺癌和肺癌中,基于致癌基因鼠类肉瘤病毒癌基因(KRAS)和抑癌基因p53 缺失进行CRISPR体内筛选与血红素和核苷酸合成相关基因。其中,血红素合成对于线粒体 ETC 功能是必需的。另外,致癌 KRAS和p53缺失细胞中,血红素和核苷酸合成所必需的糖酵解、一碳代谢以及线粒体ETC和TCA循环途径相关酶的编码基因也具有重要作用。不过还需要不同肿瘤模型来验证。通过同位素标记葡萄糖发现体内肿瘤代谢通量有所升高,同时发现相同组织不同基因型和不同组织相同基因型的代谢存在不同,说明肿瘤代谢谱与基因型和起源组织有关。这些技术应该是提出假设的发现工具,而不是用于阐述因果关系。总的来说,通过定量检测方法寻找肿瘤代谢差异将再次成为重要工具(图1)。
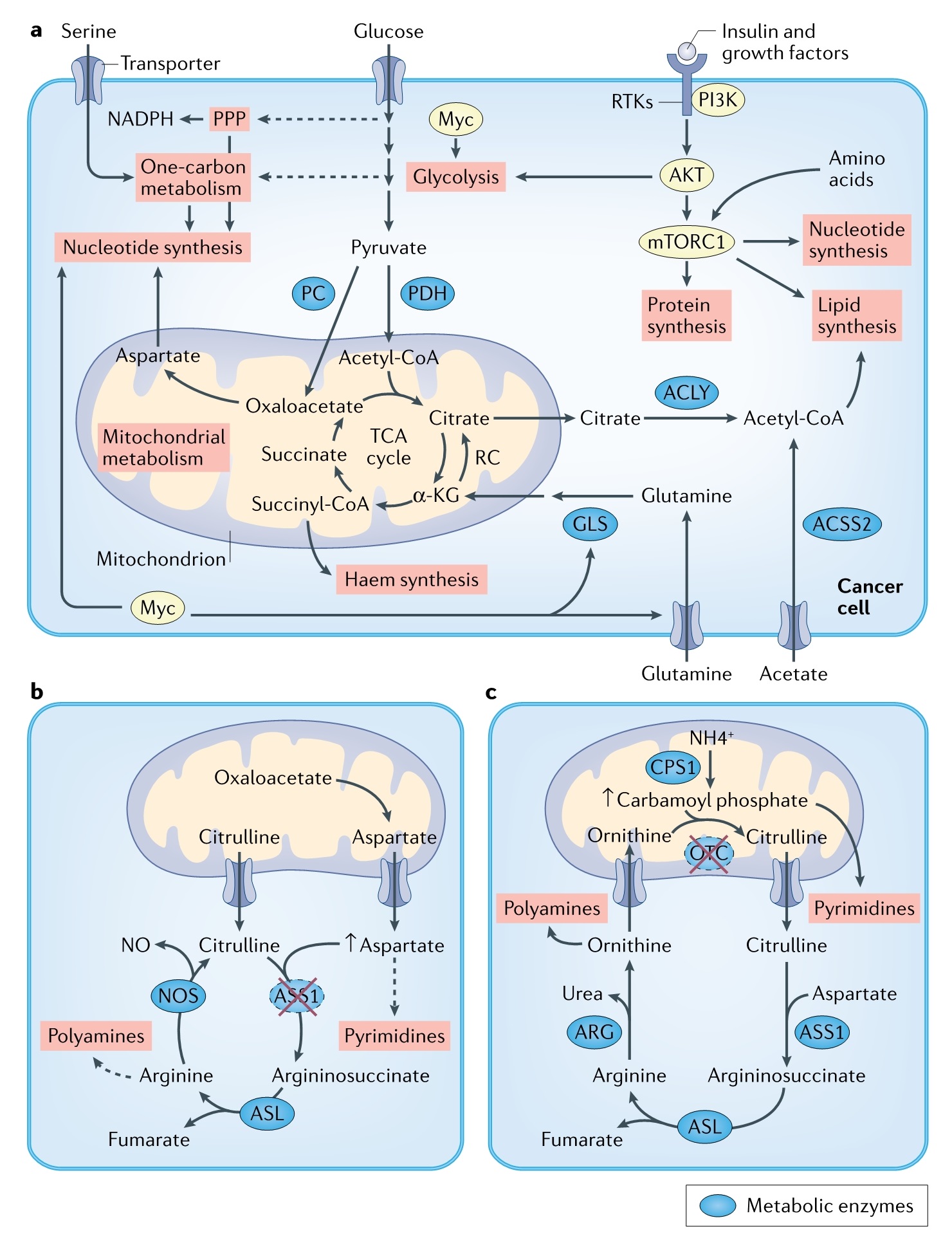
(图1)
2.参与的信号通路
肿瘤细胞可选择信号通路和转录网络(例如,PI3K-AKT-mTORC1 和 MYC)增加代谢通量以维持增殖。肿瘤抑制因子如 p53 也可以调节细胞代谢。研究表明,p53 在淋巴瘤小鼠模型中的主要肿瘤抑制功能与典型的 p53 依赖性肿瘤抑制功能(例如,细胞周期停滞、细胞凋亡或衰老)无关,而是与代谢和抗氧化功能密切相关。mTORC1 通路已成为营养传感的中心节点,并通过脂质和核苷酸合成等通路增加合成代谢通量。寻找到肿瘤细胞在 MYC 和 mTORC1 过度激活时的代谢脆弱性,并进行干预或许可以减少肿瘤细胞的增殖和存活。正常组织和肿瘤组织中的信号通路如何感应营养输入及调控代谢通路,两者之间是否不同?基于组织不同的营养环境,是否存在组织特异性控制信号通路?这些待解决的问题将为正常细胞和肿瘤细胞体信号传递和代谢途径提供新的见解。
3.作为信号分子的代谢物
某些组织琥珀酸脱氢酶 (SDH)、延胡索酸水合酶 (FH)、异柠檬酸脱氢酶(IDH1 或 IDH2)的编码基因突变后,琥珀酸、延胡索酸和 2-羟基戊二酸 (2HG) 水平增加,特定组织中这些肿瘤代谢物的任何一种积累都有助于恶性肿瘤的发展。例如,SDH 功能缺失突变常见于遗传性副神经节瘤、嗜铬细胞瘤和胃肠道间质瘤,而 FH缺失突变会导致遗传性平滑肌瘤和肾细胞癌。但问题是,有些细胞失去二个等位基因后发生转化而有些细胞没有,而且更重要的是携带SDH和/或FH突变的肿瘤细胞仍然能够产生TCA 循环代谢物用于生长所需。因此,肿瘤细胞必须进行代谢重编程以适应这些突变并确保合成增殖所需的大分子,且大多数组织很可能对这些突变具有耐受性。
琥珀酸、延胡索酸和2HG如何在某些组织中发挥致瘤作用呢?这些代谢物由于与 α-KG结构相似从而竞争性抑制 α-KG 依赖的双加氧酶 (α-KGDDs)。这些肿瘤代谢物可以抑制双加氧酶从而调节表观遗传修饰的。此外,致癌代谢物如何改变特定组蛋白或特定位点的DNA甲基化来改变基因表达在很大程度上尚不清楚。除了癌症,这些致癌代谢产物还与各种组织功能有关,包括免疫功能和机体代谢调控。还有很多代谢物不断被发现,它们除了促进生物质合成之外,还可以决定细胞的命运和功能(图 2)。
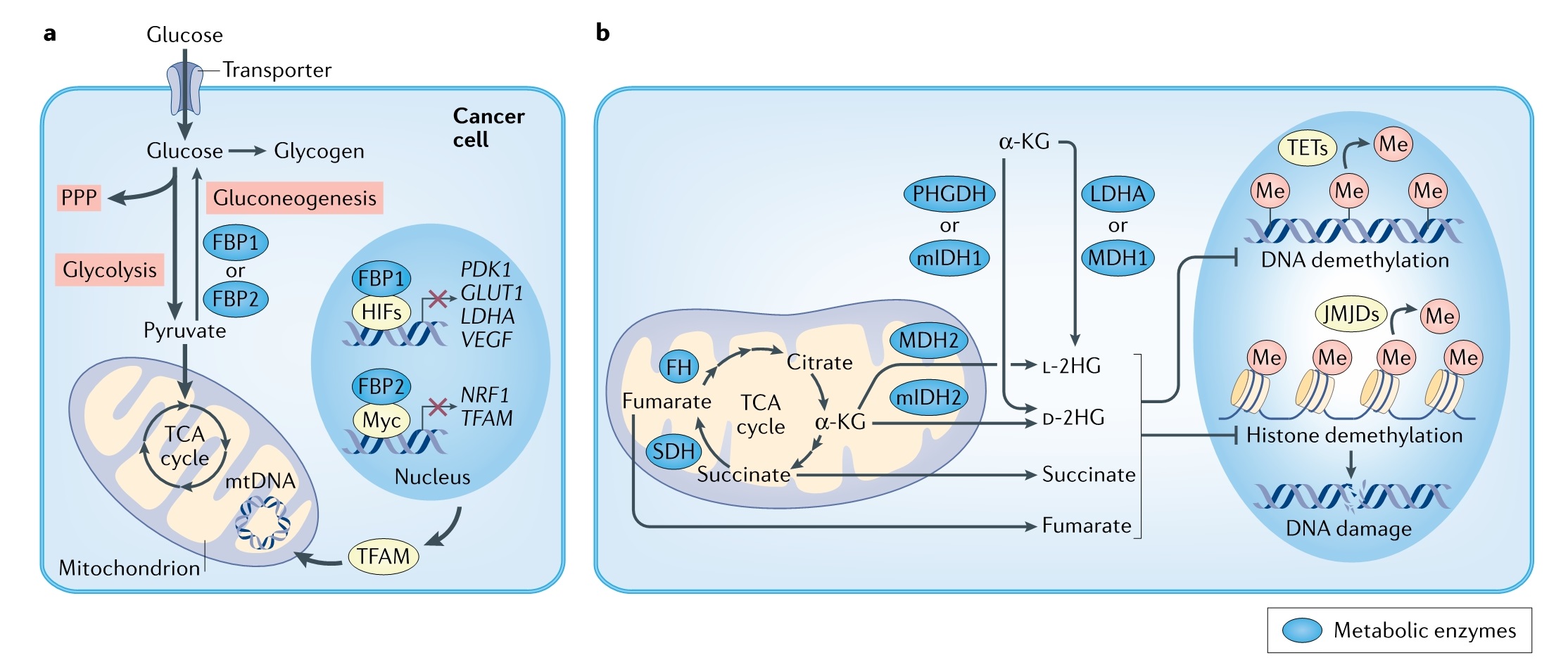
(图2)
4. ROS在肿瘤中的作用
肿瘤细胞产生的ROS主要种类是超氧化物(O2-)、过氧化氢(H2O2)、羟基自由基(-OH)和脂质过氧化氢(LOOH)。肿瘤细胞线粒体 ETC 和 NADPH 氧化酶产生超氧化物的速度很高,经超氧化物歧化酶1 (SOD1)或SOD2速转化为H2O2。H2O2主要是一种信号分子,可以通过氧化还原信号促进癌细胞增殖、存活和侵袭,也可通过过氧化物酶解毒成水。而其他形式ROS,如LOOH、OH和O2-可以导致蛋白质、脂质、线粒体和核DNA氧化而产生毒性。稳定状态下,任何类型ROS水平都是由相对于ROS清除速率的ROS产生速率所决定。相比于正常细胞,肿瘤细胞抑制抗氧化蛋白可以增加癌细胞中ROS暴露。说明肿瘤细胞ROS产生率高于正常细胞。不过胰腺癌研究表明限制ROS水平是肿瘤细胞起始发生的必要条件,而维持ROS水平则会促进转移。相比之下,通过饮食中抗氧化剂来限制ROS水平或抑制铁死亡会促进黑色素瘤细胞转移。尽管这些结果存在矛盾,但它们可能反映出肿瘤进展不同阶段ROS类型及水平的不同影响。因此,需要开发特定方法测量不同类型ROS,以及在肿瘤进展过程中调节不同类型ROS干预方式,从而明确ROS生物学功能(图 3)。
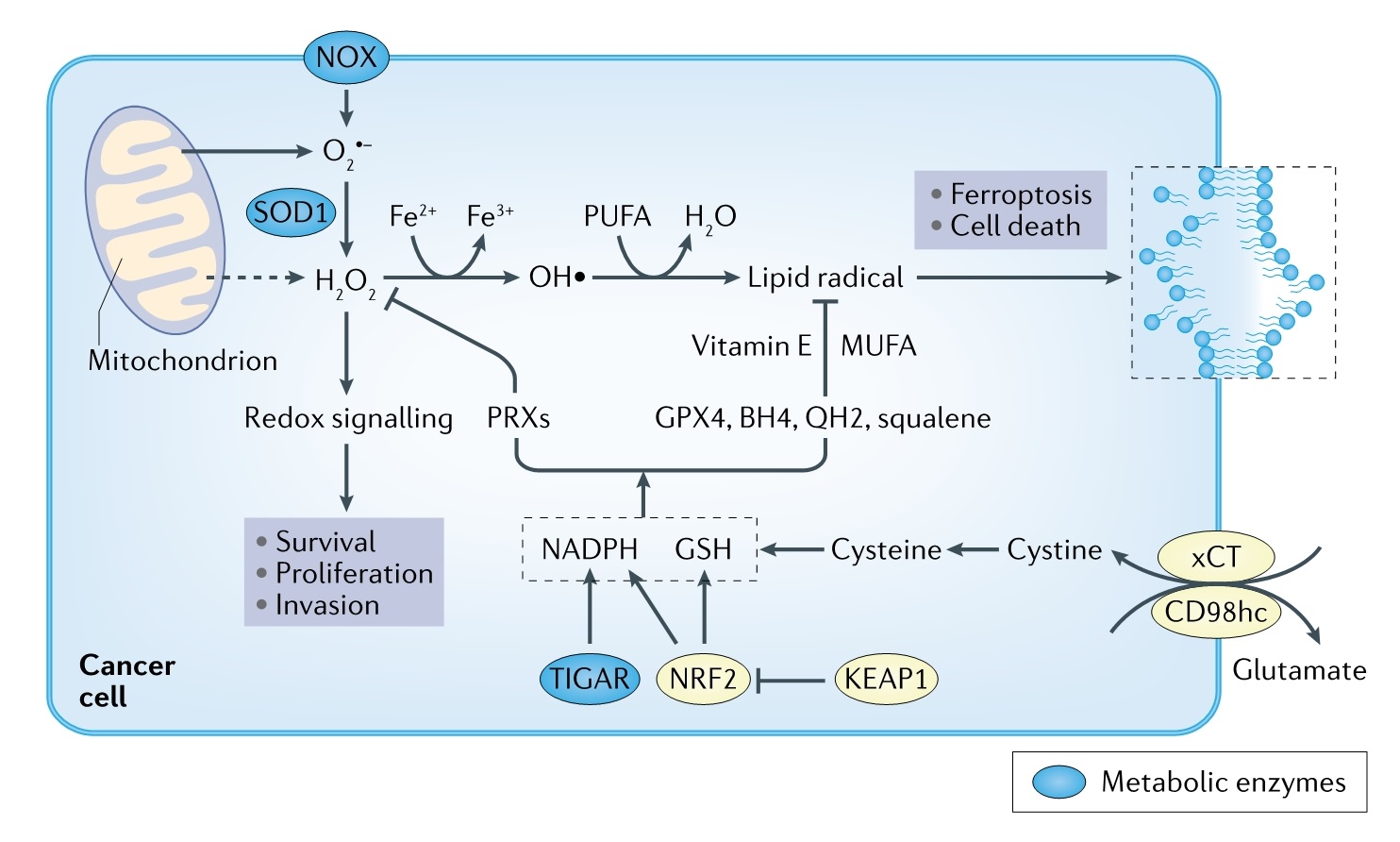
(图3)
5.营养可用性
尽管肿瘤细胞中代谢重编程已被广泛研究,但肿瘤细胞在低营养和酸性TME中增殖机制尚不清楚。肿瘤类型、位置和宿主饮食可共同影响营养的可用性。当营养素或生长因子稀缺时,自噬是细胞存活和增殖的关键途径之一。胰腺癌和肺癌研究表明,抑制自噬会损害肿瘤进展。此外,系统性自噬抑制通过肝脏释放精氨酸酶 1 (ARG1)减少肿瘤生长,导致循环精氨酸降解,这对于缺乏合成细胞内精氨酸能力的肿瘤细胞的生长至关重要。巨胞饮作用是另一种促进细胞适应营养缺乏的途径,它允许细胞内化细胞外蛋白质和坏死细胞碎片(细胞坏死),并将它们递送到溶酶体中降解,从而促进大分子合成并进入中央碳代谢途径(图 4)。
6.TME代谢
除了营养可用性和酸性条件变化外,TME由不同细胞类型组成从而又助于控制肿瘤进展的。一个简单的模型:内皮细胞和基质细胞可维持肿瘤生长,而细胞毒性T细胞 (CTL) 可抑制肿瘤进展,尽管CTL可以被某些骨髓细胞和调节性T细胞抑制以维持肿瘤生长(图 4)。一碳代谢、糖酵解和 TCA 循环等中央碳通路不仅对肿瘤细胞增殖至关重要,而且对内皮细胞、基质细胞、CTL、调节性T细胞和骨髓细胞功能也至关重要。因此,肿瘤细胞必须与 TME 中其他类型细胞竞争营养。例如,TME内某些氨基酸代谢可能被限制,包括精氨酸、色氨酸、丙氨酸、丝氨酸和甘氨酸,它们不仅是肿瘤细胞增殖所必需的,也是CTL功能维持所必需的。除了作为营养匮乏的肿瘤细胞生存机制的细胞自主作用之外,自噬还控制肿瘤细胞如何增加TME局部免疫抑制以及系统生物体依赖性免疫抑制机制。除了营养竞争外,TME 中不同细胞类型之间也存在代谢干扰,这是肿瘤细胞在不利条件下持续生长的策略。
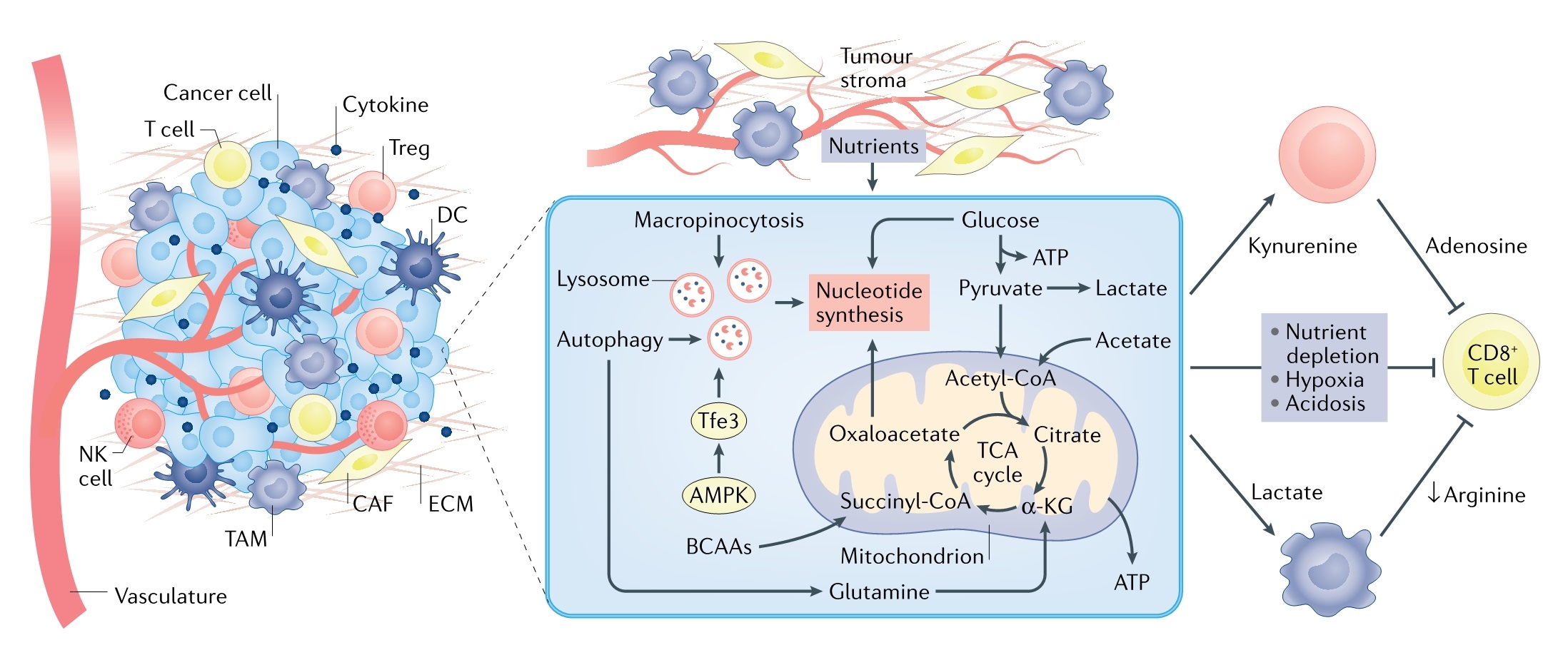
(图4)
7.转移的代谢调控
肿瘤转移是肿瘤患者死亡的主要因素,破译转移和定植远端部位的细胞的代谢脆弱性是至关重要的。代谢变化与转移中每一个连续的多步骤过程有关:基底膜侵入和细胞迁移到周围血管或淋巴系统(即血管内);在循环系统中生存;从血管系统外渗和继发性肿瘤部位定植。未来几年,人们将重点关注对转移至关重要的代谢途径。某些代谢物可以通过充当信号分子来促进 EMT。此外,与原发性肿瘤相比,哪些代谢物调控远端转移性生态位生长的信号通路尚不清楚。而且,关于代谢如何促进转移的不同步骤,仍有许多问题有待研究(图 5)。
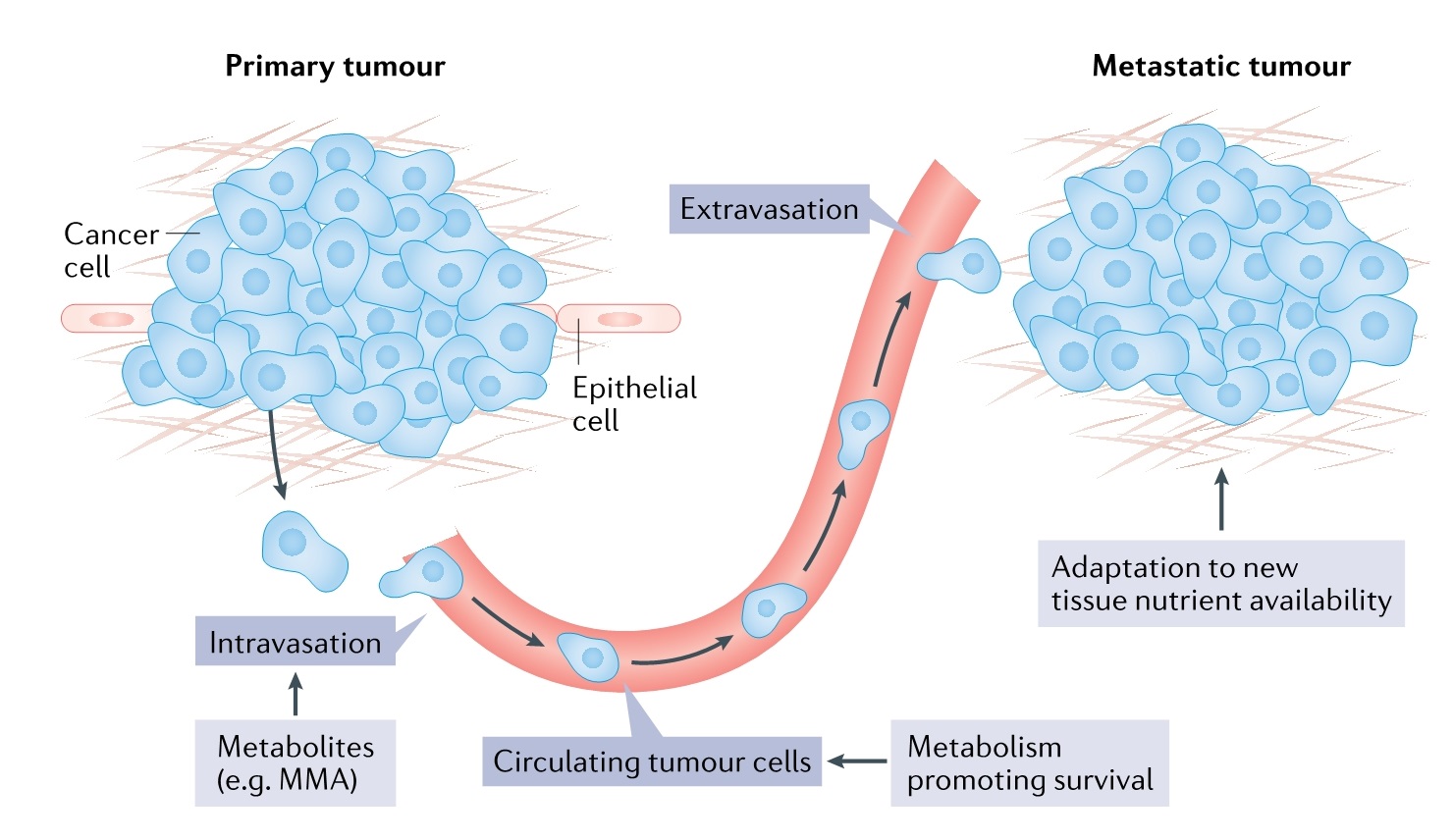
(图5)
8.靶向代谢治疗
核苷类似物是最早用于肿瘤治疗的化疗药物之一。然而,它们不仅会影响肿瘤细胞,还会影响正常增殖细胞。代谢酶是具有吸引力的潜在治疗靶点,但由于多种原因,针对代谢的新药比较少。除了肿瘤细胞内代谢和TME中其他细胞类型外,人们认识到机体代谢对于肿瘤治疗的功效至关重要。目前尚不清楚靶向代谢物生成是否能够在大多数肿瘤细胞中诱导细胞毒性。因此,需要确定特定肿瘤中特异性的、依赖于驱动突变的代谢脆弱性,将其与放射、化学疗法或免疫疗法协同作用以诱导细胞毒性(图 6)。
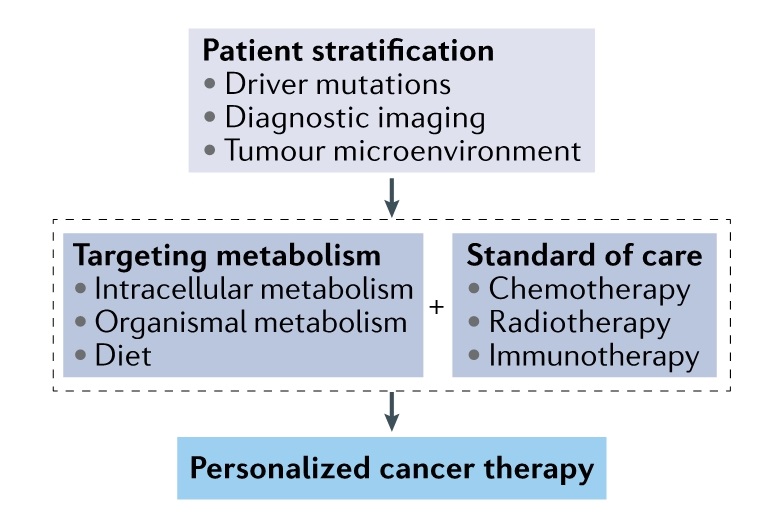
(图6)
总结
肿瘤代谢领域已经从Warburg效应发展到目前对肿瘤巨大代谢复杂性的了解。人们对TME施加的代谢限制和TME内不同细胞组成如何影响肿瘤进展有了认识。新技术的应用使得发现新的代谢蛋白和肿瘤细胞在肿瘤发生、进展和转移过程中新代谢途径成为可能。本研究概况总结了肿瘤代谢最新研究进展,包括促进肿瘤生长的信号传导和代谢途径、肿瘤代谢物如何促进肿瘤发生的分子基础、肿瘤细胞如何在肿瘤进展过程中保持氧化还原平衡、宿主和TME的代谢限制、以及靶向代谢用于肿瘤治疗的新方法,并强调了在肿瘤代谢中尚未解决的关键问题。
参考文献
Inmaculada Martínez- Reyes, Navdeep S. Chandel, et al. Cancer metabolism: looking forward. Nature Reviews Cancer. 2021.
原文阅读,请长按识别下方二维码

绘谱帮你测
肿瘤代谢的重要性越来越受到关注。靶向代谢组学可对生物样品中的数千个小分子进行全面、系统的分析,可以灵敏捕捉到机体代谢的细微变化,是寻找疾病生物标志物或药物靶标的有力工具。麦特绘谱拥有成熟的代谢物定性和定量平台,开发出Q300全定量代谢组、宏代谢组、能量代谢,以及同位素示踪/代谢流等不同的靶向代谢组检测方法,致力于提供肿瘤代谢研究多角度解决方案,详情欢迎咨询麦特绘谱热线400-867-2686。
精彩推荐
Nature Communications | 肿瘤微环境中的细胞代谢差异
Cell Metabolism | 支链氨基酸分解代谢的丧失增强mTORC1的活性并促进肿瘤的生长和进程
Journal of Hepatology | STARD1通过胆汁酸促进NASH向肝癌发展



