文献解读
Nature | 百岁老人不易得慢性病被解密:体内富含新的胆汁酸生物合成途径
长期以来,微生物组通过其在免疫力和抵抗病原体感染等方面的作用,被认为是决定老年人健康状况的关键因素。老年人体内的微生物群落通常表现出个体差异的增加和多样性的减少,因此与免疫衰老、慢性全身炎症和虚弱有关。而百岁老人(100 岁及以上)却不太容易患上与年龄相关的慢性病,推测百岁老人肠道微生物群中存在特有的成员,能促进对病原体感染和其他环境压力的抵抗力。日本庆应义塾大学Yuko Sato团队展示了百岁老人独特的肠道微生物群,富含能够产生独特的次级胆汁酸 (如Isoallo-LCA) 的微生物,这些次级胆汁酸代谢能够抑制革兰氏阳性菌的生长,对肠道菌群结构造成直接影响。相关成果发表于《Nature》。

百岁老人的肠道菌群特征
招募一个由三个年龄段组组成的队列:百岁老人(平均107岁,n = 160)、老年人(85-89 岁,n=112)和年轻人(21-55岁,n=47)。临床数据表明大多数百岁老人没有肥胖、糖尿病、高血压和癌症等慢性病,与老年人组相比,这些疾病的患病率无显著增加。收集三组粪便样本并表征其微生物组(不包括3名百岁老人和1名接受抗生素治疗的老年人)。主坐标轴分析(PCoA)显示百岁老人和两个对照组之间的菌群组成存在显著差异。其中一些类群在百岁老人组和对照组中显示出不同的丰度。Alistipes、Parabacteroides、Bacteroides、Clostridium和 Methanobrevibacter在百岁老人中显著富集,其中Clostridium scindens具有7α-脱羟基功能,可以将初级BAs转化为次级BAs。
百岁老人独特的胆汁酸特征
宏基因组分析结果显示,百岁老人组中,诱导胆汁酸(bai)操纵子基因的相对丰度增加,随后对粪便胆汁酸的分析结果显示,各组的总胆汁酸负荷无显著差异,但百岁老人表现出其独特的分布,包括初级BAs水平较低,鹅去氧胆酸 (CDCA) 代谢物水平升高,且异石胆酸(isoLCA)、3-oxoLCA、alloLCA、3-oxoalloLCA和isoalloLCA的水平在百岁老人组中显著升高,而在老年人组和年轻对照组中则相对较低。此外,粪便pH值与这些BAs的浓度呈正相关,肠道环境可能会促进某些菌群的繁殖和/或参与这些BA合成酶的表达和活性。
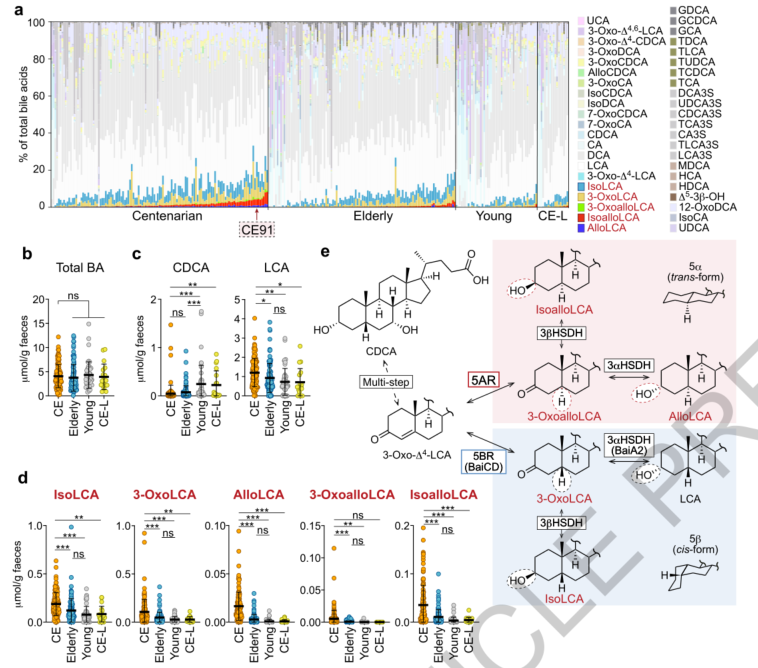
图1. 百岁老人的粪便 isoLCA、3-oxoLCA、alloLCA、3-oxoalloLCA 和 isoalloLCA 显著升高
产生isoLCA-、3-oxoLCA-、3-oxoalloLCA-和isoalloLCA-细菌菌株的鉴定
有研究指出E.lenta和Ruminococcus gnavus可通过3α-羟基类固醇脱氢酶(3αHSDH)和3βHSDH分别催化DCA和3-oxoDCA生成3-oxoDCA和isoDCA 。因此,推测3-oxoLCA和isoLCA以类似的方式通过5BR、3αHSDH和3βHSDH的作用产生。另外,3-oxoallo-、allo- 和isoallo-LCA生成的合成途径此前尚未确定。推测3-oxoalloLCA可能是由3-oxo-Δ4-LCA通过5α-还原酶(5AR)同源物生成的。而3-oxoalloLCA转化为alloLCA或isoalloLCA可能分别使用3αHSDH或3βHSDH,这与之前描述的3-oxoDCA转化为DCA或isoDCA的过程相一致。
随后对一名富含这些次级胆汁酸的百岁老人(CE91,超过110岁)粪便样本进行培养,并分离出68株独特的菌株,这些菌株概括了CE91的菌群结构。然后,分别用CDCA、LCA 或3-oxo-Δ4-LCA作为起始底物培养单个分离物。结果显示,与CDCA共培养不会导致任何培养物中产生目标BAs,而与LCA或3-oxo-Δ4-LCA共培养后,在68株菌株中分别有12株具有产生3-oxoLCA的能力和8株具有产生isoLCA的能力,表明这些菌株具有3αHSDH、3βHSDH和/或5BR活性。而且,与3-oxo-Δ4-LCA共培养后,在Parabacteroides merdae St3、Odoribacter Laneus St19、Odoribacteraceae spp.St21-24以及较低程度的Bacteroides dorei St6-7的培养物中观察到isoalloLCA的显著积累,表明这些菌株同时具有5AR 和3βHSDH酶活性。此外,P. goldsteinii St1-2、Bacteroides thetaiotaomicron St9、B.uniformis St10-13、Alistipes finegoldii St15-16、A. onderdonkii St17-18和O. Laneus St20 培养物都显示出3-oxoalloLCA的显著富集,但isoalloLCA的水平却很低或没有,可能是由于在这些培养条件下携带5AR但3βHSDH的活性缺乏或不足。共发现20个拟杆菌属菌株能够将 3-oxo-Δ4-LCA转化为3-oxoalloLCA,其中8个能够产生isoalloLCA。AlloLCA始终低于检测限,表明携带5AR的分离株在测试培养条件下 3αHSDH的活性缺乏或不足。
5AR-和3βHSDH介导3-oxo-Δ4-LCA向isoalloLCA的转化
对68个分离株进行基因组测序分析,鉴定到21个拟杆菌属中存在与人5AR (SRD5A1) 直系同源的序列,氨基酸序列相似性>30% 。在21个菌株中,发现与胆汁酸代谢功能相关的基因簇,包括注释为NADH:黄素氧化还原酶的序列,预测为5BR。还鉴定到注释为短链脱氢酶 (SDR)的序列,预测其为3βHSDH。其中3βHSDH序列包括两组:I组序列 (3βHSDH-I)与P. merdae St3 3βHSDH显示出高度相似性 (>40%),而II组序列 (3βHSDH-II) 彼此密切相关但与P.merdae 3βHSDH没有相关性。推测5AR和3βHSDH基因簇的携带与体外3-oxo-Δ4-LCA的 3-oxoalloLCA和isoalloLCA 产生明显相关。基因组序列还揭示了P. distasonis、Raoultibacter和Eggerthella菌株携带3αHSDH基因。表明上述鉴定的拟杆菌目基因簇可以协同产生isoalloLCA和相关BAs。
构建缺乏编码5AR、3βHSDH或5BR的基因的P. merdae St3突变体,正如预期的那样,当与3-oxo-Δ4-LCA一起培养时,P. merdaeΔ5AR无法产生3-oxoalloLCA或 isoalloLCA,而P. merdaeΔ3βHSDH能够产生3-oxoalloLCA但不能产生isoalloLCA。同样地,当与3-oxoalloLCA一起培养时,P. merdaeΔ5AR以类似于野生型菌株的方式产生isoalloLCA,而 P. merdaeΔ3βHSDH 则不能产生。P. merdaeΔ3βHSDH也不能将3-oxoLCA转化为 isoLCA,证实3βHSDH可以利用反式和顺式BAs作为底物。P. merdaeΔ5BR从3-oxo-Δ4-LCA 或 3-oxoalloLCA产生isoalloLCA,但在将3-oxoLCA 转化为3-oxo-Δ4-LCA时表现出缺陷。这些结果证实了5AR、3βHSDH和5BR参与了人类肠道菌群产生3-oxoLCA、isoLCA、3-oxoalloLCA和isoalloLCA。
那么这些分离株是否可以在体内产生大量的isoalloLCA?把选定12种的拟杆菌属分离株分别定殖于无菌 C57BL/6 (B6) 小鼠体内,并喂食含3-oxo-Δ4-LCA的饮食。粪便胆汁酸分析结果显示只有Odoribacteraceae菌株能诱导isoalloLCA的大量积累。尽管P. merdae St3在体外可以将3-oxo-Δ4-LCA转化为isoalloLCA,但在体内仅检测到较低水平的isoalloLCA。用P. merdae St3而非P. merdaeΔ5AR定殖的小鼠粪便中表现出显著的3-oxoalloLCA积累,表明P. merdae 5AR在体内活性较弱。B.uniformis、B.thetaiotaomicron 和B.dorei 能够产生3-oxoalloLCA,但不能有效地将其转化为isoalloLCA。总之,体内数据表明共生5AR和3βHSDH的活性依赖于环境,并且肠道环境(至少在小鼠中)有利于 Odoribacteraceae产生isoalloLCA。
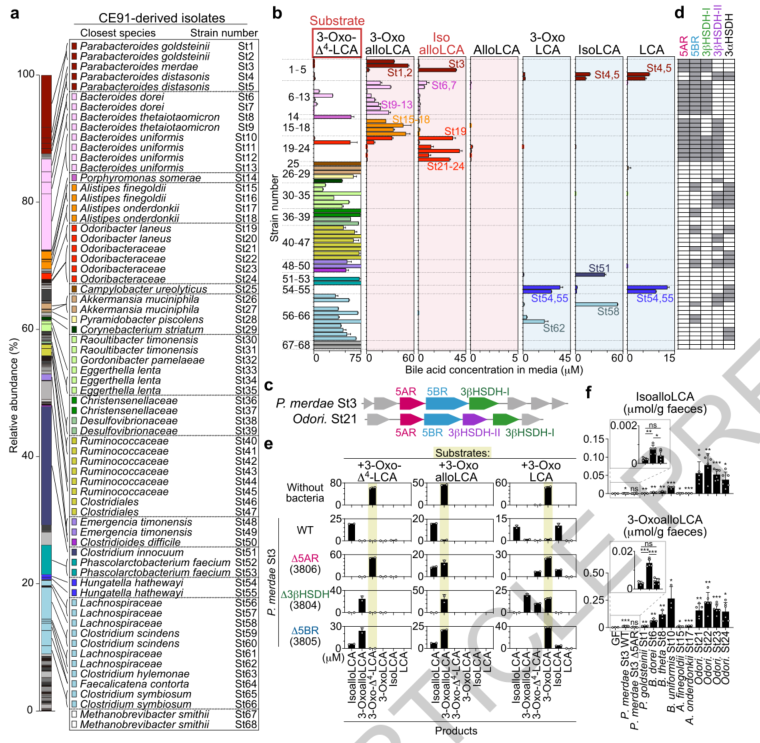
图2. 鉴定参与isoalloLCA和相关BAs产生的细菌菌株和基因
IsoalloLCA对革兰氏阳性病原体的抗菌作用
已知次级BAs可以调节宿主代谢和免疫反应(包括调节T细胞)和防止肠道病原体扩增。用百岁老人体内显著富集的次级BAs分别与不同类型革兰氏阳性和阴性病原体共培养,结果显示isoalloLCA可显著抑制所有测试革兰氏阳性病原体的生长,在WCA培养基中抑制90%生长所需的最小抑制浓度(MIC90)值范围为0.5-3μM,在BHI培养基中为3-6.25μM。相比之下,所有革兰氏阴性病原体都对isoalloLCA具有抗性。电子显微镜分析显示isoalloLCA具有杀菌作用,诱导了C. difficile和VRE的形态学改变,包括塌陷、肿胀和多重横壁。这些结果表明,isoalloLCA对革兰氏阳性病原体具有强烈的杀菌/抑菌作用。
将来自艰难梭菌感染(CDI)患者的粪菌移植到无菌B6小鼠,并喂食含0.1% isoalloLCA的饮食。结果显示isoalloLCA给药显著减少了C. difficile的脱落。随后使用Cyp2c70-/- cyp2a12-/-双敲除(Cyp DKO)小鼠,该小鼠模拟了具有高水平LCA衍生物和缺乏鼠胆酸(MCA)的人类胆汁酸谱。用C. difficile 630感染SPF Cyp DKO小鼠后用Odoribacteraceae St21反复灌胃。Odoribacteraceae给药显著增加粪便isoalloLCA水平并显著抑制了艰难梭菌脱落,使其低于检测下限。相比之下,尽管Odoribacteraceae植入程度相似,但接受相同处理的野生型小鼠未能产生isoalloLCA并抑制艰难梭菌脱落。这些结果表明 Odoribacteraceae及其衍生物BAs(包括 isoalloLCA),有助于抑制革兰氏阳性病原体在体内的扩增。
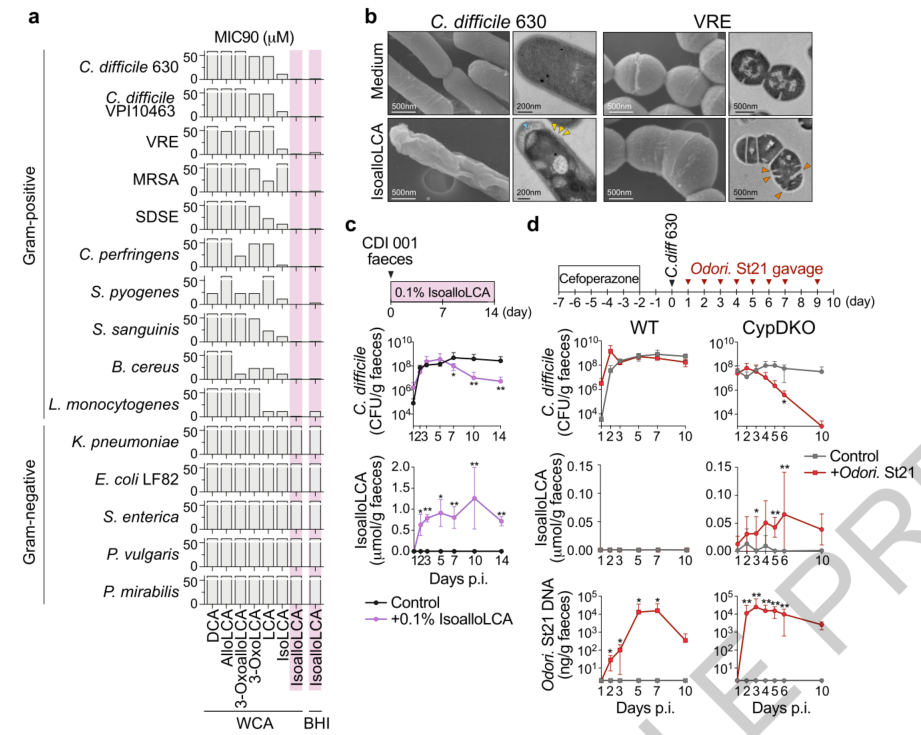
图3. IsoalloLCA对革兰氏阳性病原体具有强大的抗菌活性
isoalloLCA对共生肠道菌群的影响
随后将Bas与培养健康志愿者粪便共培养。与IsoalloLCA孵育后,革兰氏阳性菌(如Faecalibacterium、 Bifidobacterium、Streptococcus)显著减少,而革兰氏阴性菌(如Bacteroides、Alistipes)相应增加。与百岁老人肠道菌群中Bacteroides和Alistipes的富集和Streptococcus的消失相一致,这表明IsoalloLCA可直接影响肠道菌群结构并保护肠道免受潜在病原体侵害。
肠道菌群结构与胆汁酸谱的关联
对参与者宏基因组数据进一步分析发现,在35个物种(所有Bacteroidales)中鉴定出5AR和3βHSDH基因簇。这些基因簇可分为三组:V1、V2和V3。V1簇包含5AR以及3βHSDH-I 和3βHSDH-II,存在于Odoribacter的基因组中,V3簇包含5AR和3βHSDH-II,存在于Alistipes的基因组中。而V2簇包含5AR和3βHSDH-1,并由不同的Bacteroidales物种携带。同时V1和V3簇与队列中粪便isoalloLCA、3-oxoalloLCA、alloLCA、3-oxoLCA 和 isoLCA 的水平呈正相关。并且携带V1或V3的Odoribacter和Alistipes物种在百岁老人中比其他群体更丰富。而V2簇的丰度与这些BAs的浓度呈负相关,这表明5AR与3βHSDH-II(而非3βHSDH-I)一起携带是产生isoalloLCA和相关BAs所必需的。
随后将菌群分为三种类型(称为群落类型1、2 和 3)。结果显示年轻群体的群落结构主要是2型,而百岁老人主要是3型,其次是1型。重要的是,群落类型1和3的个体,相对于携带V2的个体,携带V1和V3物种的菌群丰度更高。此外,在群落类型1和3的个体中观察到更高水平的3-oxoLCA、isoLCA、alloLCA、3-oxoalloLCA和isoalloLCA,而这一趋势在CDCA中则相反。这些结果进一步验证肠道菌群结构影响肠道BAs,并且群落类型1和3与日本百岁老人有关,并可能产生有助于isoalloLCA物种扩展和发挥功能的环境。
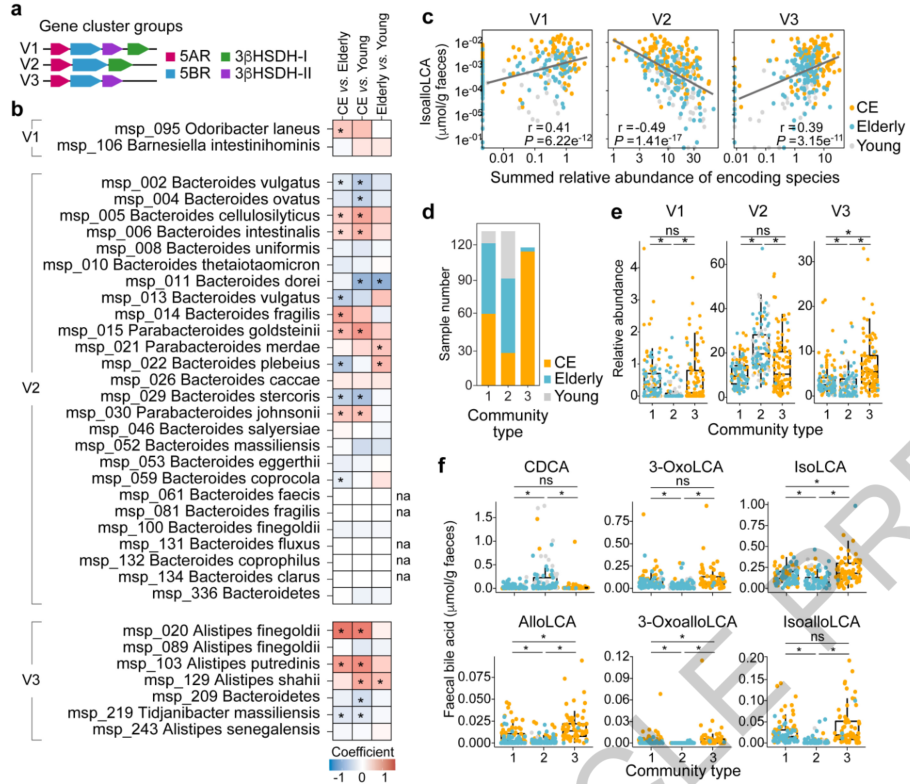
图4. 肠道微生物组结构与胆汁酸谱的关联
小结
本研究通过鉴定百岁老人特有的肠道菌群特征,确定了促进 isoLCA、3-oxoLCA、3-oxoalloLCA 和 isoalloLCA 产生的微生物种类和基因/途径。同时还阐述了Isoallo-LCA对革兰氏阳性(不是革兰氏阴性)多重耐药病原体(包括Clostridioides difcile和Enterococcus faecium)强大的抗菌作用。这些发现揭示,特定的胆汁酸代谢可能参与降低病原体感染的风险,从而可能有助于维持肠道稳态。
参考文献
Yuko Sato, et al. Novel bile acid biosynthetic pathways are enriched in the microbiome of centenarians. Nature. 2021.
原文阅读,请长按识别下方二维码
.png)
绘谱帮你测
本研究利用胆汁酸检测及宏基因组技术揭示百岁老人体内特有的生物合成途径。麦特绘谱拥有成熟的代谢物定性和定量平台,本研究涉及的胆汁酸检测及宏基因等技术,麦特绘谱均可提供全套解决方案,详情欢迎咨询麦特绘谱。
往期回顾
1. Nature Metabolism | 胆汁酸新功能–通过肠脑轴影响食欲
2. Cell Metabolism | FXR激活可通过胆汁酸依赖方式降低脂质吸收从而预防NAFLD
3. EbioMedicine | 胆汁酸决定你是否更容易发胖
4. Protein&Cell | 胆汁酸替代合成途径与代谢性疾病
5. Nature Reviews Microbiology︱全面解析肠道菌群代谢物重要作用



