文献解读
Nature Cell Bology | 天冬酰胺促进T细胞活化和抗肿瘤效应
细胞是免疫系统的关键组成部分,保护宿主免受感染和癌症。而营养物质的可用性(如微环境中丝氨酸、犬尿氨酸和精氨酸能够影响T细胞生存、增殖和效应反应)对于T细胞功能和免疫反应至关重要。尽管代谢改变对T细胞扩增和存活的影响逐渐明了,但对CD8+T细胞激活的代谢操纵机制仍知之甚少。天冬酰胺作为一种终端代谢产物会被肿瘤细胞大量释放到胞外。但微环境中天冬酰胺(Asn)对于T细胞功能的影响却知之甚少。清华大学江鹏团队利用饮食中限制或补充Asn、天冬酰胺酶(ASNase)处理以及15N-Asn同位素示踪技术,揭示Asn在体内外都能显著增强CD8+T细胞的激活、增殖和对细菌感染的免疫应答及肿瘤杀伤能力,相关研究成果发表于《NatureCell Biology》。
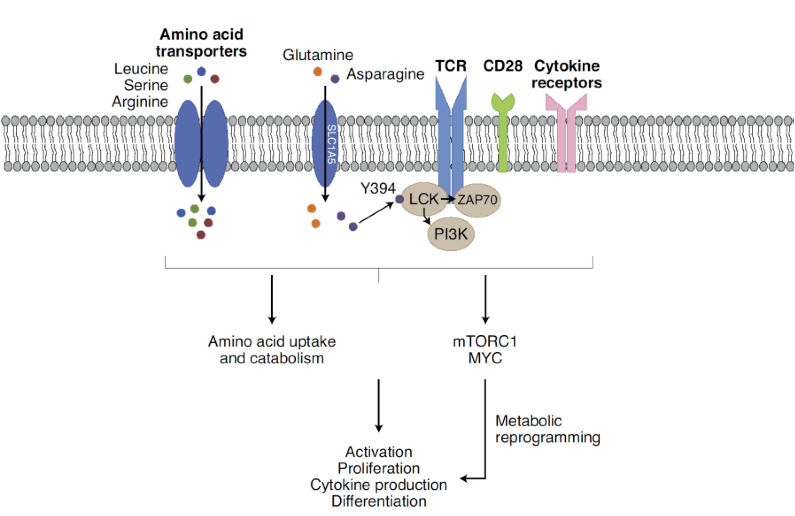
Asn促进CD8+T细胞活化
作者试图通过测量Asn对CD8+T细胞反应的影响来确定它是否影响免疫功能。Asn耗竭导致抗CD3和CD28抗体触发的CD8+T细胞活化急剧减少,而添加Asn可以增强CD8+T细胞的激活。但CD8+T细胞的活性不受Asp的耗尽或添加的影响,这表明Asn在调节CD8+T细胞激活中的特定作用。Asn处理导致CD8+T细胞数量显著减少,CD62LlowCD44highCD8+和CD62LhighCD44highCD8+T细胞比例增加。用Asn而非Asp处理可以增加具有干细胞特性的CD8+T细胞的数量,表明Asn可以调节CD8+T细胞的激活和分化。
Asn补充显著增加CD8+T细胞的数量和大小。相反,用ASNase(将Asn水解为Asp和氨的酶)处理细胞去除Asn,逆转Asn对CD8+T细胞的作用。当存在Asn时,由B16-OVA黑色素瘤细胞刺激的OT-1小鼠CD8+T细胞的激活显著增加;而添加ASNase后,这些效果却完全相反。许多肿瘤细胞产生并分泌大量的Asn,在小鼠EG-7淋巴瘤细胞和人肺癌H1299细胞的培养基中培养的CD8+T细胞激活能力显著增强,而补充ASNase则完全逆转了这种作用,表明增加细胞外Asn水平可增强CD8+T细胞激活,CD8+T细胞对肿瘤细胞分泌的Asn的感知揭示了免疫系统检测肿瘤新生的潜在机制(图1)。
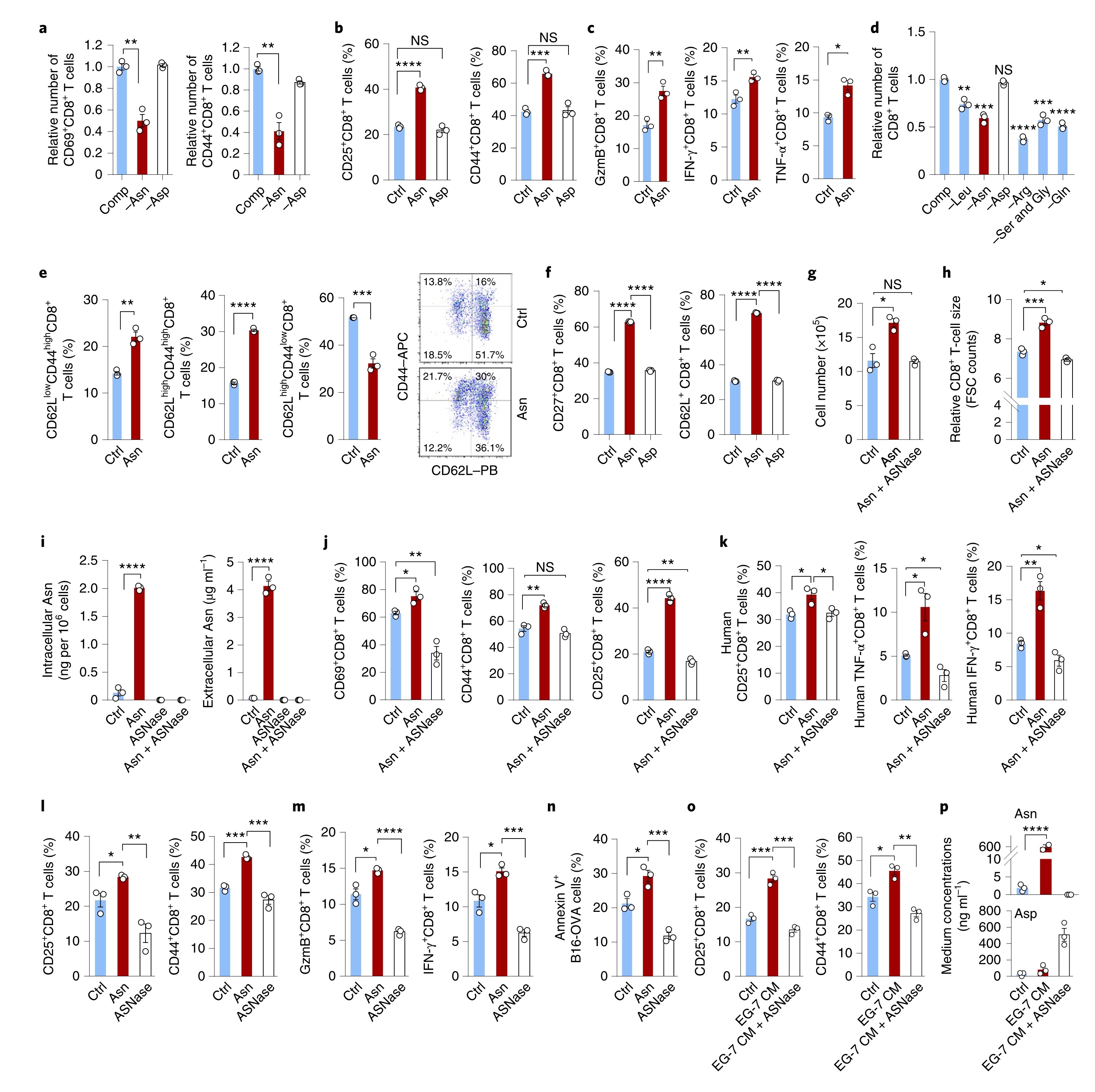
Asn在体内增强CD8+T细胞反应
对缺乏Asn基因的小鼠腹腔注射(i.p.)Asn或PBS(对照组),发现与对照组相比,经Asn处理的小鼠血液中Asn水平升高,脾和淋巴结中细胞数量增加。在注射Asn的小鼠中CD25+CD8+T细胞的数量有所增加。在含Asn饮食的小鼠中,加入ASNase进行Asn剥夺可导致血液中Asn的水平显著降低,脾脏减小,小鼠脾脏和淋巴结中的细胞数量减少。注射ASNase的小鼠中,激活的CD8+T细胞数量减少。进一步检测体内T细胞对表达OVA的单核细胞增生李斯特菌(LmOVA)感染的反应。发现限制Asn饮食可以降低OT-1 CD45.2+CD8+T细胞转移的同基因CD45.1小鼠的脾脏和淋巴结中OT-1 CD8+CD45.2+T细胞的数量(图2)。总之,Asn在体内影响CD8+T细胞的活性和反应。
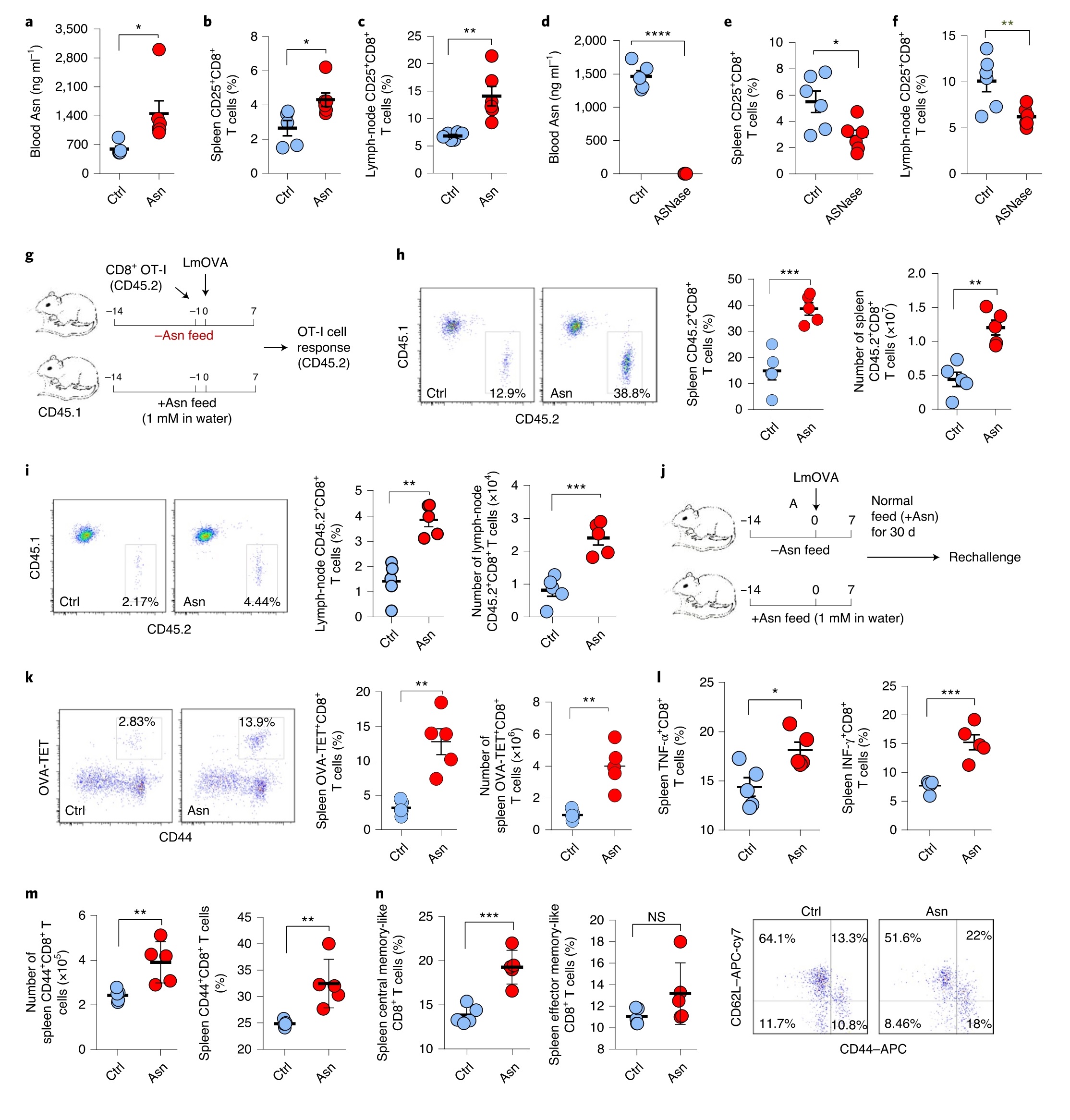
Asn促进CD8+T细胞活化需要细胞摄取
Asn是增殖细胞中的一种氨基酸交换因子。结果发现,Asn耗竭显著降低CD8+T细胞中Ser的摄取,而Asn的摄取不受Ser和Gly消耗的影响。Ser和 Gly缺乏不影响Asn增强的CD8+T细胞活化,即使将细胞在无氨基酸培养基中培养,补充Asn仍能改善CD8+T细胞活化,提示Asn作为氨基酸交换因子的作用并非促进CD8+T细胞活化所必需的。
接下来研究细胞摄取是否对Asn促进CD8+T细胞活化至关重要。作者分析了几种潜在的Asn转运蛋白在人淋巴结和脾脏组织中的表达,发现了与Asn交换功能相关的转运蛋白SLC1A5和SLC38A2及三种反转运蛋白(SLC7A1,SLC7A5和SLC1A4)的高表达。沉默SLC1A5而非SLC38A2,能够降低Asn的摄取。且SLC1A5沉默后,Gln的细胞水平显著降低,而Glu却没有显著降低。同样,SLC1A5的药物抑制可显著降低细胞内15N-Asn和Gln的水平,但不能降低Tyr的水平。因此,Asn和Gln均可使用SLC1A5将其导入细胞。在Gln缺乏的情况下抑制SLC1A5来检测Asn摄取对CD8+T细胞激活的影响,SLC1A5抑制足以阻断Asn介导的CD8+T细胞活化增强。可见SLC1A5介导的Asn摄取对于Asn促进CD8+T细胞活化至关重要(图3)。
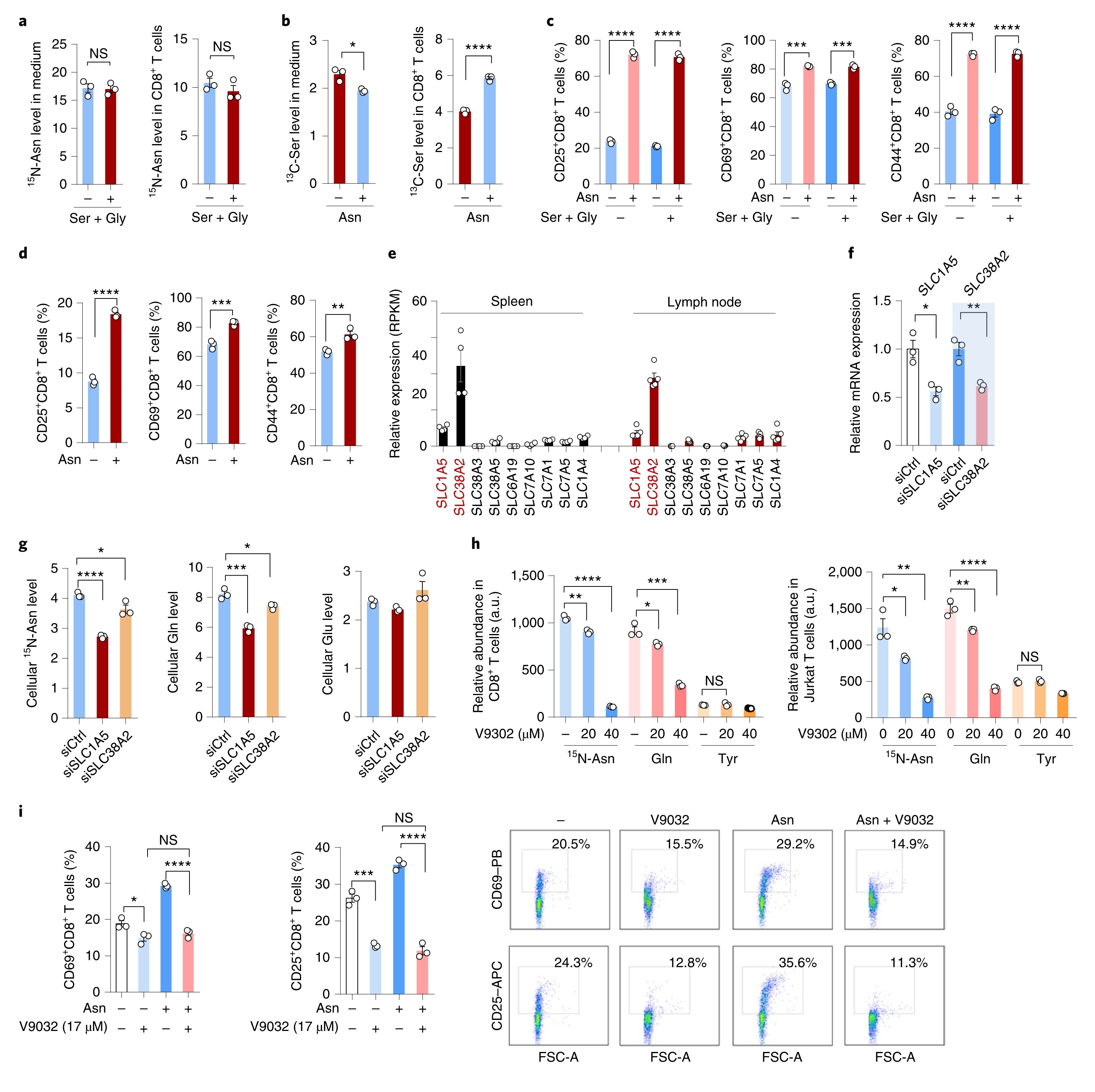
Asn增强CD8+T细胞激活不依赖于mTORC和Gln
接下来探讨Asn激活T细胞的潜在机制。已报道mTORC1活性的上调在代谢上支持T细胞活化,而Asn能够间接刺激mTORC1的活性。结果表明,CD8+T细胞的活化显示mTORC1活性增加,并且这一作用在Asn补充后显著增强。然而,尽管mTORC1抑制剂雷帕霉素可以减少T细胞活化,但Asn诱导的CD8+T细胞活化显著升高,表明mTORC1活性的上调虽有助于却不足以促进Asn增强CD8+T的细胞活化。
据报道当Gln受到限制时,Asn可用于许多肿瘤细胞的蛋白质合成。同理,在Gln缺乏时,添加Asn可以促进T细胞活化过程中的蛋白质合成,并显著恢复信使RNA的翻译。此外,Gln的耗竭可以降低蛋白酶体抑制诱导的短寿蛋白(MYC和NRF2)的积累,而Asn的补充可以使上述积累明显恢复。因此,Gln的缺乏不足以阻止由Asn介导的T细胞活化的增强,表明背后有独立的活化机制。
LCK介导Asn促进 CD8+T细胞的激活和应答
补充Asn改变了多种代谢物的细胞水平,但15N-Asn同位素示踪实验发现被摄取的天冬酰胺并没有被进一步代谢,表明Asn并非通过代谢直接参与其对T细胞的活化。T细胞活化需要Src家族酪氨酸激酶(LCK)来启动抗原特异性TCR信号传导。当向CD8+T细胞提供Asn时,发现激活过程中LCK磷酸化(Y394)、LCK底物ZAP70和PI3K显著增强。在体内也观察到类似结果。OVA肽处理后,转移的CD45.1小鼠在提供Asn时,脾脏OT-1 CD8+T细胞中LCK磷酸化显著升高。相反,用ASNase处理后LCK、ZAP70和PI3K的磷酸化降低。此外,使用高分辨成像技术发现,在Asn处理的CD8+T细胞中,磷酸化的TCR信号蛋白增加(图4)。总之,这些发现首次揭示了Asn在TCR信号调节中的重要作用。
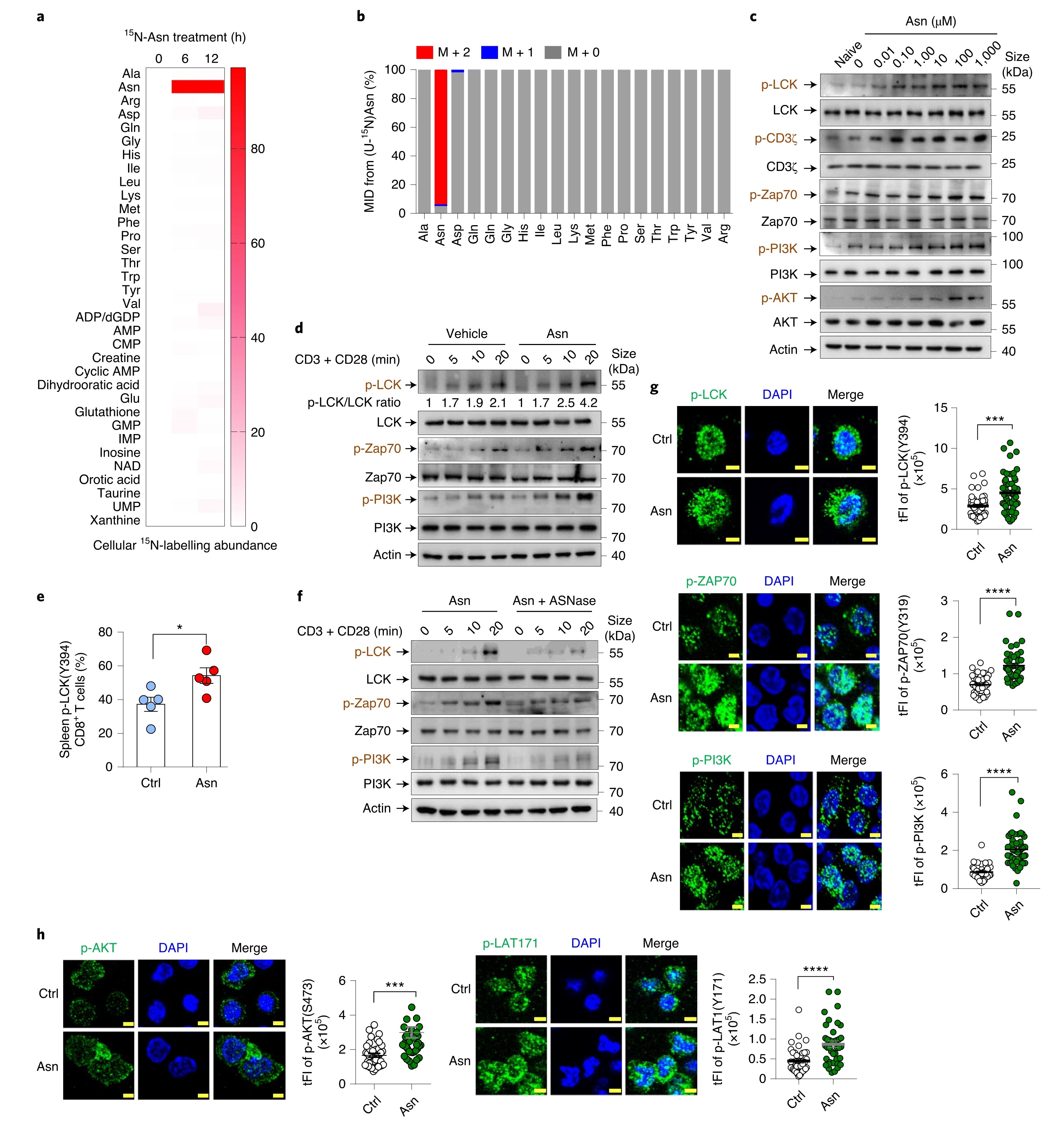
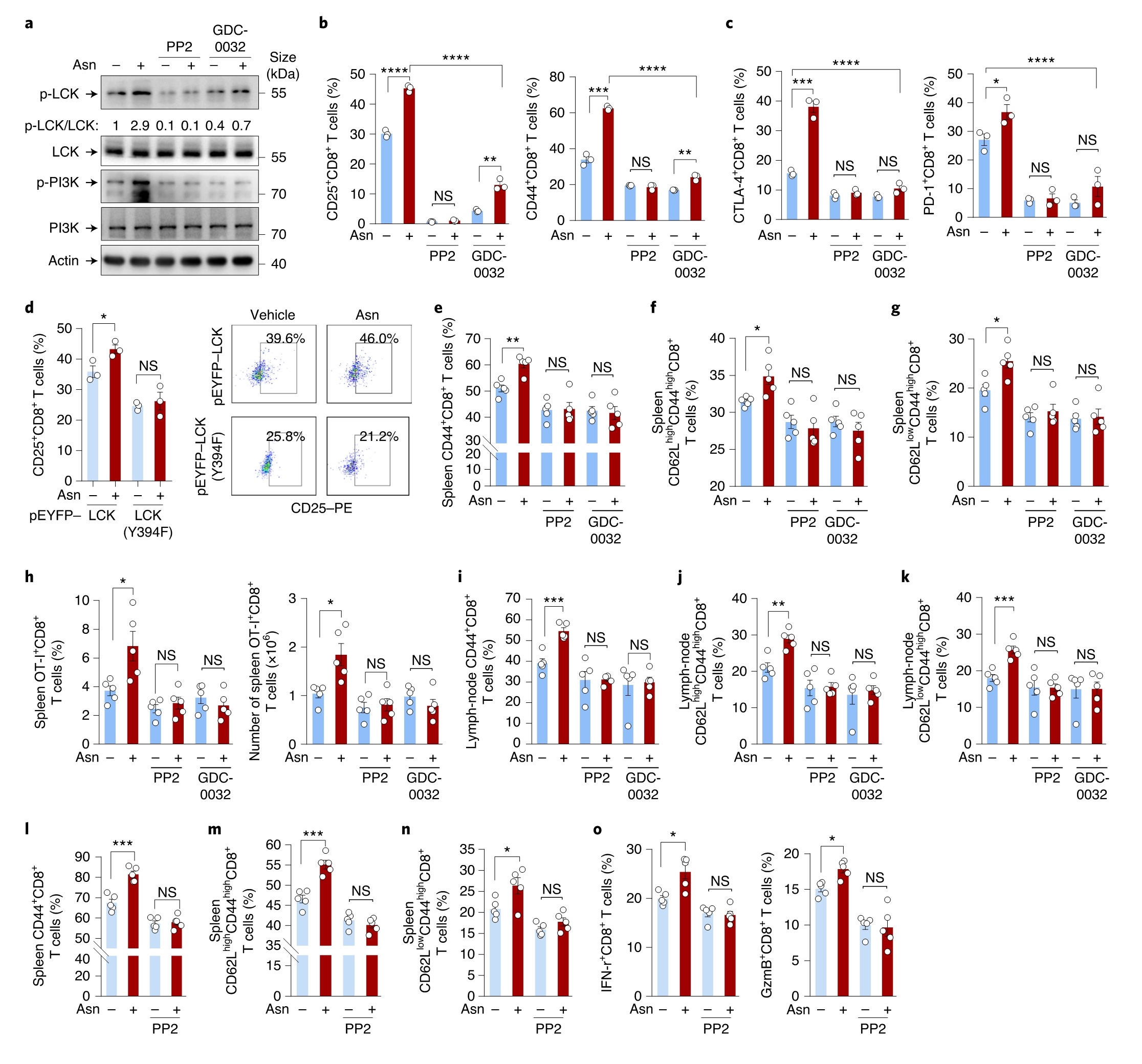
LCK抑制剂PP2的添加完全阻断了Asn触发的LCK和PI3K磷酸化。PI3K抑制剂GDC-0032轻微影响LCK磷酸化,但降低了Asn培养的细胞中的PI3K磷酸化。与这些发现一致的是,尽管添加Asn增强了CD8+T细胞活化,但PP2和GDC-0032的添加却显著逆转了Asn促进T细胞的激活。LCK突变体(Y394F)的引入减少了T淋巴细胞的活化,并削弱了这些细胞对Asn可用性的敏感性。此外,将Asn注射到OT-1过继转移小鼠中,活化的CD8+T细胞及效应子增加,而PP2或GDC-0032降低了T细胞和脾OT-I+CD8+T细胞的数量,从而减少了对照组和Asn处理小鼠之间的差异(图5)。总之,Asn通过LCK增强T细胞活化。
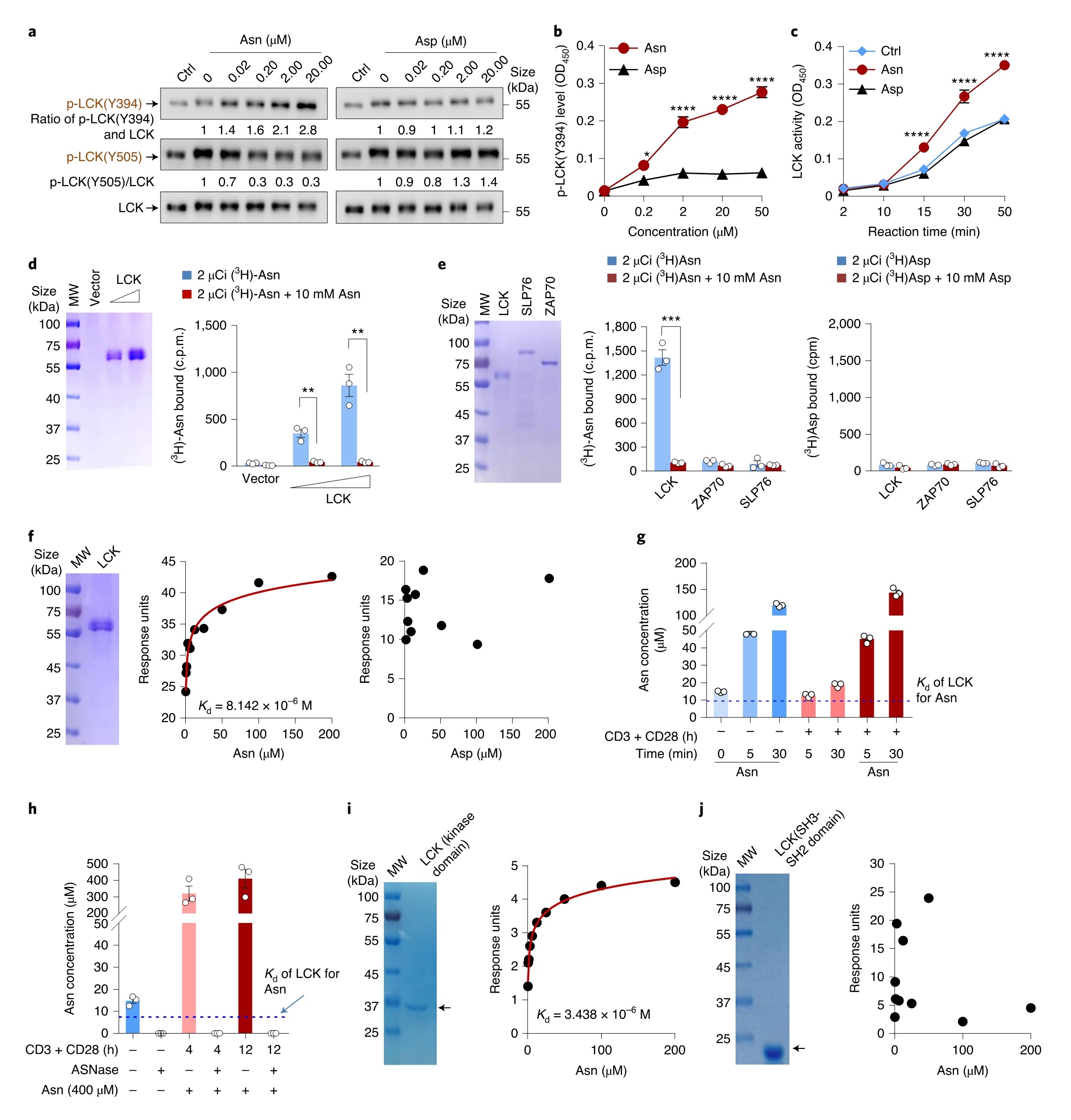
Asn直接与LCK结合并促进其活性
已报道,Tyr505磷酸化使LCK失活,而Tyr394自磷酸化激活LCK。结果发现,Asn剂量依赖性地增加了Tyr394磷酸化且降低了Tyr505磷酸化,并在体外直接激活LCK,而在Asp处理后却并不显著。接下来作者使用放射性氨基酸进行了平衡结合试验,以研究Asn–LCK结合的可能性。将固定在珠子上的纯化的重组LCK蛋白与3H-Asn孵育、洗涤并定量,结果显示LCK以剂量依赖的方式与3H-Asn结合,这可以完全与非放射性的Asn竞争。且3H-Asn仅与LCK结合却不与ZAP70和SLP76蛋白结合。
由于Asn耗竭会降低LCK活性和T细胞活化,因此细胞中Asn的浓度应足以使Asn与LCK结合。起始和活化细胞中的Asn浓度高于LCK对Asn的解离常数(Kd),这可能提示Asn是LCK活性的生理相关调节因子。与此相一致,当向细胞供应Asn时,细胞中Asn的丰度迅速升高,并导致LCK活性和T细胞功能显著增强。相反,ASNase处理后,CD8+T细胞中的Asn浓度降低,Kd从高于LCK值下降到低于LCK值。因此,Asn可能通过抑制Tyr505磷酸化来促进Tyr394自磷酸化。为了确定结合区域,比较不同LCK缺失突变体结合Asn的能力,发现Asn的结合位点是在激酶结构域内LCK的240-320位氨基酸之间的区域(图6)。
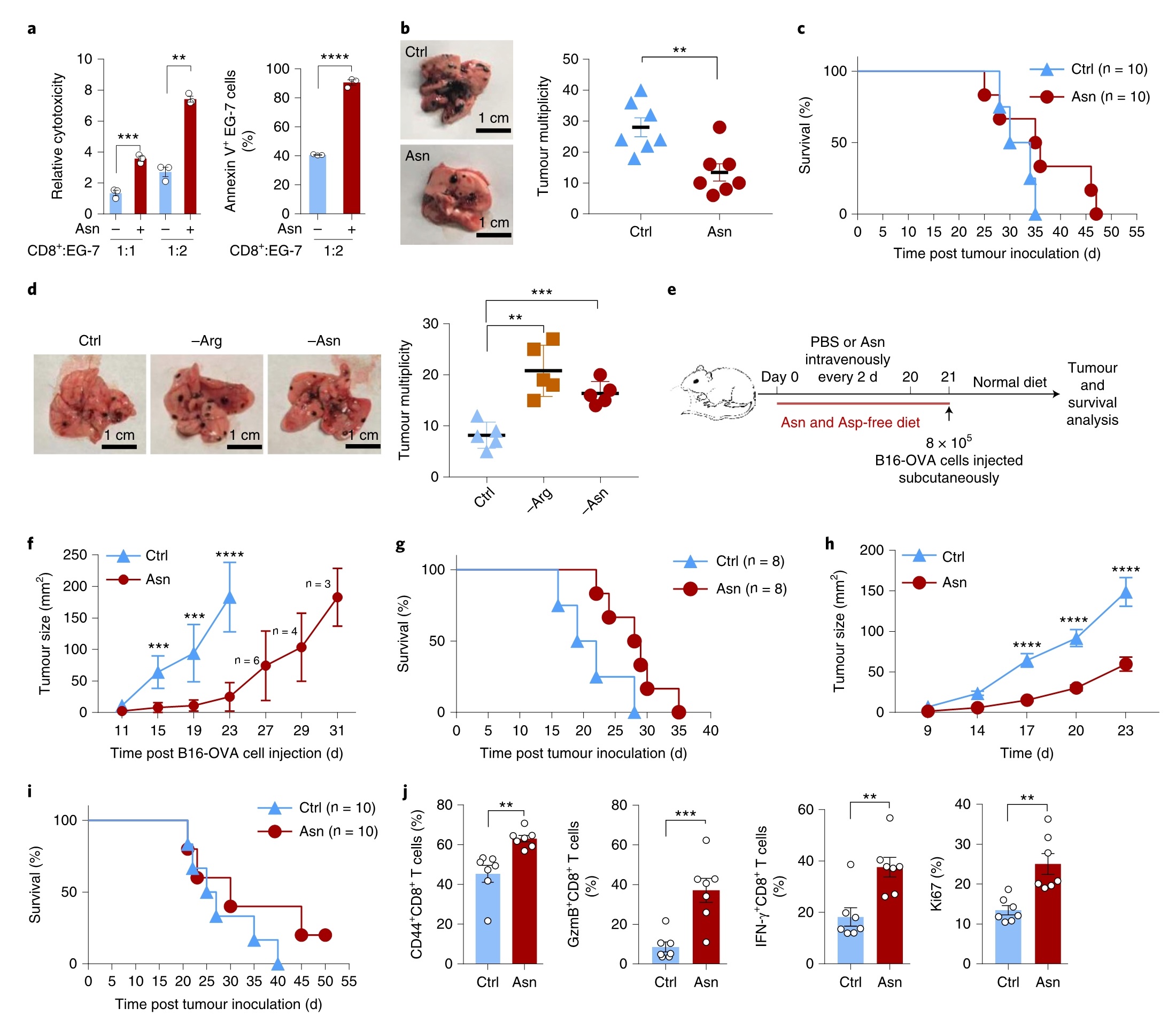
Asn增强了抗肿瘤T细胞反应
最后探究Asn是否增强抗肿瘤T细胞反应。在限制或补充Asn的培养基中用OVA257-264肽预刺激的起始OT-I CD8+T细胞与EG-7或B16-OVA细胞共培养。结果发现Asn赋予OT-I CD8+T细胞更高的细胞毒性和杀死肿瘤细胞的能力。当转移到注射了B16-OVA细胞的免疫缺陷小鼠中时,用Asn处理OT-I CD8+T细胞,发现肿瘤细胞转移减少且小鼠存活率增加,表现出优异的的抗肿瘤功效。相反,Asn缺乏使OT-ICD8+T细胞的抗肿瘤活性降低。
将B16-OVA细胞皮下注射到经PBS或Asn预处理的小鼠中,以评估Asn对内源性抗肿瘤免疫应答的影响。经Asn处理的小鼠表现出较强的抗肿瘤免疫反应,且存活率增加。此外,在免疫耗竭和荷瘤小鼠的腹腔内注射Asn,由OVA引发的OT-1 CD8+T细胞也具有有效的抗肿瘤应答。Asn赋予这些肿瘤浸润的T细胞更高的活化能力、细胞因子生成能力甚至增殖能力(图7)。综上表明, Asn水平的升高会增强CD8+T细胞的活化及其在体内的抗肿瘤活性。
小结
本研究通过体内体外实验揭示了Asn水平升高可增强CD8+ T细胞的活化和对肿瘤细胞的效应功能,限制Asn饮食、给予ASNase酶或Asn转运体SLC1A5的抑制剂可削弱CD8+T细胞的活性和反应。Asn不会直接改变细胞的代谢通量,却能与SRC家族蛋白酪氨酸激酶LCK结合并诱导其Tyr394和Tyr505的磷酸化,从而激活LCK信号,进而促进T细胞活化并改善T细胞对病原体或恶性细胞的反应。此外,本研究还揭示了Asn通过控制T细胞的激活和有效性,Asn在直接调节适应性免疫反应中发挥关键作用,LCK是一种天然的Asn传感器,感应Asn介导T细胞功能,为理解微环境中天冬酰胺的功能提供了研究方向。
配套检测方法
本文中的天冬氨酸、天冬酰胺等多种氨基酸检测,麦特绘谱均可提供全套解决方案!点击了解:方法速递 | 免疫治疗中的重要一环–氨基酸代谢
参考文献
Asparagine enhances LCK signalling to potentiate CD8+ T-cell activation and anti-tumour responses. Nat Cell Biol. 2021. doi: 10.1038/s41556-020-00615-4.
原文阅读,请长按识别下方二维码

精彩推荐
1. Cell子刊 | 癌细胞并不孤单–肿瘤微环境中的代谢通信
2. Cell重大发现 | 代谢组和蛋白组联手解析精氨酸如何调控T细胞代谢,并增强其抗肿瘤活性?
3. 客户案例|紫杉醇增强灵芝孢子多糖的抗乳腺癌作用:抑制肿瘤代谢,重塑肠道菌群
4. Cell Metabolism | 氨基酸如何支持免疫(上)
5. Cell Metabolism | 氨基酸如何支持免疫(下)
6. Trends in Immunology | 多胺和犬尿氨酸的免疫调节
7. Nature Reviews Clinical Oncology | 代谢调节提高免疫治疗
8. Nature Communications | 谷氨酰胺氮代谢转变有助于癌症恶性进展
9. NATURE REVIEWS DRUG DISCOVERY | 色氨酸代谢—最火的疾病治疗靶点成药性如何?




