文献解读
Immunity | 重磅综述: 饮食-菌群-免疫互作
已有证据表明饮食摄入对人体健康和疾病的影响与免疫系统和菌群有关,但由于缺乏完整系统的模型来阐述这三个复杂系统之间的关系,从而限制了我们更好的去理解和治疗慢性和传染性疾病的能力。加州大学旧金山分校的PeterJ.Turnbaugh团队回顾了微生物学、免疫学和营养学界交叉领域的最新研究,剖析了饮食-菌群-免疫的相互作用机制,并将这些相互作用机制分为6种类型(图1)。期望从人类队列的观察性研究过渡到可控实验模型和受控的人类干预试验,为精准营养时代奠定基础。
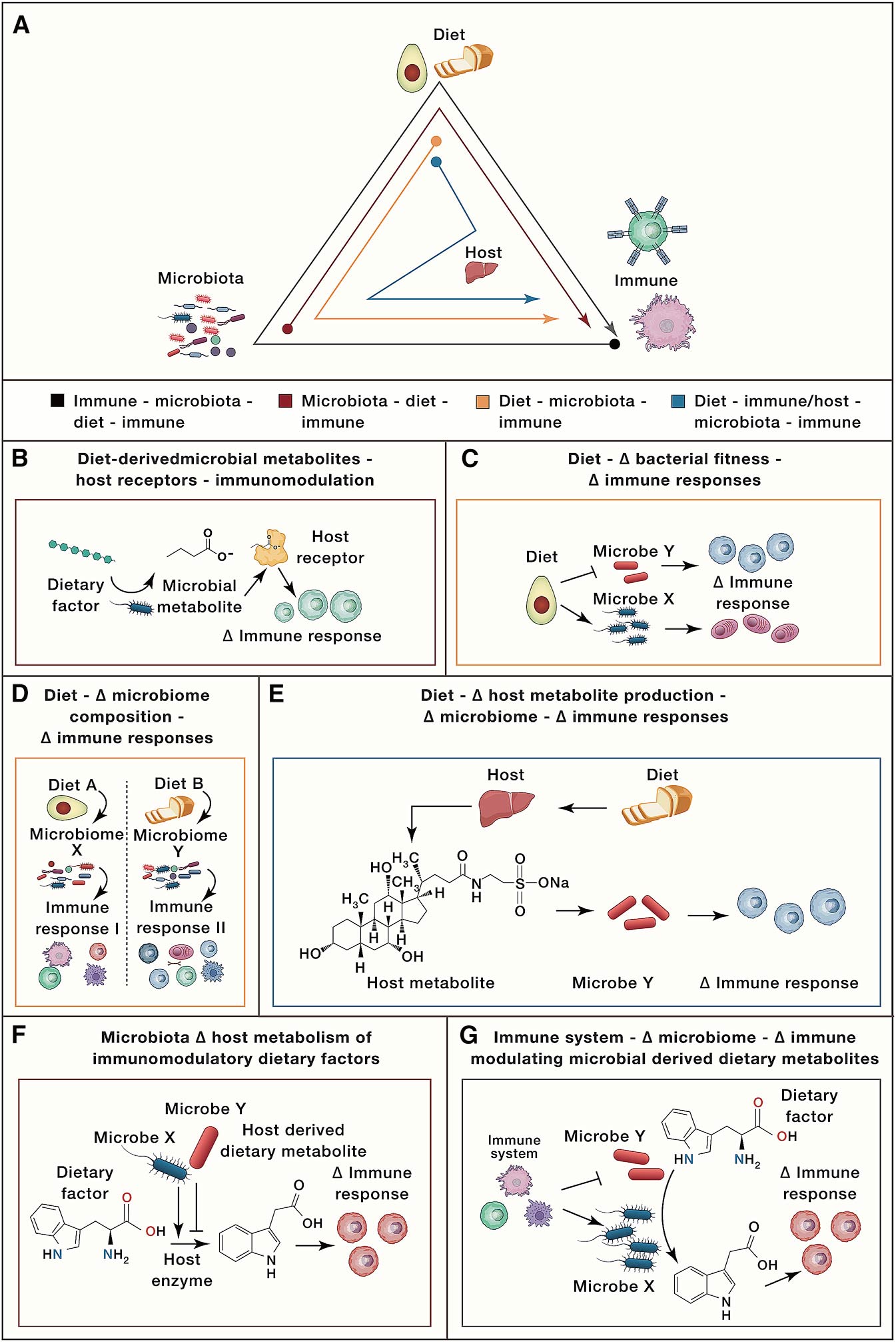
饮食来源的菌群代谢物改变宿主受体信号影响免疫应答
饮食来源的菌群代谢物通过宿主受体信号改变免疫应答是研究最深入的一个机制。比如,寡糖和多糖以及氨基酸的细菌发酵过程中产生的短链脂肪酸(SCFAs)可以激活免疫和非免疫细胞中的G蛋白偶联受体(GPCR)。由于GPCR FFAR2(GPCR43)的激活,菌群产生的丙酸、乙酸、丁酸增加结肠调节性T细胞(Treg)的活性,从而保护小鼠免受结肠炎的侵害。其中,乙酸盐或低浓度丙酸盐可活化FFAR2从而促进3型先天淋巴样细胞(ILC3)扩增。丙酸也会增加ILC3细胞白介素22(IL-22)的分泌,这对肠道屏障的维持很重要。与正常对照组相比, Ffar2条件性缺失小鼠结肠炎发展恶化。中长链脂肪酸也可通过宿主受体信号通路调节免疫反应。比如,亚油酸可以通过细菌和真菌编码的环氧化物水解酶代谢成12,13-diHOME。12,13-diHOME在患有儿童特异反应和哮喘风险的新生儿中含量高,这些患者体内环氧化物水解酶相关菌群呈现富集。大肠杆菌中环氧水解酶的表达足以将12,13-EpOME转化为12,13-diHOME。蟑螂抗原处理的小鼠接受12,13-diHOME干预后,过敏性气管炎的标志物如肺部T细胞、中性粒细胞、单核细胞和促炎性细胞因子增加,Treg细胞减少。体外12,13-diHOME可降低人树突细胞IL-10分泌并激活PPARg,其中PPARg是一种脂质激活的核受体,可调节炎症反应和肠道菌群。此外,色氨酸相关菌群代谢物也是通过宿主受体信号通路调节免疫反应的一个代表,乳杆菌将色氨酸代谢成吲哚类产物,如吲哚-3-乙酸(IAA),它们充当AHR配体并促进IL-22的产生。在结肠炎DSS模型中,当小鼠移植将色氨酸代谢成AHR配体的乳杆菌时,肠道炎症就会减弱,而AHR拮抗剂处理可消除这些影响,从而证明了AHR信号在这种保护中的作用。这些研究表明,饮食来源的菌群代谢物可以通过宿主受体信号调节免疫应答。
饮食改变肠道菌群进而影响免疫应答
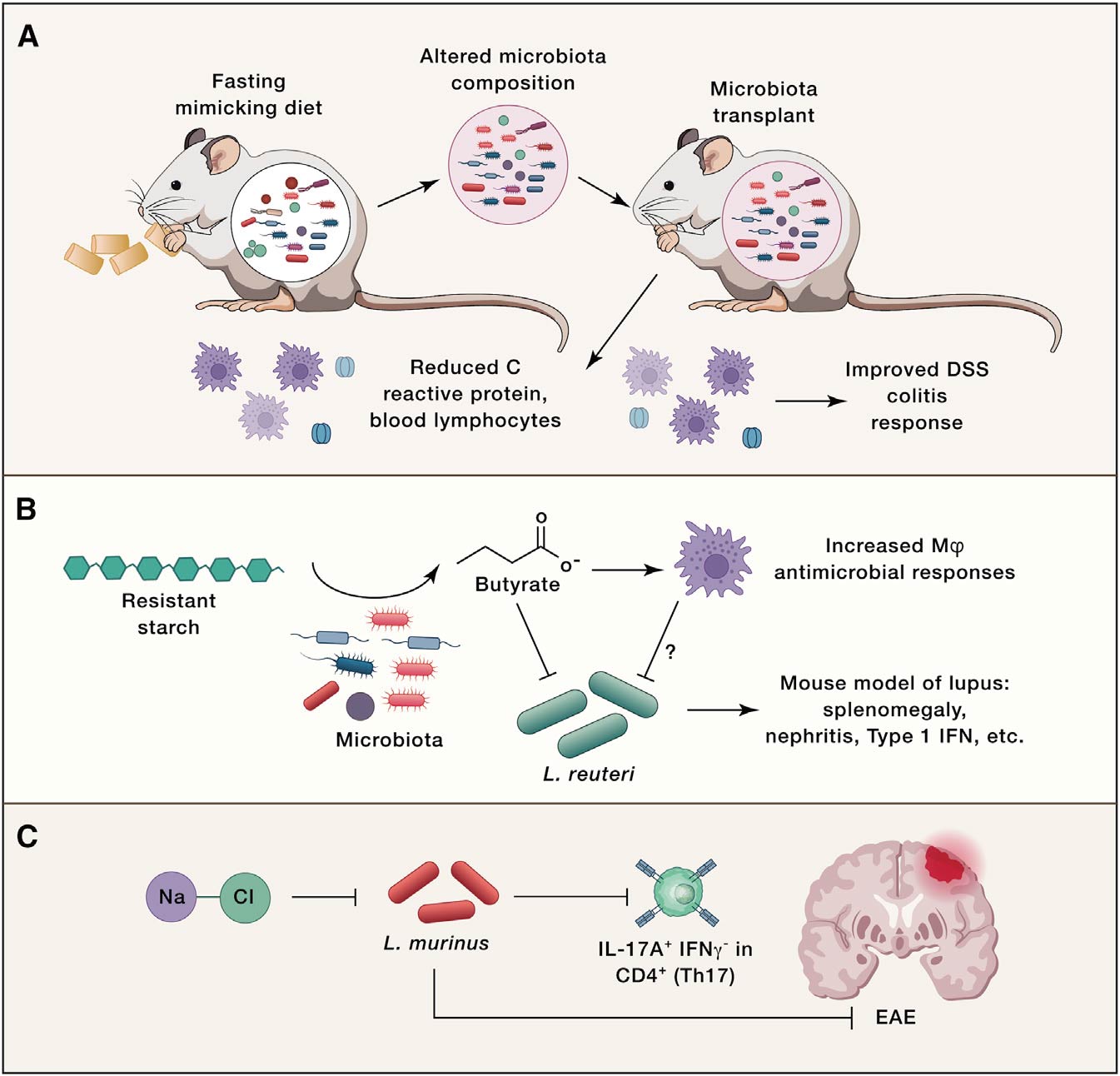
临床中菌群组成改变后的功能研究还是比较困难的,因为缺乏合适的方法精准调控人体肠道菌群变化,常用菌群移植的手段验证有关菌群变化引起的功能影响(图2)。例如,移植间歇性禁食小鼠的肠道菌群可改善自身免疫性脑脊髓炎(EAE)(一种多发性硬化症小鼠模型)。禁食小鼠粪便移植可导致DSS小鼠结肠炎严重程度降低(图2A)。不过,这些发现并不意味着微生物组是导致这些复杂表型的唯一因素,也有研究表明,饮食对免疫细胞的影响与微生物无关。例如,在无菌小鼠(GF)和无特异性病原体小鼠(SPF)中,限制热量摄入可降低循环单核细胞,而禁食可降低Peyer’s patches中的B细胞。但这些研究表明,饮食引起肠道菌群变化可以进而影响免疫反应。
微生物的贡献与饮食对免疫的作用是研究的一个中心问题。已有研究围绕这些因素对肠道Treg细胞水平的影响开展工作。例如,GF小鼠小肠固有层Treg细胞的频率和数量与SPF小鼠相似,表明这些细胞的积累与微生物无关。采用无抗原饲料(AFD)喂养的GF小鼠的小肠Treg细胞(CD4 + FoxP3 +)水平出现显著下降。为进一步探讨饮食和微生物对免疫的最用,可以将SPF级小鼠与对照组小鼠分别喂食AFD和将对照组小鼠微生物群移植到GF小鼠以评估微生物组组成的改变对肠道Treg细胞的影响。
研究复杂饮食变化的另一种方法是改变单一饮食成分,然后对菌群和免疫反应进行分析。例如,维生素D缺乏饮食的小鼠结肠中Treg细胞减少,DSS结肠炎加重,同时菌群移植验证了这些结果。不过维生素D缺乏饮食小鼠中的多形拟杆菌和梭状芽孢杆菌减少,可能与Treg细胞减少有关。这些细菌产生的SCFA与Treg细胞的诱导也具有相关性;因此,还需要更多的工作来阐述菌群或代谢物对疾病表型的重要作用。虽然微生物移植是研究饮食、微生物组和免疫三者关系的一个强有力研究工具,但在这些研究中仍有一些问题需要考虑。一个问题是,在没有原始干预情况下,饮食引起供体微生物群落结构改变是否能够移植到受体中并保持下去。另一个问题是由于样本数受限造成的结果普遍性。要阐明饮食塑造微生物群落组成的机制是极其困难的,更不用说改变微生物群落影响免疫的众多潜在机制。因此,需要做更多的系统工作来探索识别微生物群落的活性成分,类似于在天然产物研究中常使用的活性成分分馏方法。
饮食因素在菌群移植以及相关的功能中的作用可以通过缺乏或补充该因素来研究。例如,喂食无纤维饮食的小鼠结肠黏液层厚度降低,炎症标志物lipocalin 2的蛋白水平增加,结肠缩短,黏液降解细菌丰度增加。在低纤维饮食中向小鼠补充双歧杆菌和菊粉可防止粘液变质。
菌群可以诱导抗原特异性反应,那么饮食是否会改变菌群的抗原表达,从而影响抗原特异性反应?Wegorzewska发现,较高水平的聚糖和较低水平的盐可降低多形拟杆菌抗原的体外表达。饮食中的葡萄糖可以降低多形拟杆菌抗原的表达,并降低体内的抗原特异性T细胞,这表明饮食因素会影响抗原依赖性免疫。另外一种假设是饮食成分及其代谢产物直接影响细菌的生长和生存力来改变菌群组成和随后的免疫反应。Zegarra发现,丁酸在体外抑制罗伊氏乳杆菌的生长。饲喂罗伊氏乳杆菌会加重Toll样受体7(TLR7)依赖的狼疮小鼠模型,但抗性淀粉饮食改善了诸如脾肿大,脾脏和回肠的1型IFN诱导以及肾炎等疾病,表明抗性淀粉改善狼疮可能是通过丁酸介导进而导致罗伊氏乳杆菌降低(图2B)。此外,饮食菌群代谢物还可以改变宿主信号途径诱导菌群适应改变(图2C)。
饮食与菌群通过宿主过程调节免疫
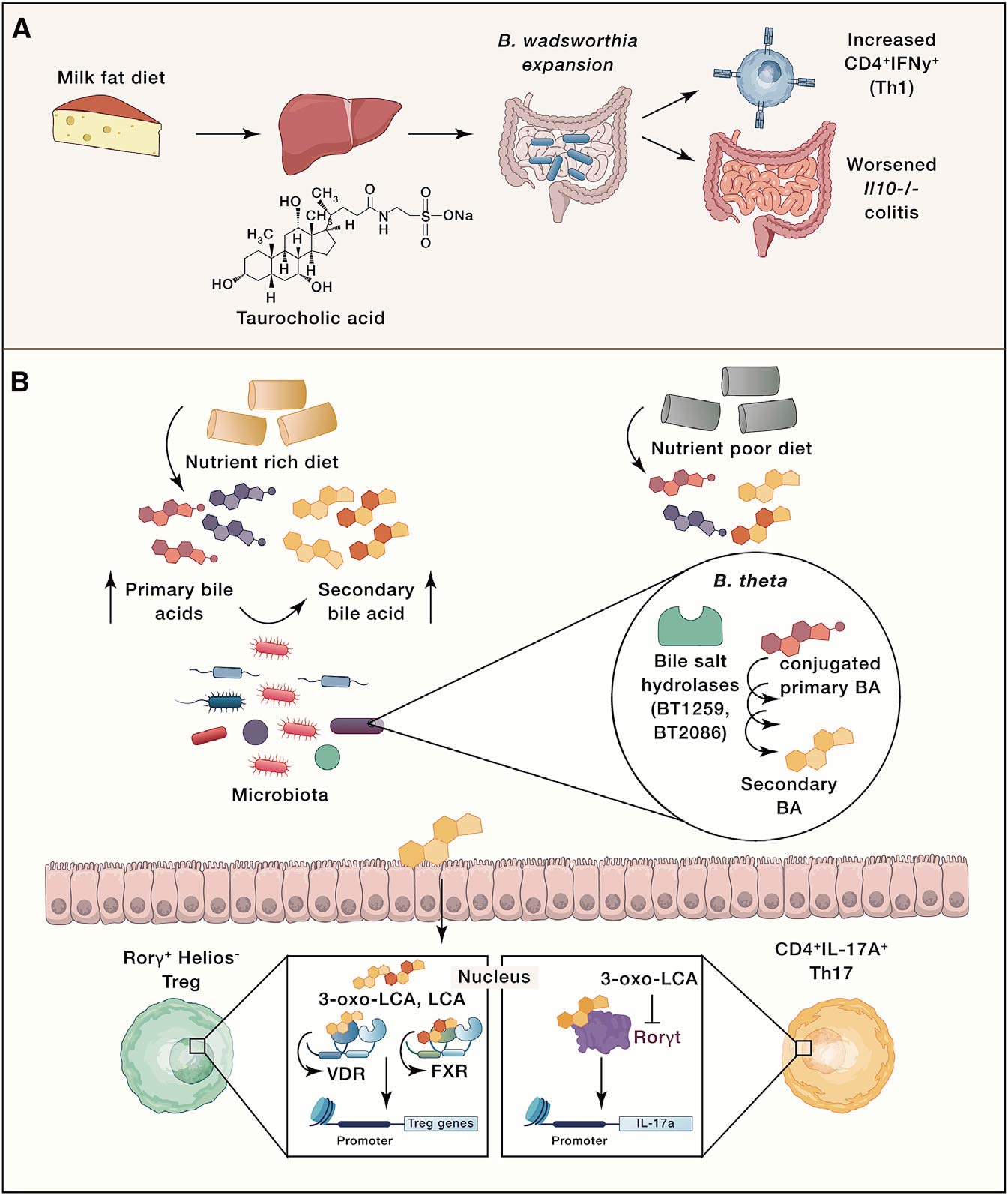
饮食可以通过对宿主信号的间接影响来塑造菌群。比如,饮食中的脂肪摄入会影响宿主生成胆汁酸(BA),从而影响肠道菌群的代谢和免疫功能。Devkota发现,乳脂饮食小鼠的肝脏中牛磺酸结合型胆汁酸增加,从而导致Bilophila wadswothia水平升高;低脂饮食且补充牛磺胆酸也可以导致B. wadsworthia水平升高,Th1细胞数量增加(图3A)。David在临床受试者中验证了这一结果,相对于植物性饮食,动物性高脂饮食组粪便BA浓度、B. wadsworthia和细菌性亚硫酸盐还原酶活性都显著升高。这些研究表明,饮食导致宿主代谢的变化,进而对菌群产生影响反馈给免疫反应。
饮食也会影响宿主代谢产物产生,并被菌群进一步代谢为免疫调节物。比如,石胆酸LCA的两种不同代谢产物(3-oxoLCA和isoalloLCA)对T细胞有显著不同作用,其中3-oxoLCA抑制Th17细胞分化,isoalloLCA促进Treg细胞的体内外生长。该研究表明,次级BA和免疫细胞转录因子之间直接相互作用,进而导致免疫应答改变。Song等研究者发现,富含营养(NRD)饮食组与低营养饮食(MD,无胆固醇,脂肪酸种类少,氨基酸组成不同)组的的SPF小鼠具有不同的Treg细胞反应。与NRD组相比,MD组小鼠结肠Treg细胞比例降低。用isoalloLCA/ 3-oxoLCA的组合补充MD可以恢复Treg细胞的比例。这些研究共同证明,饮食和菌群因素会影响BA池,从而影响免疫反应(例如Treg细胞水平),某些情况下会通过直接结合并抑制主转录因子(在3-oxoLCA和RORγt情况下)或通过宿主核受体的信号传导发挥其重要作用(图3B)。
宿主免疫因子影响菌群代谢进而调节免疫作用
宿主免疫因子会影响肠道菌群组成,进而影响菌群代谢的免疫调节。Lamas等发现,CARD9(胱天蛋白酶募集结构域的蛋白9)缺失的IBD患者AHR活性出现降低,这与IBD患者IAA(色氨酸代谢物)水平降低有关。CARD9在真菌免疫应答和TLR信号等免疫中发挥重要作用。Card9缺失小鼠的肠道罗伊氏乳杆菌水平降低。将Card9缺失小鼠的菌群移植到野生型无菌小鼠体内可诱导DSS结肠炎表型出现,这可能是由于罗伊氏乳杆菌丰度降低,色氨酸代谢为IAA水平降低,进而降低AHR活性。这表明,免疫信号蛋白CARD9的差异可以改变菌群代谢导致肠道菌群结构发生变化诱导相应免疫调节。
小结
针对饮食因素、免疫和微生物开展临床营养和微生物组研究是具有无限前景的。基础研究是对正在进行的临床队列观察和干预研究的补充,提供了候选生物标志物和治疗靶点。针对三者相互作用的更深入的可控的系统研究至关重要,但缺乏理解饮食、菌群和免疫表型的综合机制框架,是造成目前许多争议的主要原因。本文回顾了相关研究,将饮食-菌群-免疫互作分为6种类型机制。饮食通过对菌群生长和生存的直接影响以及对宿主细胞的作用间接影响来塑造肠道菌群。反过来,菌群在扩大饮食底物代谢中起着至关重要的作用,这不仅提供能量等方面意义,而且还通过宿主受体对免疫功能发挥重要作用。这些数据将有助于阐明饮食干预改变免疫应答的原因以及它们对宿主基因型、肠道菌群结构和菌群代谢产物的敏感性差异。
参考文献
Margaret Alexander, et al. Deconstructing Mechanisms of Diet-Microbiome-Immune Interactions. Immunity.2020
https://doi.org/ 10.1016/j.immuni.2020.07.015.
原文阅读,请长按识别下方二维码

精彩推荐
2. Cell | 丙酸通过免疫调节机制改善多发性硬化症病程
3. Geroscience︱代谢组-微生物组-免疫因子关联分析揭示大鼠机体随年龄变化规律
4. Nature Reviews Clinical Oncology | 代谢调节提高免疫治疗
5. 综述(上) | Annu. Rev. Immunol.:肠道微生物群、上皮细胞和免疫细胞之间的互作
6. 综述(下) | Annu. Rev. Immunol.:肠道微生物群、上皮细胞和免疫细胞之间的互作



