文献解读
绘谱导读︱7月代谢组学文献精选
一、Blood | 微生物衍生短链脂肪酸丁酸盐和丙酸盐与慢性GVHD

目前,对胃肠道微生物群与同种异体造血干细胞移植(allo-HCT)结局之间关系的研究主要集中在早期并发症如感染和急性移植物抗宿主病(GVHD)上,慢性GVHD(cGVHD)在造血干细胞移植(HCT)后晚期伴有胃肠道的生态失调,本研究发现体循环中微生物来源的短链脂肪酸(SCFAs)丁酸盐和丙酸盐与保护慢性GVHD(cGVHD)相关。
(1) 通过病例对照研究设计,对异基因HCT后晚期患者粪便和血浆样本进行分析,以探讨微生物组与cGVHD的潜在关系;
(2) allo-HCT伴随着粪便微生物群α-多样性的丧失,住院治疗、饮食改变、抗生素和其他药物使用对胃肠道微生物群落造成持久损害,胃肠道微生物组主要依赖于微生物衍生的代谢物SCFAs来调节aGVHD的异源反应性;
(3) 相比对照移植患者队列和独立移植中心的横断面队列中未发生并发症的患者,cGVHD患者第100天血浆中微生物来源的SCFAs丙酸和丁酸的循环浓度显著降低;
(4) 病例对照队列及两个横断面队列中得出的结果表明胃肠微生物组可能通过控制全身性微生物衍生的SCFAs浓度对异基因HCT患者发挥免疫调节作用,在两个独立的患者队列中发现高浓度SCFAs与较低的cGVHD发生率相关。
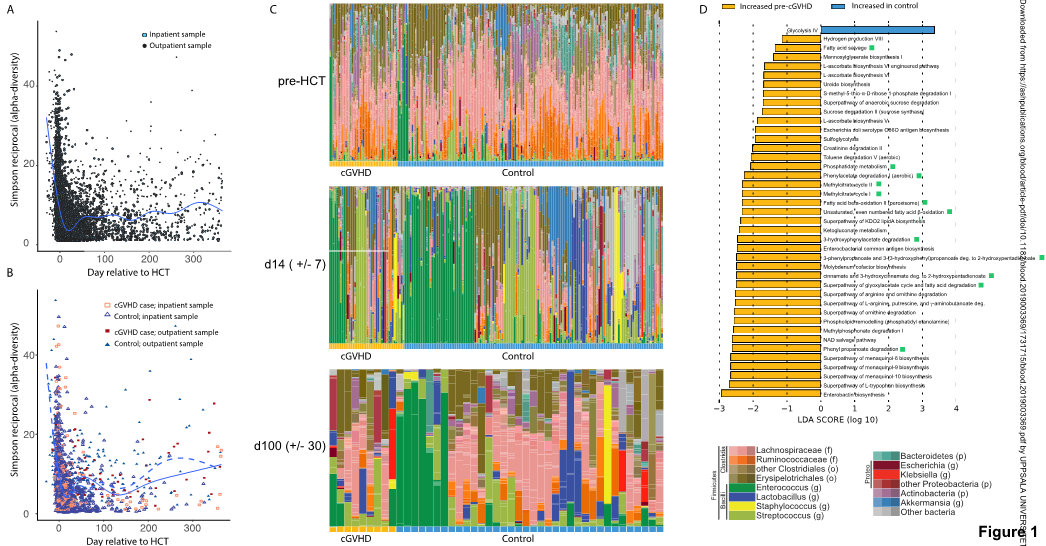
Microbe-derived short chain fatty acids butyrate and propionate are associated with protection from chronic GVHD. Blood. 2020. https://doi.org/10.1182/blood.2019003369
原文阅读,请长按识别下方二维码

二、Science Translational Medicine︱菌群失调与色氨酸代谢的改变诱发自身免疫疾病

自身免疫性疾病系统性红斑狼疮(SLE)以致病性自身抗体产生为疾病特征,目前研究发现肠道微生物异常可能是SLE发病机制之一。本研究对肠道微生物失调是否导致红斑狼疮易感小鼠色氨酸代谢异常,肠道微生物、色氨酸代谢和基因易感性之间的相互作用是否驱动系统性自身免疫展开探讨。
(1) 老年的三重同源(TC)狼疮易感小鼠模型表现出肠道炎症、菌群失调及红斑狼疮相关表型,未出现明显的肠屏障破坏和肠道菌群移位;
(2) 抗生素处理、粪菌移植和共饲养等实验结果显示,老年TC小鼠粪便移植到无菌B6对照小鼠后可诱导其产生自身抗体和活化免疫细胞等红斑狼疮相关表型,而年轻小鼠粪便移植后并无此反应,老年TC小鼠与B6小鼠共饲养可减少TC小鼠自身免疫应答,由此证实了菌群失调对自身免疫的调控作用;
(3) 粪便非靶向代谢组学结果显示,嘌呤、嘧啶和氨基酸合成途径存在组间差异,这些通路与CD4+ T细胞失调有关;此外,TC小鼠血清色氨酸和5-HT减少而犬尿氨酸增加,抗生素处理可增加粪便色氨酸浓度,但显著降低TC小鼠血清犬尿氨酸水平及犬尿氨酸/5-HT比值,提示色氨酸代谢在自身免疫中起到重要调控作用;
(4) 低色氨酸饮食可调控小鼠肠道菌群、抑制抗dsDNA IgG的产生并缓解自身免疫表型,而高色氨酸饮食起相反作用,表明色氨酸代谢是TC小鼠自身免疫发病机制的重要部分。

Gut microbiota dysbiosis and altered tryptophan catabolism contribute to autoimmunity in lupus-susceptible mice. Sci Transl Med. 2020. doi:10.1126/scitranslmed.aax2220
原文阅读,请长按识别下方二维码

三、Nature Cancer | 醛缩酶B通过抑制G6PD和磷酸戊糖途径抑制肝细胞癌变

代谢重编程是肿瘤细胞的核心特征,也是肿瘤研究领域的重要方向之一。本研究首次阐明果糖-1,6-二磷酸(Fructose-1,6-bis-phosphate,FBP)醛缩酶B(Aldolase B, Aldob)在调控肝癌代谢重编程中的作用、机理及临床意义。
(1) HCC患者肿瘤组织中醛缩酶B(Aldob)表达显著下调,磷酸戊糖途径的限速酶葡萄糖-6-磷酸脱氢酶(G6PD)表达显著上调,且Aldob低表达、G6PD高表达患者生存期短、预后差, Aldob和G6PD负相关表明Aldob在代谢重编程中具有重要作用;
(2) 在N-亚硝基二乙胺(N-nitrosodiethylamine, DEN)诱导的HCC小鼠模型中,Aldob敲除促进肿瘤发生,通过G6PD酶活性增加以及PPP氧化通路增强葡萄糖代谢;回补Aldob则通过抑制G6PD和PPP氧化通路抑制肿瘤形成;
(3) Aldob与G6PD通过直接相互作用来抑制G6PD酶活性,Aldob增强Aldob–G6PD–p53复合物稳定性从而增加p53介导的G6PD抑制作用。在肿瘤细胞中,Aldob表达下调,使得Aldob–G6PD–p53复合体解离,从而降低对G6PD的抑制作用、增强PPP代谢,进而促进肿瘤发生。
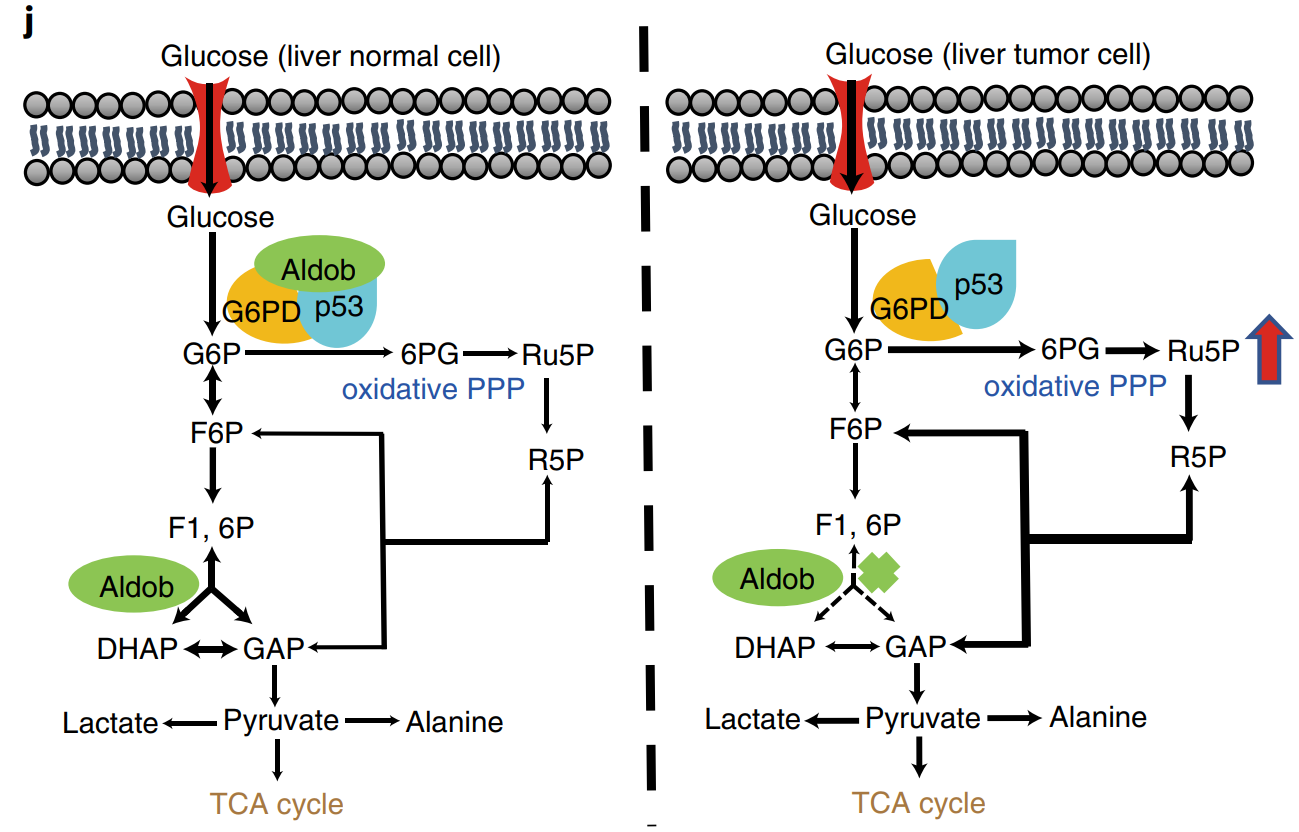
Aldolase B suppresses hepatocellular carcinogenesis by inhibiting G6PD and pentose phosphate pathways. Nat Cancer .2020. doi.org/10.1038/s43018-020-0086-7
原文阅读,请长按识别下方二维码

四、Nature communications | 膳食补充谷氨酰胺可抑制黑色素瘤生长
血清中谷氨酰胺是最丰富的氨基酸,研究表明实体肿瘤如黑色素瘤、胰腺癌和直肠癌发生于谷氨酰胺缺乏的微环境中。本研究发现谷氨酰胺补充剂可抑制表观遗传学激活的致癌途径,并抑制黑素瘤肿瘤的生长,膳食补充谷氨酰胺可以提高转基因黑色素瘤模型的存活率。
(1) 通过饮食或饮水补充谷氨酰胺可以显著抑制异种移植瘤生长,并在其他黑色素瘤小鼠中得到验证,且肿瘤模型小鼠生存期延长,肿瘤负荷减轻;
(2) 补充谷氨酰胺抑制黑色素瘤的致癌基因(如CD271,ES, AXL,LOXL2, MITF, CCL2)表达从而抑制肿瘤生长;
(3) 补充谷氨酰胺有效增加肿瘤微环境中谷氨酰胺浓度从而诱导下游代谢物α-酮戊二酸(αKG)浓度升高,以介导转录组变化;
(4) αKG 是几种JHDM酶的重要辅助因子以介导组蛋白去甲基化,高水平αKG驱动H3K4me3甲基化水平降低,诱导依赖H3K4me3转录的黑色素瘤相关癌基因表达及致癌途径降低,从而抑制肿瘤生长;
(5) 补充谷氨酰胺可提高靶向治疗敏感性。
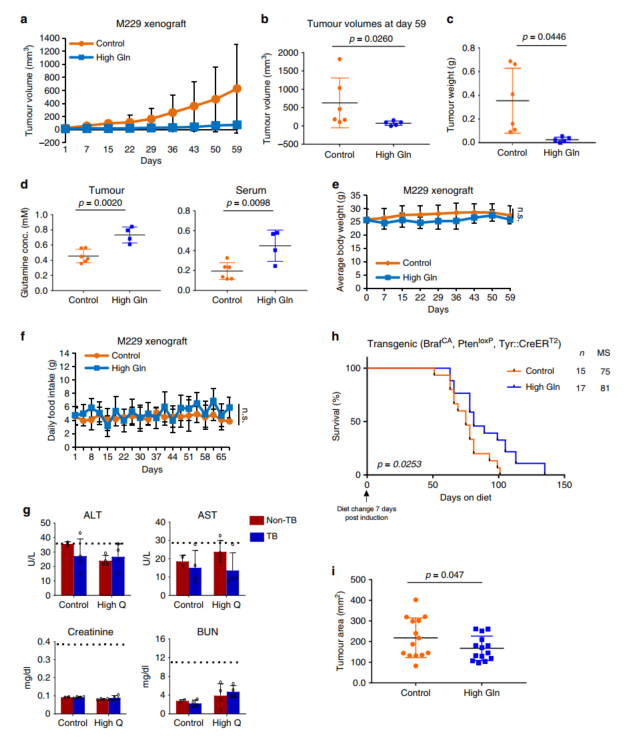
Dietary glutamine supplementation suppresses epigenetically-activated oncogenic pathways to inhibit melanoma tumour growth. Nature communications. 2020. https://doi.org/ 10.1038/s41467-020-17181-w
原文阅读,请长按识别下方二维码

五、Gastroenterology | 肠道菌群-血清代谢物与肝硬化患者急慢性肝衰竭、死亡相关性分析

肝硬化住院患者急性慢性肝衰竭(ACLF)发生率高,且入院30天内死亡率较高。因此需要更好的生物标志物预测这些结果,本研究对多个中心肝硬化患者血清样本进行代谢组学分析,以确定代谢物谱是否可以预测易出现ACLF和死亡的高危患者。
(1) 采用代谢组学技术对来自多中心的602名患者血清样本进行代谢组学分析(平均年龄,56岁; 61%男性;终末期肝病评分19.5),发现1464种代谢物,其中459种脂质类、329种外源性物质、268种未被鉴定、223种氨基酸类,其他为核酸、多肽、碳水化合物等;
(2) 利用协方差分析模型筛选有无ACLF和住院30天内是否发生死亡的差异代谢物,其中与ACLF发生相关的代谢物为高水平芳香族氨基酸和低水平脂质;与住院死亡率相关的代谢物包含65种脂质、18种氨基酸和14种外源性物质;与30天死亡率相关的代谢物包含178种脂质,106种氨基酸,57种外源物质;
(3) 临床指标构建ACLF预测模型,其AUC为0.78 (0.72-0.83),联合3-苯丙酸、4-羟基苯甲酸、5-羟基吲哚乙酸、胆碱、甘胆酸、邻甲酚硫酸盐、氧化三甲胺构建预测模型,AUC升高至0.84 (0.78-0.88, p=0.001)。住院死亡率模型纳入3-甲氧基儿茶酚硫酸盐,4-羟基苯甲酸,胆碱,甘氨猪胆酸和邻甲酚硫酸盐可将AUC从0.73(0.66-0.80)提高至0.81 (0.74-0.85, p=0.002),30天死亡率模型也可以从0.73 (0.69-0.78)升高至0.77(0.73-0.81, p=0.02);
(4) 133例患者粪便样本进行16S rRNA测序分析,其中Clostridium cluster XI, Enterococcaceae和Fusobacteriaceae与代谢物相关,且在ACLF患者、死亡患者中丰度更高,而Lachnospiraceae和Ruminococcaceae则相反。
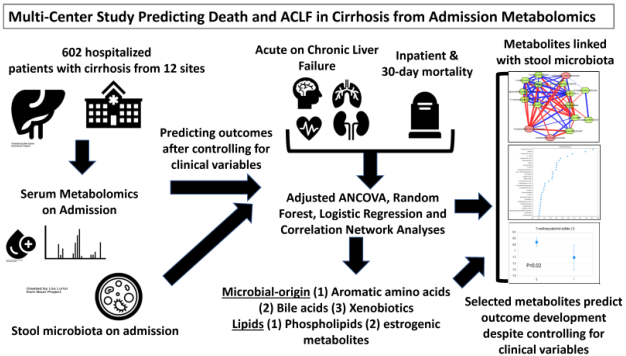
Serum Levels of Metabolites Produced by Intestinal Microbes and Lipid Moieties Independently Associated With Acute on Chronic Liver Failure and Death in Patients With Cirrhosis. Gastroenterology. 2020. doi:10.1053/j.gastro.2020.07.019
原文阅读,请长按识别下方二维码

六、Nature Communictions︱胆汁酸促进新生儿肠道菌群成熟

新生儿出生后其肠道暴露于母体细菌和环境细菌中,相继形成密集而高度动态的肠道菌群。尽管外源性影响因素已被广泛研究,但内在的、宿主介导的机制仍在很大程度上未被探索。本研究旨在分析肝功能和肝脏代谢对早期肠道菌群的影响。
(1) 为研究小鼠出生后肠道微生物的发育情况,获取小鼠(出生后0、6、12、18、24h以及1、 7、14、28、56天)小肠和结肠组织,16S rRNA测序显示出生后24 h内,菌群结构无明显变化,24 h后丰度和多样性显著下降,说明出生24 h后进入多样化发育阶段。在1-21天(PND 1-21)内小肠和结肠中菌群结构没有明显差异,断奶后呈现特定部位菌群结构分布;
(2) 基于前期研究,选择一组肝代谢物作为小肠代谢物代表进行分析。在PND7分别与PND21,28,和56之间,氨基酸、生物胺、酰基肉碱和一些甘油磷脂呈现降低趋势,可能与饮食结构改变有关。断奶后许多胆汁酸显著增加,特别是PND7 vs PND28以及 PND7 vs PND56;
(3) 宿主胆汁酸合成能力、肝胆转运系统的成熟以及细菌胆汁酸代谢的增强,导致断奶后总胆汁酸池及其组成发生明显变化。不过,出生后不久的小鼠小肠内主要以结合型初级胆汁酸为主;
(4) UDCA、GCA、TMCA和TCA与菌群组成随年龄变化存在显著相关,表明这些胆汁酸可作为候选宿生因子推动出生后肠道菌群稳态建立;
(5) 给新生小鼠口服四种胆汁酸(UDCA, GCA, βTMCA和TCA),发现口服βTMCA和TCA显著增加小肠内菌群组成,趋向于成年菌群组成,而UDCA和GCA没有这些影响。

Best et al., Bile acids drive the newborn’s gut microbiota maturation. Nature Communictions. 2020. https://doi.org/10.1038/s41467-020-17183-8
原文阅读,请长按识别下方二维码

七、Gut | 膳食胆固醇调节肠道菌群和代谢物驱动NAFLD相关肝癌

非酒精性脂肪肝(NAFLD)是代谢综合征的肝病表现,其涵盖了从单纯脂肪变性到非酒精性脂肪性肝炎(NASH)的一系列病变。研究发现临床和NASH动物模型中肝脏胆固醇稳态都存在异常。本研究确定了膳食胆固醇在NAFLD–HCC(肝癌)发生发展中的作用和机制。
(1) 采用高脂高胆固醇(HFHC),高脂低胆固醇(HFLC)或正常饮食饲喂小鼠,结果表明高胆固醇可自发诱导小鼠依次发生脂肪变性、脂肪性肝炎、肝纤维化和HCC;
(2) 16S rRNA测序分析肠道菌群,发现HFHC喂养小鼠中粘螺旋菌、脱硫弧菌、厌食性褐变和脱硫弧菌科依次增加;双歧杆菌和拟杆菌属减少,这在高胆固醇血症患者中得到证实;
(3)基于LC-MS代谢组学技术分析血清代谢产物,发现膳食胆固醇可引起肠道代谢物改变,其中胆汁酸代谢通路变化显著,TCA 、TUDCA、 GCA、TCDCA水平升高,而色氨酸代谢中间产物3-吲哚丙酸水平降低;
(4) 将不同饮食小鼠粪便移植到无菌小鼠中,发现HFHC喂养的小鼠粪菌移植后肝脏脂质出现积累,炎症和细胞增殖增强;
(5) 对HFHC喂养的小鼠给与降胆固醇药物阿托伐他汀,发现阿托伐他汀可恢复胆固醇诱导的肠道菌群失调,并完全阻止NAFLD-HCC的发展。

Dietary cholesterol drives fatty liver-associated liver cancer by modulating gut microbiota and metabolites. Gut. 2020.https://doi.org/ 10.1136/gutjnl-2019-319664.
原文阅读,请长按识别下方二维码

八、Developmental Cell | 饮食脂质导致秀丽隐杆线虫和人类癌细胞的铁死亡

铁死亡是一种与氧化脂质相关的调节性细胞死亡形式,研究表明,在哺乳动物中,通过小分子铁螯合剂和捕获自由基的抗氧化剂可以抑制铁死亡,不过体内饮食对铁死亡的机制尚不清楚。本研究利用秀丽隐杆线虫模型探讨双高-γ-亚麻酸(DGLA)诱导铁死亡的调控机制。
(1) DGLA通过NADPH氧化酶(NOX)产生的活性氧(ROS)和铁积累诱导线虫生殖细胞铁死亡;
(2) 通过饮食或内源性单不饱和脂肪酸(MUFAs)如油酸(OA)提升单不饱和脂肪酸水平,能够抑制DGLA诱导的生殖细胞铁死亡;
(3) 含有多不饱和脂肪酸(PUFAs)的磷脂增加和含有保护性的多不饱和脂肪酸磷脂丧失,都可诱导肿瘤细胞铁死亡,表明DGLA可能通过直接调节膜磷脂酰化诱导细胞铁死亡;
(4) 内源性合成的醚类脂质通过抑制脂质过氧化物在富含PUFAs膜中的传播来保护细胞免受膳食DGLA诱导的细胞铁死亡。
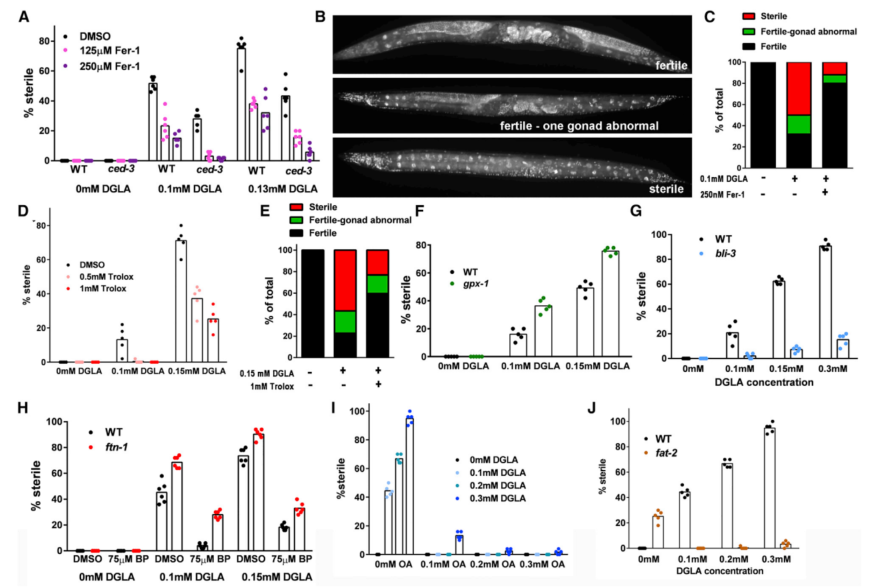
Marcos A Perez,et al. Dietary Lipids Induce Ferroptosis in Caenorhabditis elegans and Human Cancer Cells. Developmental Cell. 2020. https://doi.org/ 10.1016/j.devcel.2020.06.019
原文阅读,请长按识别下方二维码

精彩推荐



