文献解读
绘谱导读︱6月代谢组学文献精选
一、Cell | 重磅首发–孕期血液代谢图谱将更加精准的预测孕妇的预产期和分娩时期
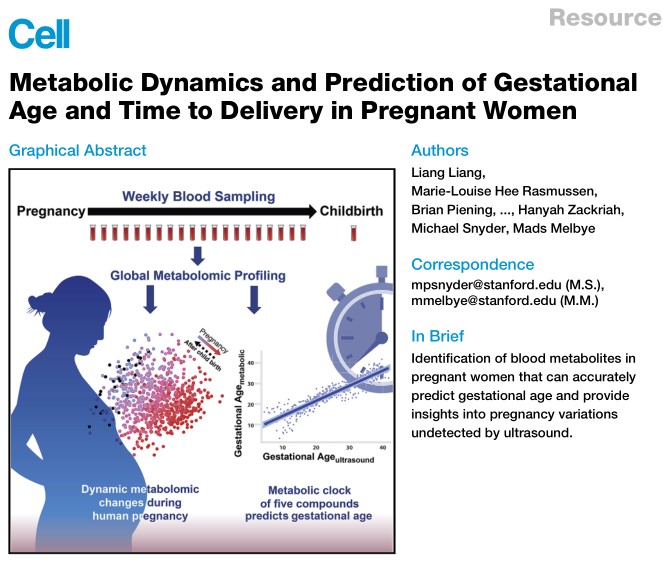
(1) 本研究对30名孕妇每周采集到的784份血液样本进行非靶向代谢组学检测,共鉴定到9651种代谢物,其中4995种代谢物水平在孕期/产后发生了显著改变,其中一些激素类物质如estriol-16-glucuronide, estrone 3-sulfate,THDOC显著升高,而脂类及类脂类分子如单酰基甘油、磷脂酰胆碱等显著降低,母亲血液中代谢物水平虽然随着孕期的改变呈现动态变化,但大部分代谢物的含量在产后又恢复到正常水平,首次提供怀孕与产后近一万个血液小分子随时间变化的高分辨图谱;
(2) 研究人员选择其中42个小分子代谢物建立线性模型,并在两组相互独立的人群中,对分娩时期进行预测,进一步精简预测模型,仅使用五种血液代谢物建立组成的代谢时钟(孕酮等4种激素和1种脂质),仍能够准确预测分娩时期(发现队列R=0.92;两个独立的验证队列R分别为0.89和0.91);
(3) 研究人员还建立了只包含2-3种血液分子的分子预测模型,可以准确预测孕晚期孕妇是否将在2周、4周或者8周之后分娩,并可精准预测孕期是否已经超过20周、24周、28周、32周和37周,而这些时间是与流产、胎儿存活以及不同早产时期相关的孕期关键时间点;
(4) 研究人员还发现一些孕妇的分子时钟保持稳定,而另一些孕妇会在某一段时间出现分子时钟提前或者落后的现象,如果一个孕妇的分子时钟提前,她极有可能会在超声估计的预产期之前分娩,而如果一个孕妇的分子时钟落后,她的孩子则很有可能会在预产期之后诞生,可见人类怀孕的分子时钟中包含着常规超声检查完全无法涵盖的全新生物学信息,这一发现具有很好的应用前景,未来将有希望对更多孕期女性的预产期和分娩时期作出更加精准的预测。
Metabolic Dynamics and Prediction of Gestational Age and Time to Delivery in Pregnant Women. Cell(2020). https://doi.org/10.1016/j.cell.2020.05.002.
原文阅读,请长按识别下方二维码


二、Hepatology | 微生物组+代谢组+预测宏基因组学研究大样本人群肝脂肪变性
肝脂肪变性是全世界最常见的肝病,肝脂肪变性的病因是多方面的,如酒精性脂肪肝疾病中过量饮酒和非酒精性脂肪肝疾病(NAFLD)中不健康的饮食习惯,是导致疾病发展的关键。此外,肠道微生物组对脂肪形成也具有重要影响,本研究纳入1355名参与者(472名通过超声检查诊断为脂肪肝患者)采用16S rDNA测序分析微生物多样性和组成、血清代谢组学及功能宏基因组学分析(所有分析均对年龄,性别,BMI,酒精,饮食和质子泵抑制剂进行校正)以探究其与肝脂肪变性的关联。
(1) 脂肪肝人群中的α多样性较低,而其β多样性差异较大,经Lasso分析共获得37个差异菌属,其中三个属在校正后仍显著相关(Coprococcus3:β=-65;Ruminococcus Gauvreauiigroup:β= 62;和Ruminococcus Gnavusgroup:β= 45,Q值= 0.037);
(2) 宏基因组分析表明,脂肪肝中存在次级胆汁酸合成和生物素代谢的途径,但D-丙氨酸代谢缺乏;
(3) 代谢组学结果显示,芳香族氨基酸、支链氨基酸及糖蛋白乙酰基与脂肪肝和R. Gnavusgroup呈正相关,与α-多样性和Coprococcus3呈负相关;
(4) 本研究首次大规模证明较低的微生物多样性及Coprococcus 和Ruminococcus Gnavus与脂肪肝的关联性,同时发现脂肪肝和α多样性呈相反的代谢谱特征。
Microbiomics, metabolomics, predicted metagenomics and hepatic steatosis in a populationbased study of 1355 adults. Hepatology(2020).
https://doi.org/10.1002/hep.31417
原文阅读,请长按识别下方二维码


三、Molecular Cell | 饮食到癌细胞代谢的分子联系
环境因素在形成癌细胞代谢中起着重要作用。就代谢而言,饮食和营养是主要的环境因素,并已成为决定癌细胞代谢的关键因素。该综述探讨了癌症代谢的新概念,以及饮食和营养如何影响癌细胞的代谢。
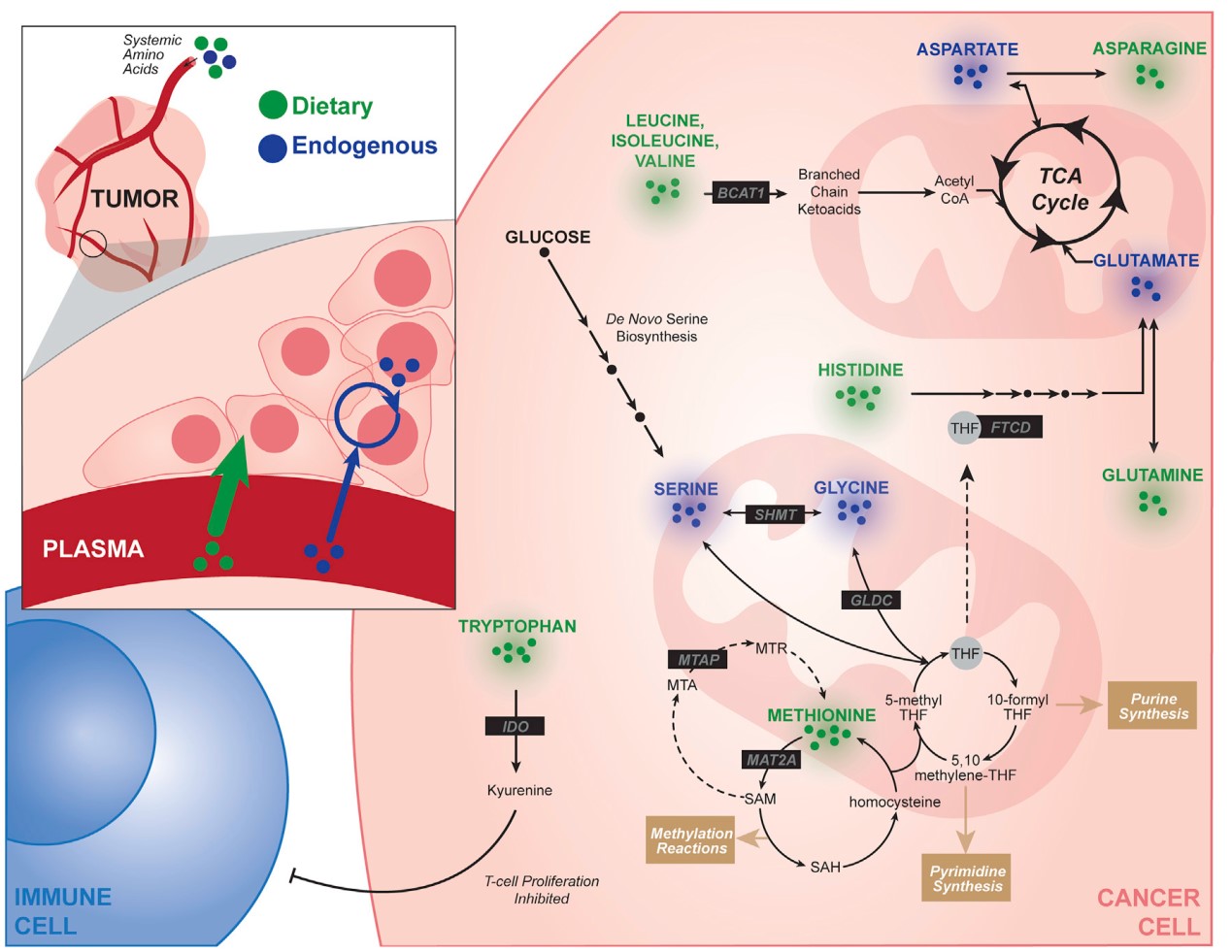
(1) 癌细胞会重塑自身代谢以满足失控的细胞增殖,包括对能量、生物合成前体和信号中间分子的需求;
(2) 饮食成分会影响循环代谢因子和营养物质的可利用性,反过来,也会影响肿瘤细胞的代谢,饮食是影响癌细胞代谢的关键因素,但其如何影响癌症进展的分子机制仍有待进一步研究;
(3) 目前被报道较多的饮食干预措施包括热量限制(Calorie Restriction)、禁食和宏量营养素的平衡,如碳水化合物、脂肪和蛋白质的摄入;
(4) 肿瘤中碳水化合物、脂类和氨基酸的摄取和代谢发生改变,癌症亚群表现出葡萄糖代谢改变、单碳代谢改变、对氨基酸代谢的依赖增加,以及许多其他途径;
(5) 癌细胞的增殖需要重塑氨基酸代谢,癌细胞对这些营养物质外源性摄取的依赖似乎是癌症特有的代谢弱点,使其成为潜在的干预靶点,如蛋氨酸、半胱氨酸、支链氨基酸、丝氨酸和甘氨酸、精氨酸、组氨酸、天冬氨酸和天冬酰胺;
(6) 饮食驱动的肠道菌群变化与癌症的形成、进展及治疗相关,但菌群在癌症中所起的作用仍有待进一步阐明。
The Molecular Link from Diet to Cancer Cell Metabolism, Molecular Cell (2020), https://doi.org/10.1016/j.molcel.2020.05.018
原文阅读,请长按识别下方二维码

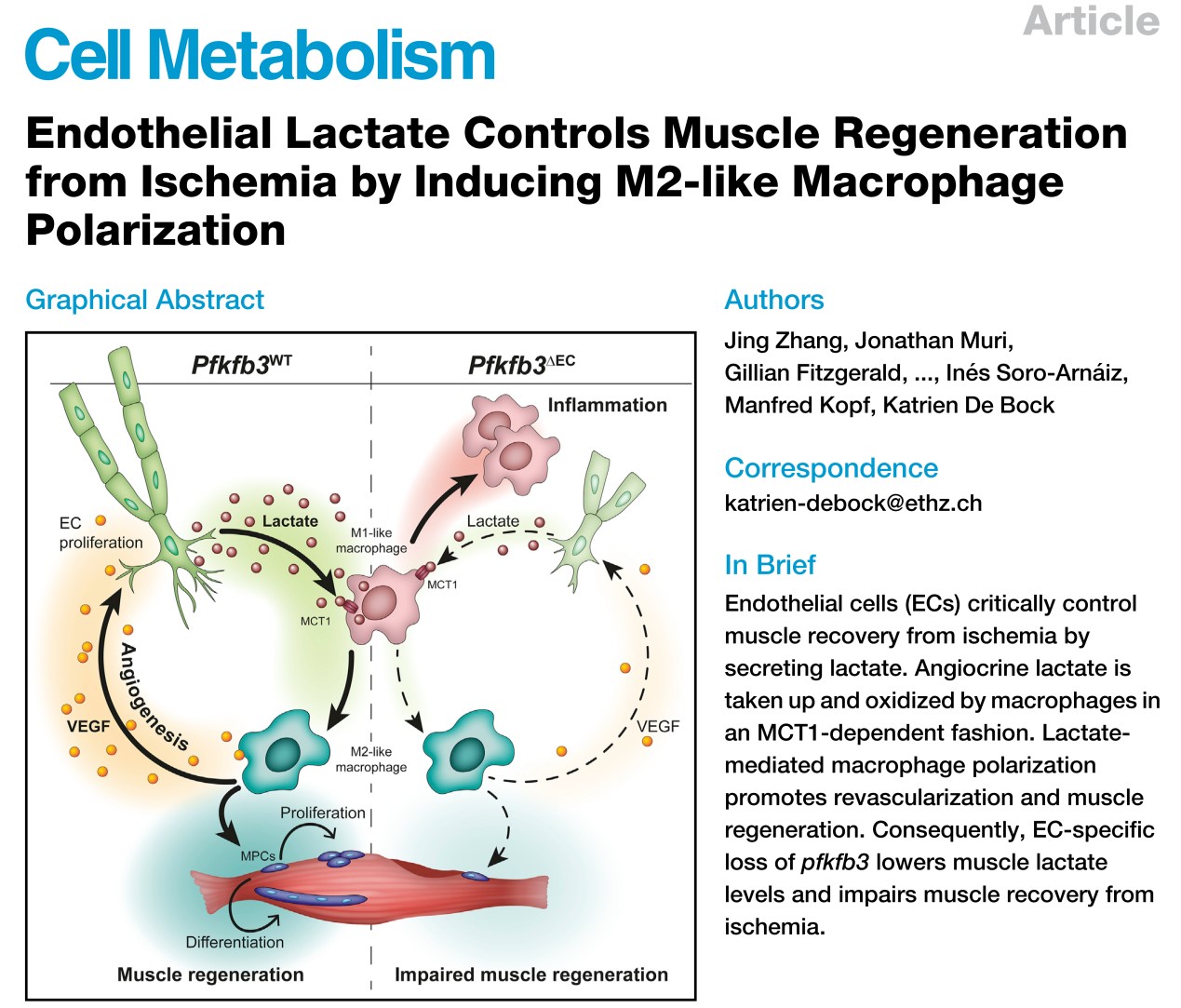
四、Cell Metabolism | 乳酸通过诱导巨噬细胞M2极化来调控肌肉再生
(1) 骨骼肌缺血后的再生是由多种细胞之间严格定时的相互作用来协调的,但对这些相互作用仍然知之甚少;
(2) 糖酵解调节因子pfkfb3的内皮细胞特异性缺失降低了下肢缺血后的血管重建,损伤了肌肉再生,主要是由于巨噬细胞极化为促血管生成和促再生的M2样表型能力降低所致;
(3) pfkfb3的缺失降低了内皮细胞的乳酸分泌,乳酸可介导MCT1依赖的巨噬细胞功能极化;
(4) 内皮细胞的乳酸穿梭使得巨噬细胞能够促进肌肉祖细胞的增殖和融合,同时增加VEGF的生成正反馈刺激血管的再生;
(5) 增加缺血时的乳酸水平可恢复巨噬细胞的极化,促进肌肉再灌注和再生,而巨噬细胞特异性的MCT1敲除可阻止巨噬细胞M2型极化。
Endothelial Lactate Controls Muscle Regeneration from Ischemia by Inducing M2-like Macrophage Polarization. Cell Metabolism. (2020).
https://doi.org/10.1016/j.cmet.2020.05.004
原文阅读,请长按识别下方二维码


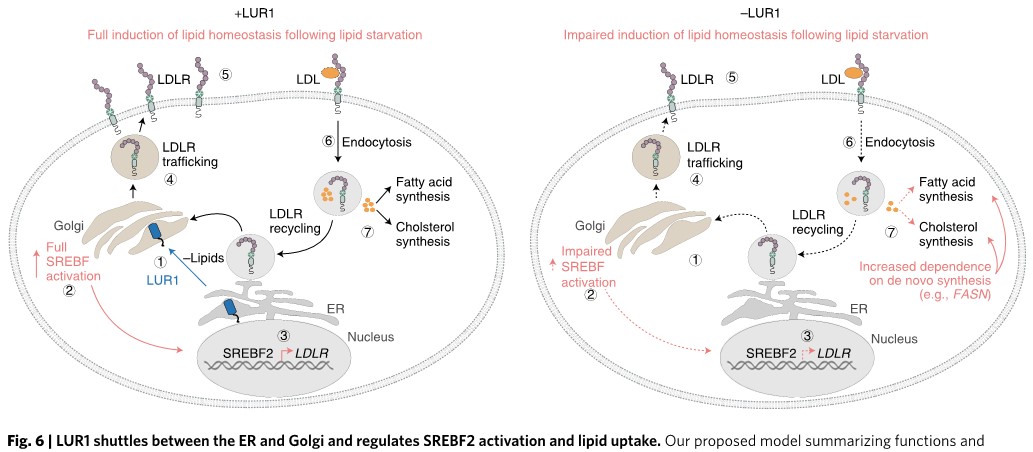
五、Nature Metabolism | 抗癌新靶点–新型脂质代谢调节因子LUR1的发现
癌细胞利用脂质代谢提供营养物质并恶性增殖最终导致机体出现癌症表型,脂质摄取/脂肪酸合成脂质代谢的改变是癌症的典型特征,当癌细胞自身无法生产脂质时,便从环境中吞噬脂质以维持营养供给,本研究发现一种新型脂质摄入调节因子LUR1(C12orf49)可以帮助启动一组直接参与脂质输入的基因,以响应脂质缺乏时调节外源脂质的摄入,不失为一种新的改善脂质代谢稳态的抗癌新靶点。
(1) 对FASN缺失或野生型HAP1及5个同类细胞系进行全基因组CRISPR筛选,重点关注脂质代谢,揭示了脂肪酸从头合成与脂质吸收过程之间的强相互作用,突显了一种平衡细胞内合成脂质与从细胞外环境吸收脂质的系统;
(2) 对亲本HAP1和FASN-KO细胞进行靶向代谢谱分析,发现FASN-KO细胞中FASN底物丙二酰辅酶A显著增加,表明其作为缺陷脂肪酸合成模型系统的适用性;
(3) 对WT和FASN-KO HAP1细胞进行独立验证并确定了高度可信的阴性GIs是SLCO4A1, PGRMC2, LDLR, RABL3和C12orf49的相互作用,FASN突变细胞对脂质摄取具有强烈依赖性,可见它们与脂质代谢有关;
(4) 在FASN和ACACA谱中发现最强阴性GIs涉及未鉴定的基因C12orf49,C12orf49的表达与肾癌、乳腺癌、肝癌等多种肿瘤预后差异有关,且发现该基因在脂质代谢中具有功能性作用;
(5) C12orf49缺失导致LDL摄取显著减少,在脂质缺乏时C12orf49在内质网和高尔基体之间穿梭,无偏向的全基因组GI筛选、转录组、蛋白质组和生化研究揭示了未鉴定基因C12orf49在维持脂质稳态中的新作用;
(6) 本研究确定了LUR1调节SREBF2信号以响应脂质缺乏时调节外源脂质摄取中的潜在作用,同时证明了系统的GI图谱在揭示人类细胞代谢缓冲机制方面的作用,为改善脂质代谢稳态相关的疾病提供了新的抗癌靶点。
Systematic mapping of genetic interactions for de novo fatty acid synthesis identifies C12orf49 as a regulator of lipid metabolism. Nature Metabolism(2020).
https://www.nature.com/articles/s42255-020-0211-z
原文阅读,请长按识别下方二维码


六、Nature | 肿瘤代谢物通过破坏局部染色质信号传导抑制DNA修复
代谢失调和基因组完整性破坏是癌症的标志,异柠檬酸脱氢酶1或2 (IDH1或IDH2)基因的体突变,富马酸水合酶(FH)和琥珀酸脱氢酶(SDHA、SDHB、SDHC和SDHD)基因的种系突变导致人类恶性肿瘤中2-羟基戊二酸(2-HG)、琥珀酸和富马酸代谢物的含量增加,这些代谢物与DNA修复相关并抑制同源依赖修复(HDR)途径,它们对正在进行临床试验的聚(ADP-核糖)聚合酶(PARP)抑制剂具有高度敏感性,但上述单体代谢物抑制HDR的机制尚不清楚。
(1) 单代谢物诱导的赖氨酸去甲基化酶KDM4B的抑制导致DNA断裂周围位点组蛋白3赖氨酸9 (H3K9)异常的高甲基化,掩盖了一个局部的H3K9三甲基化信号(H3K9me3),该信号对HDR的正常执行至关重要;
(2) 同基因细胞系的蛋白质印迹分析显示IDH R132H突变或者敲低FH和SDH并不会改变HDR通路中RAD51,BRCA2, ATM, TIP60, MRE11及RPA的蛋白水平,但由IDH,FH,SDH突变产生的2HG, 琥珀酸和富马酸可以直接抑制HDR的功能;
(3) 作者通过构建DSB-CHIP以监测HDR因子向位点特异性DSB募集的情况,发现对照组细胞在DSB产生后损伤标志物γ-H2X迅速累积并很快消失,而2-HG,琥珀酸和富马酸预处理的细胞γ-H2X信号则会持续存在一段时间,说明细胞对于DSB修复能力减弱;
(4) 作者构建KDM4A和KDM4B敲除的细胞系,结果显示只有敲除KDM4B才会导致HDR缺陷,并会导致H3K9me3水平的异常升高,而敲除KDM4A则没有效果,表明KDM4B的催化活性对于HDR是必需的;
(5) H3K9 me3的快速突增可以协调TIP60和MRE11的募集,促进ATM激活,许可末端切除并导致RPA,BRCA1和RAD51的下游募集,高水平的H3K9me3可以防止甲基化过高,从而损害HDR因子的募集和结束切除,赋予对PARP抑制剂的敏感性;
(6) 以上结果揭示了肿瘤代谢物通过KDM4B导致H3K9me3异常升高损害HDR因子的募集从而抑制DNA修复途径,将为与代谢物相关的恶性肿瘤患者的治疗奠定基础。
Oncometabolites suppress DNA repair by disrupting local chromatin signaling. Nature(2020).
https://doi.org/10.1038/s41586-020-2363-0
原文阅读,请长按识别下方二维码


七、Nature cell biology | 胞外丝氨酸调控表皮干细胞命运和肿瘤发生
组织干细胞是许多恶性肿瘤的起源细胞,代谢物调节自我更新和分化的平衡来维持组织稳态,表皮干细胞(EpdSCs)是鳞状细胞癌的起源细胞,本研究发现:
(1) 促癌EpdSCs是丝氨酸营养缺陷型,其生长和自我更新需要大量的外源丝氨酸;
(2) 恶性前干细胞的生长依赖于细胞外丝氨酸,有限的胞内NAD+再生导致丝氨酸合成受限;
(3) 当细胞外丝氨酸受到限制时,EpdSCs会重新激活丝氨酸合成,从而刺激α-酮戊二酸依赖的双加氧酶,去除抑制性组蛋白修饰H3K27me3并激活分化程序;
(4) 丝氨酸饥饿或强制的α-酮戊二酸产生拮抗鳞状细胞癌的生长,相反,阻断丝氨酸合成或抑制α-酮戊二酸驱动的去甲基化会促进肿瘤恶性进展;
(5) 以上发现提示细胞外丝氨酸是EpdSCs命运的关键决定因素,指出肿瘤启动过程中营养利用如何与干细胞相结合,靶向丝氨酸摄取或将消除致癌干细胞,从而为靶向致癌干细胞的治疗提供希望。

Extracellular serine controls epidermal stem cell fate and tumour initiation. Nature cell biology(2020). https://doi.org/10.1038/s41556-020-0525-9
原文阅读,请长按识别下方二维码


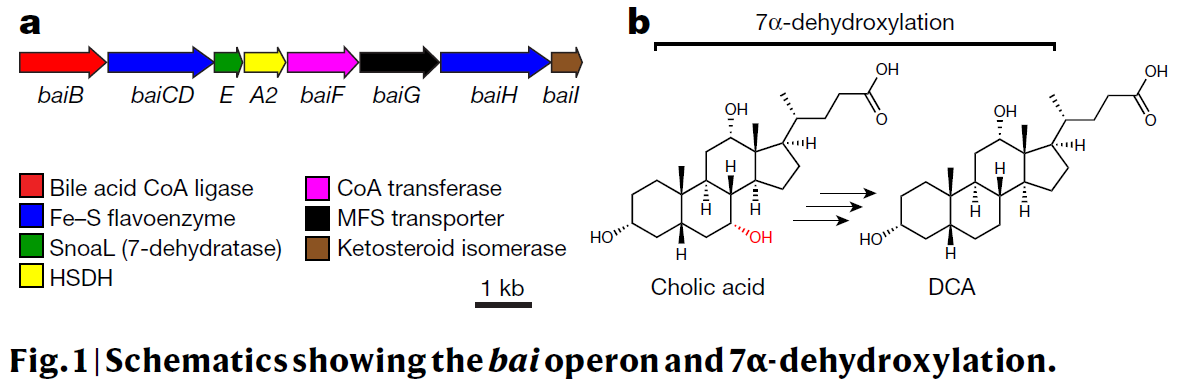
八、Nature | 肠道菌群介导胆汁酸脱羟基的代谢途径
(1) 肠道微生物代谢产物脱氧胆酸(DCA)和石胆酸(LCA)具有抑制艰难梭状芽胞杆菌生长、促进肝癌的发生并通过G蛋白偶联受体TGR5调节宿主代谢的功能;
(2) 通过体外克隆操纵子编码的Bai酶并与胆酸(CA), NAD+, CoA以及ATP在厌氧的条件下共同孵育后,发现在液相色谱-质谱分析后会出现CA到DCA的时间依赖性转化,说明重组的BaiB、BaiCD、BaiA2、BaiE、BaiF和BaiH足以促进7α-脱羟基作用的发生而不需要其他酶的参与;
(3) 利用穿梭载体成功将Bai酶相关的质粒转入Clostridium sporogenes中产生了MF001菌株,其与CA共同孵育时,MF001菌株可以随着孵育时间的延长而产生DCA,即研究人员成功构建了具有核心bai基因簇并足以促进胆汁酸脱羟基化作用发生的菌株;
(4) 将MF001菌株转入无菌小鼠后,体内检测到DCA的产生,但是比Clostridium scindens菌株的水平要低一些,这可能是因为体内环境较为复杂且可能需要其他额外因子参与导致的;
(5) 本研究揭示了完整的胆汁酸7α-脱羟基化途径,使得对内源性人体代谢途径的认识更近一步, 将该途径设计成梭状芽孢杆菌孢子基因,并将DCA和LCA的产生赋予非产生共生体,证明了微生物来源的途径可以异种表达和控制,同时该途径的关键特征可作为在肠道中产生高丰度代谢物的其他途径的模型。
A metabolic pathway for bile acid dehydroxylation by the gut microbiome. Nature(2020). https://doi.org/10.1038/s41586-020-2396-4
原文阅读,请长按识别下方二维码


九、Cell | 代谢指纹图谱将致癌的PIK3CA与花生四烯酸衍生的类花生酸类物质联系起来
(1) 研究人员利用智能手术刀(iKnife)对烧灼标本的气溶胶进行采样,提出了一种新的实时诊断模式,将代谢表型与突变的PIK3CA基因型耦合,发现iKnife和REIMS(快速蒸发电离质谱)可通过雾化组织材料的MS分析用于PIK3CA多发性乳腺癌的近实时诊断;
(2) PIK3CA突变体驱动mTORC2-PKCζ介导的钙依赖性磷脂酶A2(cPLA2)的激活,致癌的PIK3CA通过mTORC2-PKCζ-cPLA2信号通路促进花生四烯酸(AA)代谢,以及类花生酸类物质的过量产生,从而以超出细胞自主的方式促进细胞增殖;
(3) 使用cPLA2抑制剂ASB14780,发现cPLA2的遗传和药理学抑制作用选择性降低致癌PIK3CA介导的致瘤性,而这可通过补充外源AA恢复;
(4) ASB14780抑制cPLA2协同膳食脂肪限制,可抑制PIK3CA诱导的乳腺肿瘤生长,恢复抗癌免疫反应,突出了饮食中限制AA对治疗反应的作用;
(5) 本研究证明了iKnife/REIMS能够根据其代谢指纹对临床相关肿瘤特征进行接近实时的预测,为癌症诊断和治疗选择提供了一种新的方法。
Metabolic Fingerprinting Links Oncogenic PIK3CA with Enhanced Arachidonic Acid-Derived
Eicosanoids. Cell. 2020. https://doi.org/10.1016/j.cell.2020.05.053
原文阅读,请长按识别下方二维码

精彩推荐
5. 公开课回顾 | 代谢组学临床转化突破之路–从临床研究到临床转化



