文献解读
Cell | 丙酸通过免疫调节机制改善多发性硬化症病程
多发性硬化症(MS)以对白质慢性自体免疫攻击为特征从而导致中枢神经系统(CNS)内神经轴突周围的髓鞘破坏,临床表现为促炎性自身反应性T细胞(即辅助性T(Th)17细胞和Th1细胞)增加,而调节性T(Treg)细胞数量减少且功能受损。这种自身反应和调节因素之间的不平衡导致了复发性组织炎症,并在一定程度上介导了MS患者持续的神经退行性病变和随后的神经功能缺陷,如果不进行治疗或将导致严重的残疾(如瘫痪、认知障碍和自主神经功能障碍)。MS动物模型表明短链脂肪酸(SCFAs)如丙酸(PA),可显著增加肠道相关Treg细胞数量,随后降低全身免疫反应,并伴随疾病改善。德国鲁尔大学圣约瑟夫医院Aiden Haghikia研究团队围绕“MS患者体内SCFAs水平和产生SCFAs的肠道菌群是否发生变化及补充PA对Treg细胞的诱导作用是否适用于MS”进行研究,相关成果发表于《Cell》。
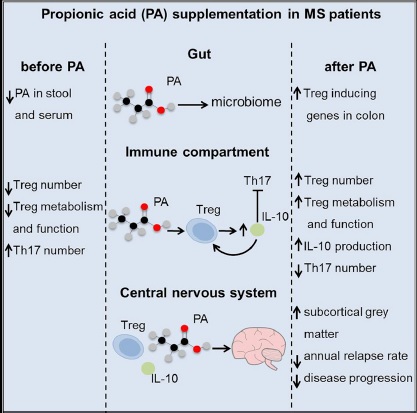
MS患者血清和粪便样本中PA含量降低且微生物组发生改变
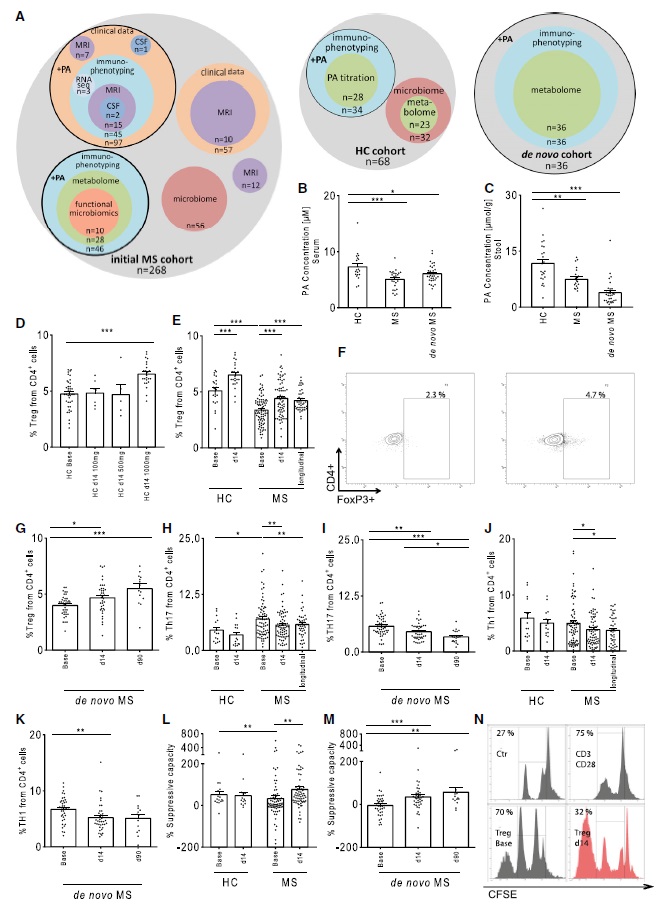
本研究收集MS患者和健康对照者(HC)血清和粪便样本(图1A) 采用LC-MS/MS测定SCFA代谢物(丁酸(BA)、乙酸(AA)和PA)的浓度(图1A),产生SCFA的细菌变化及膳食PA对免疫调节元件的影响。与HCs相比,MS患者粪便和血清中PA显著降低(图1B-1C),并在新发初治MS患者(图1A)队列得到验证,但仍需更大的样本量才能验证疾病疗法是否对PA水平有影响。接着本研究对MS患者肠道微生物组组成是否发生改变,以及SCFA降低是否与微生物组的改变有关进行了分析。因此,对一个大型MS确诊患者队列和HCs进行菌群分析,发现HCs和MS之间菌群α和β多样性没有显著差异,但肠道微生物分类发生改变。这种肠道失调是MS的普遍特征,因此仍需对PA是否可以调节肠道微生物群以产生有益的治疗效果进一步评估。
PA补充可平衡Treg /Th17以具有更强调控表型
前期工作显示MS患者粪便和血清中PA浓度降低同时产SCFA菌群丰度也伴随降低,因此,作者假设肠道产生SCFA细菌的减少会限制全身PA的可用性,从而导致MS和其他自身免疫性疾病中Treg和Th17失衡。已接受免疫调节治疗的患者进行PA补充,发现患者已经稳定3.7(±2.3)年(图1A+PA队列)。在HCs初始剂量滴定后(图1D),91例MS患者和24例HCs进行PA(1000 mg/d)补充,分别在第0天(PA摄入前)、第14天收集全血进行T细胞亚群的免疫表型和功能分析。与HCs相比,MS患者基线Treg细胞数量明显减少(图1E)。补充PA 14天后,HCs Treg细胞数量增加约25%,MS患者Treg细胞数量增加30%(图1E-1F)。在14天后选择继续补充PA的MS患者中发现PA对外周Treg细胞的影响持续存在(图1E),并在新发MS患者中得到验证,PA补充显著增加Treg细胞数量(图1G)。此外,相比HCs,MS患者基线Th17细胞数量显著升高,而MS组和新发MS组进行PA治疗第14天和第90天时的Th17细胞数量显著下降(图1H-1I)。作者还探讨了PA对类风湿关节炎的影响,发现患者Treg细胞数量在口服PA 14天后显著增加约45%, 28天后显著增加72%,进一步表明PA具有免疫调节特性。
PA补充通过增加抑制能力诱导Treg功能增加
借助体外功能分析研究PA处理后Treg细胞的增加是否伴随着功能改变。将分离的Treg细胞与来自同一供体的外周血单核细胞(PBMCs)共培养,测定Treg细胞对PBMCs增殖的抑制能力。与HCs相比,MS患者第0天分离的Treg细胞共培养的PBMCs增殖显著升高,提示MS患者Treg细胞的抑制能力减弱(图1L)。而在PA补充下,Treg细胞的抑制能力在MS(复发缓解型和继发进展型)和新发MS患者中显著增加,而在HCs中没有改变(图1L-1N)。
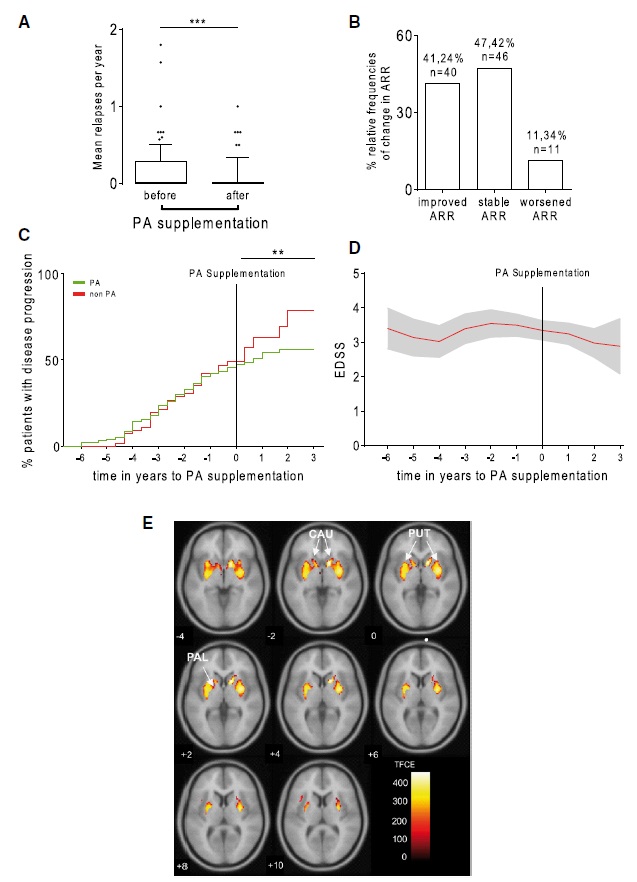
长期补充PA可降低MS患者年复发率并降低疾病进展
采用97例患者的纵向临床数据以研究补充PA所引起的免疫效应是否对MS的临床进展产生影响(图1A)。补充PA后41.2%的患者出现改善,47.4%保持稳定,仅11.3%的患者年度复发率(ARR)升高(图2B)。总的来说,补充PA之前和之后的ARR从0.24显著下降到0.08(图2A)。接受PA辅助治疗的患者疾病进展风险降低(图2C)。此外,相比无PA辅助治疗组,PA组的扩展残疾状况量表(EDSS)稳定(图2D)。
22例接受辅助PA治疗的MS患者和22例非PA患者在基线和随访时间点均接受1.5-T MRI扫描,纵向分析发现两组患者双侧额中部和额上、中央前和中央后区域的整体和区域脑容量显著减少。有趣的是,PA组纹状体,特别是尾状核、壳核和苍白球体积显著增加。作者推测长期PA补充可能引起脑脊髓液(CSF)中PA水平增加导致PA组纹状体(尾状体、壳核和苍白球)体积显著增加(图2E)。采用LC-MS/MS对3例在PA补充前和期间进行腰椎穿刺的MS患者进行了脑脊液中PA浓度测定,发现脑脊液中PA浓度在PA补充后显著升高。
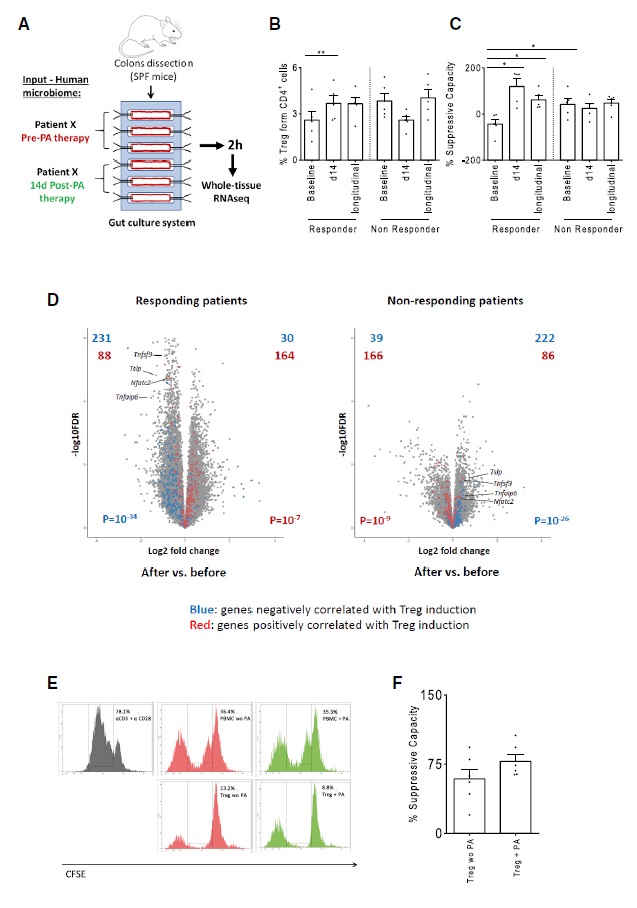
补充PA后可引起明显的结肠转录应答
为了测试PA补充后引起的微生物组改变是否会对局部肠道组织产生功能性影响,作者评估了患者补充PA前、补充后14天的粪便样本对肠道器官培养系统的影响。补充PA前后,将MS患者中应答者(n = 5)和无应答者(n = 4)的微生物组分别以107个CFU/mL的相等细菌载量引入肠道培养系统,并在2小时后对36例结肠组织进行RNA测序(研究设计图3A-3C)。差异基因表达显示应答组肠道组织中129个转录本表达增加,314个表达减少;无应答组有44个转录本增加和112个表达减少。在应答患者中,与Treg细胞正相关的基因被诱导,而负相关的基因被抑制,表明补充PA后应答患者粪便具有Treg细胞诱导特性(图3D),但无应答患者显示出相反的效果。PA处理后厌氧菌的细菌载量略有增加,所有样品中的需氧菌减少(n = 10)。综上结果表明, MS患者进行PA补充后其微生物组在诱导Treg发育方面发挥了功能性作用。
PA体外刺激Treg细胞的抑制能力增加并由IL-10介导
为直接观察PA是否导致Treg细胞抑制功能的增加,从HCs的PBMCs中分离出Treg细胞,并在有或无PA的情况下培养5天,随后将收获的细胞进行抑制试验,在有或没有经过PA处理的Treg细胞共培养的条件下检测PBMCs增殖,发现PA处理增加了体外Treg细胞的抑制能力(图3E-3F)。在体外抑制实验中(图1L-1M),从PA治疗的患者中分离出的细胞上清中细胞因子数量显示潜在炎症的改变。MS组和新发MS组在PA处理后白细胞介素-10(IL-10)显著升高(图4A-4B);MS组(初始混合队列)中IL-17和干扰素-γ(IFN-γ)显著降低,说明抑制能力与IL-10的量显著相关。
IL-10介导Treg细胞功能的增加。为研究细胞因子和免疫细胞功能之间的联系,作者检测了PA诱导的Treg抑制功能增加是否需要IL-10。从新诊断为MS患者基线和第14天分离Treg细胞并用抗IL-10抗体等进行抑制试验。在第14天时抑制IL-10可阻止PA给药后抑制能力的增加(图4C),而在基线没有差异,表明IL-10对于PA调节Treg细胞功能的必要性。
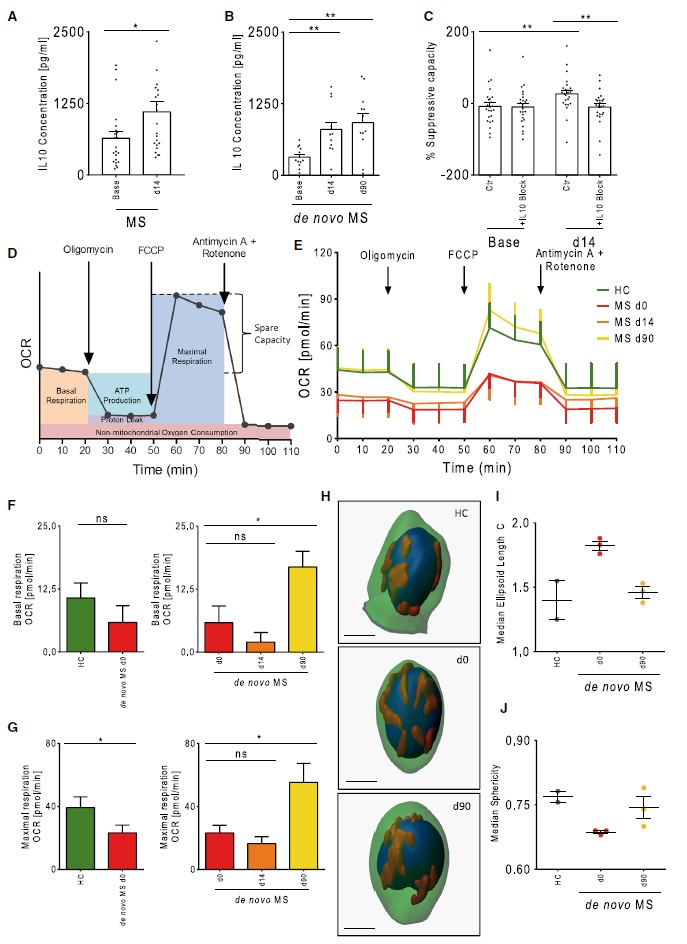
补充PA增加线粒体呼吸并改变线粒体形态
接下来作者探究Treg细胞抑制能力和IL-10产生增加的潜在机制,测量了PA补充前后MS患者Treg细胞的耗氧量(OCR)。在基线,MS患者与HCs相比最大呼吸减少(图4F-4G)。长期PA干预(90天)能够使MS患者Treg细胞的线粒体呼吸恢复到HCs水平,MS患者的基础呼吸和最大呼吸显著增加(图4D-4G)。与HCs线粒体相比,MS线粒体具有较高的椭球体长度和较低的球形度。与第0天相比, MS患者补充PA 3个月后MS线粒体形态显示出更多球形和更少椭球形的趋势(图4H-4J)。90天MS患者Treg细胞的线粒体形态与HCs相似,表明MS 的Treg细胞线粒体不仅功能受损,且具有形态改变的表型,可通过长期补充PA逆转,可见线粒体功能和完整性在MS发病机制中发挥重要作用。
PA补充后IL-10和TNF家族的T细胞相关基因表达上调
为阐明PA补充后MS患者Treg细胞抑制能力增强的内在机制,PA补充前后MS患者外周血细胞的基因表达谱分析发现585个显著调控基因(517个上调和68个下调基因),通路分析揭示主要为T细胞特异性调控基因变化(图5A)。网络分析显示,补充PA后,IL-10和TNF是两个主要的基因相互作用枢纽(图5B),体现了它们在协调细胞对PA治疗反应方面的潜在生物学重要性。
PA补充后,筛选到线粒体相关差异表达基因(p <0.01,FDR<0.05,FC<2),包括编码肉碱O-辛酰基转移酶CROT会影响酰基辅酶A(CoA)从过氧化物酶体到线粒体的转运;酰基辅酶A主要参与脂肪酸β-氧化过程,同时酰基辅酶A产生的产物用于ATP生成;上调的XPA基因在线粒体自噬中发挥重要作用;在第14天与线粒体呼吸链复合物IV组装有关的CMC1的表达增加;上述基因表达的改变表明在补充PA后MS患者代谢增加,长期补充PA后Treg细胞的线粒体呼吸也增加。

小结
本研究首次借助质谱技术对约300名多发性硬化症(MS)患者的PA代谢和其免疫调节能力进行深入研究。MS患者血清和粪便中SCFAs(尤其PA)减少,伴随着Treg细胞数量和功能降低,补充丙酸(PA)可增强Treg细胞功能,逆转Treg细胞/Th17细胞失衡,PA对MS患者的免疫、神经退行性和临床表型(复发率和残疾进展)具有有益影响。体外实验表明PA治疗诱导的功能恢复依赖于抗炎的IL-10,同时相关Treg细胞因子也是关键的中心枢纽基因,补充PA会使Treg细胞线粒体呼吸和线粒体形态恢复正常,可见PA可作为一种有效的免疫调节药物。在MS等免疫发病机制中起关键作用的可能是肠道菌群的失调,SCFAs的减少是肠道微生物群改变的结果。纯化PA补充剂是现有免疫调节药物的一种安全添加物,本研究是第一个显示PA临床效果和直接神经再生效果的研究,连接了肠道代谢组和大脑免疫轴,该回顾性研究结果将为未来的临床II期试验提供坚实基础,不仅可用于MS的辅助治疗,也可用于其他自身免疫性疾病如类风湿关节炎。
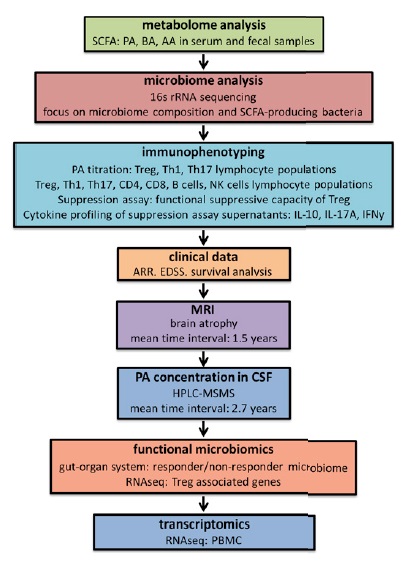
技术路线
参考文献
Alexander Duscha, Ralf Gold, Aiden Haghikia,et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell, 2020.
https://doi.org/10.1016/j.cell.2020.02.035
原文下载,请长按识别下方二维码

精彩推荐
2. 科研 | Nature:乙酸盐通过介导微生物-脑-β细胞轴促进代谢综合征
3. Cirulation | 短链脂肪酸–丙酸盐预防高血压心血管损害
4. GUT | 丁酸盐通过肠-脑神经回路降低食欲并激活棕色脂肪组织
5. Nature Communications | 短链脂肪酸–戊酸盐通过调节淋巴细胞代谢抑制自身免疫
6. SCFAs | 肠道菌群发挥广泛调控作用的“重要武器”–短链脂肪酸
7. Nature子刊 | 短链脂肪酸在微生物-肠-脑通讯中的作用(综述)



