文献解读
Cancer Cell︱支链氨基酸在癌症中的重要作用
代谢重编程对维持癌症细胞异常增殖非常重要,特别是在营养物质有限的情况下。癌症细胞必须调整它们代谢的方式以维持生物量和ATP生成,并维持氧化还原状态,而通过干扰这些过程会改变癌症细胞增殖和癌症生长。因此,了解细胞如何利用和感知营养物质可为干预癌症代谢变化提供依据和改善癌症患者生存状态。目前最大的难点是筛选并确定哪些代谢通路是特定癌症所依赖的。支链氨基酸(Branched-chain amino acids,BCAAs)是一类与特定癌症表型相关的氨基酸。BCAA代谢变化既可影响癌症细胞内在癌症特性,也可反映与某些癌症相关的代谢通路的系统性变化。因此,BCAA既可影响多种癌症表型,又可作为疾病病理标志物。
美国波士顿丹娜法伯癌症研究院(Dana-Farber Cancer Institute)Matthew G. Vander Heiden团队针对支链氨基酸合成与代谢,BCAA代谢的细胞和系统调节,以及BCAA代谢是如何参与癌症进展进行了系统总结,相关成果发表于《Cancer Cell》。
BCAA代谢概述
BCAA包括亮氨酸、异亮氨酸和缬氨酸。作为人体必需氨基酸,BCAAs不能在人体内合成,但它们可被高度可逆的酶分解代谢(图1)。许多作用于这些氨基酸的酶可以利用这三种BCAAs作为底物,从而改变三种BCAAs的水平。因此,BCAA中有一种氨基酸水平发生变化,那么其他两个氨基酸也会出现具有相同方向性和量级水平的变化,这也反映了这些氨基酸相似的化学性质和代谢。
BCAA代谢:BCAAs是一种重要的营养来源。其中亮氨酸是蛋白质中最丰富的氨基酸,也是饮食中蛋白质代谢或组织中蛋白质分解的主要产物。BCAA最终氧化产物因特定氨基酸不同而存在一定差异,此外,只有异亮氨酸和缬氨酸可以提供一碳前体用于葡萄糖或其他以乙酰辅酶(CoA)为前体以外的生物合成。BCAA分解代谢可以满足对癌症细胞生长很重要的几个需求(图1)。首先,BCAA分解为其他生物合成提供碳源。这也使得BCAA氧化为三羧酸(TCA)循环代谢和氧化磷酸化提供能量。其次,它们为核苷酸和氨基酸从头合成提供氮源。再次,BCAA代谢可以改变影响表观基因组的代谢物衍生的辅助因子水平。最后,这些氨基酸可以通过直接作为蛋白质氨基酸或者细胞营养信号影响蛋白质的合成。
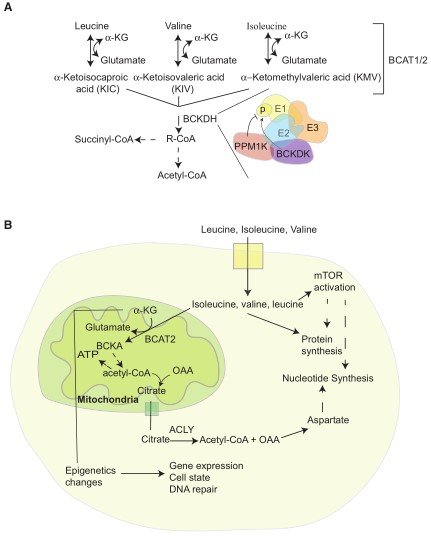
图1 BCAA代谢与信号示意图
BCAA降解:细胞中游离BCAAs可通过氨基转移和转硝基过程与α-酮戊二酸(α-KG)生成谷氨酸及相应支链酮酸(BCKAs,α-酮-β-甲基戊酸[酮异亮氨酸],α-酮异戊酸[酮亮氨酸],α-酮异丁酸[酮缬氨酸])(图1A)。这些反应是由BCAA转氨酶BCAT1和BCAT2催化完成。BCAT1存在于细胞质中,而BCAT2位于线粒体中。BCAT1和BCAT2都是高活性且可逆的酶,可作用于三种BCAAs及相应的BCKAs。因此,BCAT酶可以将谷氨酸中的氮源转移给BCKA再生成BCAA和α-KG。因此,即使在BCAAs净分解代谢程度最小情况下,细胞内BCAAs、BCKAs、谷氨酸和α-KG之间的氮交换也非常迅速,这使得追踪细胞和组织中BCAAs衍生的氮源的方法更加困难。
BCKAs代谢:作为正常生理的一部分,BCKAs存在于血液中进行循环交换并被某些细胞/组织中多聚BCKA脱氢酶激酶复合体(BCKDH)进一步分解代谢。BCKDH包括三个亚基(E1、E2和E3),它们对酶催化能力很重要。E1亚基受BCKA脱氢酶激酶(BCKDK)和蛋白磷酸酶PPM1K调控。BCKDK和PPM1K的相对活性决定E1的磷酸化状态,从而调节BCKDH E2的抑制性磷酸化并影响该通路通量(图1A)。值得注意的是,在哺乳动物细胞中,BCKDH反应本质上是不可逆的,正是哺乳动物体内缺乏相应酶从头合成BCKAs使得BCAAs成为必需氨基酸。
感知营养状况:细胞可以通过感知胞内氨基酸的可用性来协调营养可用性,如核糖体生物合成和蛋白质合成。胞内亮氨酸与Sestrin2相结合而被感知,Sestrin2是哺乳动物雷帕霉素复合物1 (mTORC1)负调节因子,mTORC1是一种蛋白激酶,是细胞生长的重要调节因子。当亮氨酸与Sestrin2结合时,它会破坏Sestrin2与Gator2之间的联系,从而激活该酶,Gator2是mTORC1活性正反馈调节因子。此外,亮氨酸衍生的乙酰辅酶A也可以通过相互作用的Raptor乙酰化正向调节mTORC1。亮氨酸在以mTORC1方式感知氨基酸过程中发挥核心作用,而mTORC1信号也可以影响脂质和核苷酸的合成,为氨基酸感知和其他生物合成代谢提供了联系。尽管亮氨酸在调节mTORC1通路中发挥重要调节作用,但在众多癌症中该通路不恰当激活也被广泛关注,包括营养过剩和营养限制的癌症。
BCAA系统性代谢
机体水平上,BCAA代谢涉及多个组织,且血浆中BCAAs水平可根据饮食摄入和全身蛋白消耗而变化。大多数氨基酸在肝脏中分解代谢,但BCAT在肝脏中不表达,因此BCAAs较为特殊。BCAAs在肠道中被吸收进入血液循环,而饮食中BCAAs水平对血液BCAA水平有直接影响。多余氨基酸包括BCAAs以蛋白质形式进行储存,哺乳动物肝脏和骨骼肌蛋白是氨基酸主要储存库,在机体禁食期间可被获取。BCAAs从蛋白中释放出来后,在包括骨骼肌的许多外周组织中表达BCAT酶进行BCAAs代谢,从而BCKA产生并释放进入循环系统。肝脏是循环系统中BCKA代谢的主要场所,尽管肝脏组织缺乏BCAT表达以启动BCAA分解,但它可以激活BCKDH以获取BCKA碳源进行糖异生、生酮或脂肪酸合成。细胞和组织会对营养可用性做出系统性波动响应,而BCAAs水平以mTOR信号非依赖方式影响机体代谢。BCAAs可以通过调节胰岛素分泌和外周组织对胰岛素的敏感性影响全身葡萄糖代谢,协调机体各组织间氨基酸和碳水化合物的代谢稳态。线粒体Bcat2全身敲除小鼠的代谢特征表明,抑制BCAA代谢和/或过量BCAAs积累会影响蛋白质的转换和葡萄糖稳态。BCAA代谢也受胰岛素水平影响,胰腺正常生理功能紊乱会对骨骼肌BCAA的分解和BCAAs循环水平产生全面影响。
胰腺、大脑和肝脏之间的信号交流也可以调节血浆中BCAA水平。肝脏中BCKDH的表达受脑内胰岛素调控,相关研究认为肥胖和糖尿病伴发的胰岛素抵抗可抑制肝脏BCKA代谢,并可能影响其他组织BCAA代谢。目前尚不清楚机体血浆BCAA水平维持在何种范围内,特别是疾病状态变化时的BCAA水平,这种变化可以通过不同人群中进行检测。同位素示踪技术对BCAA摄取和代谢的全身分析研究表明,组织中BCAA代谢存在特异性差异,因为有些组织可以对BCAA进行快速吸收和转胺作用, 而骨骼肌中则主要进行BCAA氧化。反过来,BCAA对肝脏、胰腺和骨骼肌等组织蛋白质的贡献最高。疾病状态下这些组织的代谢改变也可能是导致与疾病相关BCAA水平变化的原因。
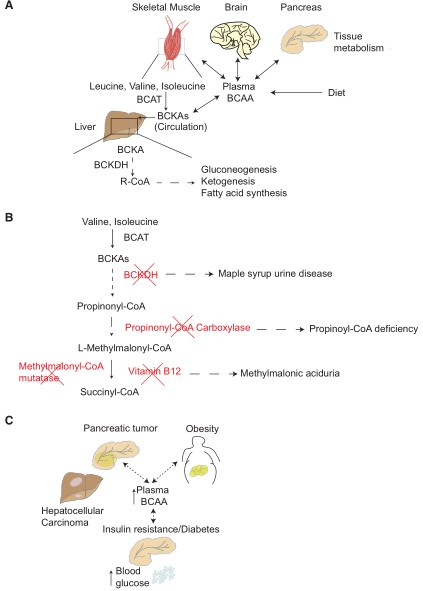
图2 BCAA系统性代谢
BCAA研究应用
BCAA与癌症: 研究发现在许多实体瘤中BCAA代谢通路都存在改变,包括黑色素瘤、鼻咽癌和乳腺癌。黑色素瘤中Ras-MEK致癌性信号激活可以维持mTOR激活,但当亮氨酸缺乏时,Ras-MEK信号过度激活却不能抑制mTOR信号,导致自噬减弱、细胞死亡增强。也有研究发现心脏和骨骼肌中BCAA降解水平升高可以维持线粒体的生物合成。此外研究还发现当胰腺导管腺癌(PDAC)和非小细胞肺癌(NSCLC)的Kras和p53受到相同扰动时,它们对BCAAs却有不同的要求。BCAAs全身性代谢失调可影响癌症的发生和进展,在某些癌症如胰腺癌中更为突出。不过目前还不清楚胰腺癌中血浆BCAA水平的改变是否与胰腺癌有直接关系。在某些动物模型中,补充亮氨酸可以促进胰腺癌生长,但在某些胰腺癌模型中,补充亮氨酸没有作用。这些数据表明,血液中BCAA水平升高并不一定反映了癌细胞对BCAA内在需求,也可能是癌细胞对BCAA的利用导致了外周组织中蛋白质分解释放的BCAA与循环中释放的氨基酸不平衡所致。在小鼠和人类肝细胞癌(HCC)模型中,血液BCAA水平也出现升高,BCAA水平升高与mTOR过度激活相关。有趣的是,在肝部分切除术后的肝再生过程中没有观察到,尽管增殖的肝细胞也激活了与细胞周期进展相关的mTOR信号通路。不同于肝癌,在肝再生过程中增殖的肝细胞并不抑制BCAA分解,提示在肝癌中抑制BCAA分解具有选择性。然而,小鼠口服BCAAs可抑制非酒精性脂肪性肝炎进展,从而预防HCC发生,这强调了BCAAs可对癌症生物学产生不同影响。这也表明,BCAA的调节是相互依赖的,可能在同一组织不同病理和生理环境中发挥不同作用。BCAA分解下游BCAT缺陷会导致BCKAs过量积累。在胶质母细胞瘤中,多余的BCKAs从癌细胞中排出抑制单羧酸转运蛋白1从而影响癌症生长。这表明肿瘤微环境中癌细胞与其他类型细胞之间存在共生关系,例如BCKAs被非癌细胞进一步氧化。
BCAA与遗传疾病:BCAA代谢过程被抑制会引起中间代谢物的毒性积聚。枫糖尿症(MSUD)又称支链酮酸尿症,是一种常染色体隐性遗传病,由编码BCKDH复合体的三个基因(BCKDHA、 BCKDHB、DBT)中的一个基因突变引起,导致BCKAs可用性受损。维生素缺乏也会影响BCAA代谢。缬氨酸和异亮氨酸衍生的甲基丙二酸转化为琥珀酰辅酶A过程中需要钴胺素(维生素B12)。在甲基丙二酸尿等遗传疾病中也可发现钴胺素代谢缺乏。由Mut基因编码的甲基丙二酰辅酶A (MMA-CoA)变位酶催化MMA-CoA转化为琥珀酰辅酶A。在甲基丙二酸尿疾病,Mut突变将导致MMA-CoA积累。类似地,由PCCA和PCCB基因编码的两个亚基组成的丙酰基辅酶A羧化酶(PCC)缺乏也会引起一种罕见病称为丙酸血症。任何一种基因的突变都能导致该酶功能不全,而位于线粒体的PCC可催化丙酰辅酶A转化为MMA-CoA。丙酰基辅酶A水平升高可抑制尿素循环,改变细胞内谷胱甘肽水平。在PCCA或PCCB缺乏症患者中,血浆BCAA水平降低,尤其是随着年龄的增长。然而,目前还不清楚这是否由于饮食中缺乏BCAA造成。
BCAAs与表观遗传:许多组蛋白和DNA修饰依赖于作为辅助因子的代谢底物。代谢物可作为信号辅助因子改变表观基因组,BCAA代谢产物也可以通过这种方式影响基因表达。例如,BCAAs代谢是乙酰辅酶A的来源。乙酰辅酶A是组蛋白乙酰化中乙酰基来源,因此乙酰辅酶A的水平可以影响细胞表观遗传。线粒体中BCAA代谢产生乙酰辅酶A,为了调控表观遗传基因,线粒体乙酰辅酶A必须在胞质内重新获取乙酰辅酶A,而核孔对乙酰辅酶A具有通透性,因此,线粒体外乙酰辅酶A可影响核质乙酰辅酶A,从而用于蛋白质和组蛋白乙酰化。有证据表明,不同细胞依赖不同营养物质来维持乙酰辅酶A水平,但究竟是什么因素决定了BCAAs发挥作用,以及这种作用是如何影响乙酰辅酶A水平的,目前还不完全清楚。也有证据表明,BCAA代谢与表观遗传学存在相互调节作用。如急性髓系白血病(AML),BCAT1高表达并促进疾病进展。由于BCAT1催化氮从BCAAs转移到α-KG,BCAT1活性变化将影响AML细胞中α-KG水平。由于α-KG是多种组蛋白和DNA去甲基化酶(包括TET、JHDM家族去甲基化酶)活性的重要辅助因子,因此,在这种情况下,α-KG水平降低会影响基因的表达。
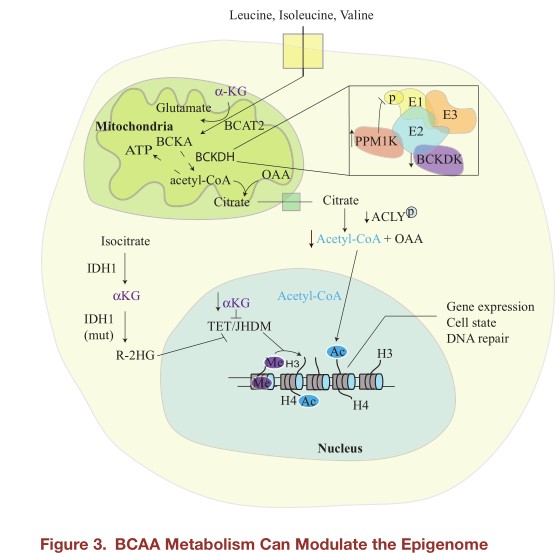
小结
BCAA代谢可影响细胞的不同生物学过程,从蛋白质合成到表观遗传调节。癌症中BCAA代谢失调可能通过影响这些过程从而促进疾病进展。在机体水平上对BCAA代谢的进一步研究可以帮助我们了解不同组织是如何调控对氨基酸的代谢需求,以及这些需求是如何影响癌症生长。此外,确定特定癌症类型中BCAA代谢特征可以更好的指导我们以这些氨基酸以及相关代谢途径为靶点进行干预治疗,或作为疾病状态的标志物进行诊断分型。
参考文献
Sharanya Sivanand , Matthew G. Vander Heiden. Emerging Roles for Branched-ChainAmino Acid Metabolism in Cancer. Cancer Cell 37, February 10, 2020.
原文下载,请长按识别下方二维码

精彩推荐
1. Nature Metabolism | 支链氨基酸间接通过氨基酸平衡和食欲控制影响健康和寿命
2. Science | 解锁–支链氨基酸与疾病的‘对话’机制
3. Cell Metabolism | 支链氨基酸分解代谢的丧失增强mTORC1的活性并促进肿瘤的生长和进程
4. Gastroenterology | 支链氨基酸的增加预警胰腺癌风险



