文献解读
Molecular Cell | 肠道菌群–新型神经元信号调节因子
人类与人体固有的数万亿微生物共同进化,近十几年研究发现,微生物组是宿主生理和行为的关键调节因子,可通过免疫、神经元和代谢途径影响大脑功能和行为。早期研究已将肠道微生物与神经行为表型联系起来并提出了“微生物-肠-脑”轴的概念。有证据表明,某些微生物具有合成和/或调节各种神经化学物质以调节神经传递,也可以合成和/或调节环境中其他代谢物直接或间接影响神经元活动。因此,微生物通过肠-脑轴调节神经元通讯方面的作用具有重要意义。近日,美国加州大学洛杉矶分校K.G. Jameson 团队在《Molecular Cell》上发表见解,从短链脂肪酸、神经递质、尚不明确的代谢物和神经调节药物等几个方面,探讨了微生物与神经元信号传递机制研究进展、问题和方向,为相关研究者提供一定参考(图1)。
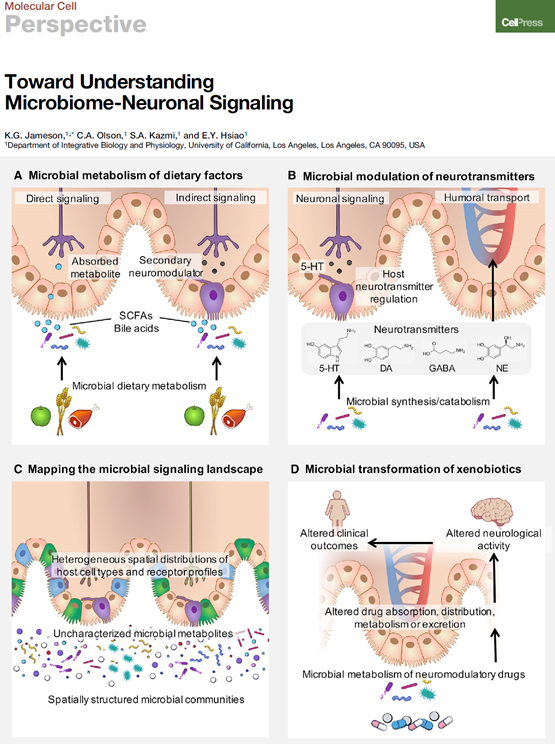
图1 微生物通过调节饮食产品、神经递质、尚不明确的生化物质和神经调节药物与神经系统相互作用
微生物调节短链脂肪酸
早期关于进食行为的研究,为饮食调节肠-脑轴的概念奠定了基础。无菌啮齿动物模型的出现,让人们意识到肠道菌群是饮食代谢和宿主营养之间的重要媒介。无菌动物的肠道和血液中严重缺乏短链脂肪酸(SCFAs)乙酸、丙酸、丁酸和戊酸,表明微生物在调节宿主局部和全身SCFA利用度方面起着重要作用。大量证据表明,菌群和SCFAs的变化与摄食行为失调有关。特别是肥胖小鼠和人,肠道菌群的改变会导致乙酸和丁酸水平改变。另外,补充丙酸可促进肥胖患者肠道激素分泌,减少肥胖倾向和体重增加。SCFA游离脂肪酸受体2和3(FFAR2和FFAR3)可在肠神经系统和门静脉神经以及感觉神经节表达,提示神经系统的激活参与上述生理过程。
SCFAs是调节能量稳态的基本分子,SCFAs受体也可由多种非神经元细胞亚型表达,如在免疫细胞中SCFAs可以调节T调节细胞的分化和小胶质细胞的成熟,而在肠内分泌细胞中,SCFAs可以刺激肠道激素的释放。此外,肠道菌群也是胆汁酸次级代谢的重要组成部分,通过不同类型细胞上的受体调节宿主的不同表型。因此,研究特定神经元途径在SCFA和胆汁酸信号传导中的作用,有助于理解微生物如何通过饮食代谢来调节神经元活动。
微生物调节神经递质
肠道菌群也能调节宿主神经递质的水平。微生物合成神经递质的发现源于20世纪初首次发现化学递质,乙酰胆碱模拟副交感神经的刺激作用,提示化学介导的神经传递,后来发现乙酰胆碱很可能来自麦角菌中的芽孢杆菌污染物。基于此重要发现,其他神经递质如去甲肾上腺素(NE)、5-羟色胺(5-HT)、γ-氨基丁酸(GABA)和多巴胺(DA)陆续被发现可由培养的细菌产生,并受肠道菌群调节。那么神经递质在微生物中的功能作用是什么?宿主相关微生物可以通过神经递质影响神经系统吗?
早期研究表明结构相似的儿茶酚胺类NE和肾上腺素能刺激肠出血性大肠杆菌的运动和毒性。最近,一项利用体外共培养和元基因组数据集的研究揭示了人类肠道产GABA与消耗GABA的细菌,另一项研究发现5-HT促进Turicibacter sanguinis的肠道定殖,同样表明神经递质在促进微生物健康方面的作用。小鼠体内,肠道微生物通过肠上皮的肠嗜铬细胞(ECs)合成结肠和血液中高达60%的5-HT。肠道微生物调节的5-HT激活肌间神经丛的固有传入原代神经元以促进胃肠蠕动。ECs的亚群可能与化学感觉迷走神经或背根神经元的5-HT传入纤维突触,揭示了微生物调节5-HT影响中枢神经系统的直接途径。结肠中重同位素标记的乙酸进入血液,穿过血脑屏障,升高下丘脑乙酸盐,并进入GABA神经胶质循环,以增加中枢GABA的产生。目前,选择性标记微生物产生或调节的目标神经调节因子的新型工具及动物的时空追踪技术将有助于评估微生物调控中枢神经系统远端部位的能力。
其他微生物产物调节神经系统
人体微生物不仅调节肠道代谢物,还可对循环血液和各种器官系统中大量代谢物进行调节。然而,许多微生物调节哪些代谢物、同源受体、信号通路和生理功能仍知之甚少。近年来,功能宏基因组学研究揭示了细菌基因在代谢物合成和向宿主传递信号中的作用。通过筛选黏粒宏基因组文库,研究人员鉴定了宿主相关的细菌效应基因,并对基因产物进行检测最终发现了一种能激活宿主G蛋白偶联受体(GPCR) G2A的N-酰基酰胺,后来又证明了细菌产生的N-酰基丝氨醇激活内源性大麻素受体GPR119A。因此,功能宏基因组学不仅可以发现新的细菌代谢物,还可以通过模拟内源性GPCR配体来揭示细菌代谢物如何影响宿主生理。
有研究发现还有未知细菌产物能够激活许多其他神经系统中表达的神经肽和激素受体。例如,人体微生物分离培养的上清液也能激活神经递质GPCRs。除了组胺,细菌产生的尸胺、腐胺和胍丁胺也能激活组胺受体。含有9,10-亚甲基十六烷酸的细菌上清液激活脑血管生成因子1,而12-甲基十四烷酸激活神经肽受体1。综上,选择性微生物产物可以激活由神经元表达的GPCRs。
微生物与神经疾病药物互作
肠道菌群编码一系列能够代谢药物的酶,从而对药物生物利用度产生潜在影响,导致药效的广泛差异。早期研究发现肠道微生物中细菌β-葡萄糖醛酸酶的葡萄糖醛酸化会促进药物清除。此后,微生物组的外源性物质代谢已扩展到许多针对神经适应症的药物研究中。人类肠道菌群的测序研究和细菌与药物互作的筛选中,许多抗精神病药、抗抑郁药、阿片类药和抗胆碱能药物极大地影响细菌功能,并改变肠道微生物组成。一项结合无菌模型、药理与细菌基因方法的研究揭示了微生物与宿主异源生物的转化。通过比较抗病毒药物Brivudine在无菌小鼠多个组织中的代谢,研究人员建立了一种药代动力学模型来预测微生物对药物代谢特征的贡献,包括口服生物利用度、宿主药物代谢活性、代谢物吸收和肠道转运。
基于DA的宿主代谢机制,最近的一项研究确定了微生物代谢左旋多巴(L-dopa)的新型种间代谢途径,即粪肠球菌将L-dopa脱羧为DA,随后由Eggerthella lenta脱羟基为m-酪胺。编码多巴胺脱羟基酶的细菌基因中单核苷酸多态性可预测某些患者代谢该药物的能力。因此,菌群有望成为潜在的治疗靶点,不仅有助于提高神经系统疾病药物的疗效,还可以作为开发其他个性化药物治疗的手段。
小结
宿主相关的微生物群落的破坏可以改变动物的行为,感觉神经元信号、体液代谢互作和免疫调节可能是介导微生物-神经系统相互作用的纽带,宿主相关的微生物群落正逐渐成为大脑活动和行为的重要调节因子。尽管肠道菌群调节宿主生理的研究已在动物模型中取得可观进展,但如何将研究结果应用到临床仍面临着巨大挑战。通过揭示微生物及微生物产物如何与宿主的感觉神经系统的关联作用将有助于理解动物及其相关微生物群落的共同进化历程。
配套检测方法
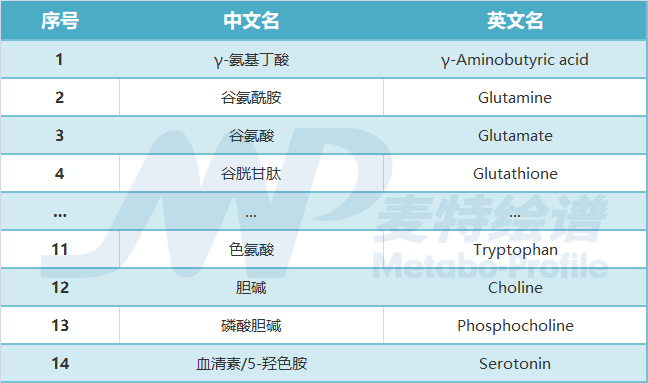
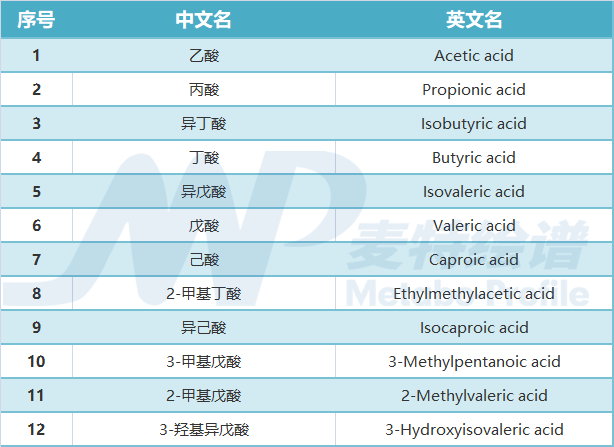
本文涉及的短链脂肪酸、胆汁酸及神经递质等小分子物质,麦特绘谱均可提供全套解决方案!现有DA、5-HT、GABA、NE等神经递质类的绝对定量检测方法,乙酸、丙酸、丁酸、戊酸等短链脂肪酸的绝对定量方法,200+种肠道菌群代谢物绝对定量的宏代谢检测方法,60+种胆汁酸的绝对定量检测方法。
参考文献
Jameson et al., Toward Understanding Microbiome-Neuronal Signaling, Molecular Cell (2020), https://doi.org/10.1016/j.molcel.2020.03.006.
原文下载,请长按识别下方二维码

精彩推荐
1. 贾伟/李后开: “肠道菌-胆汁酸-脑”代谢轴可能参与阿尔茨海默病和肝性脑病的发病机制
2. Cell | ASICs介导肠道5-羟色胺能神经元调控线虫觅食行为
3. SCIENCE ADVANCES | 移植精神分裂症患者菌群诱导小鼠谷氨酸-谷氨酰胺-γ-氨基丁酸代谢异常
4. Nature子刊 | 短链脂肪酸在微生物-肠-脑通讯中的作用(综述)



