文献解读
Cell Metabolism|一种新的阿尔茨海默症治疗策略?
阿尔茨海默病(AD)是一种神经退行性疾病,其中β淀粉样蛋白(Aβ)聚集会导致神经元丢失以及随后的记忆障碍。小胶质细胞,一种大脑固有免疫细胞,监控环境从而维持大脑稳态。AD中,小胶质细胞可对Aβ产生炎症表型反应,并清除这些毒性聚集物。韩国首尔国立大学研究团队发现Aβ急性干预可诱导小胶质细胞激活,该过程中伴随着从氧化磷酸化(OXPHOS)到糖酵解的代谢重编程。然而,长期暴露于Aβ中,小胶质细胞整体代谢出现缺陷。总的来说,代谢重编程对小胶质细胞功能至关重要,调节小胶质细胞代谢可能是AD的一种新的治疗策略。该成果发表在《Cell Metabolism》。(文末有下载原文方式)
Aβ诱导小胶质细胞急性炎症,并伴有OXPHOS到有氧糖酵解的代谢重编程
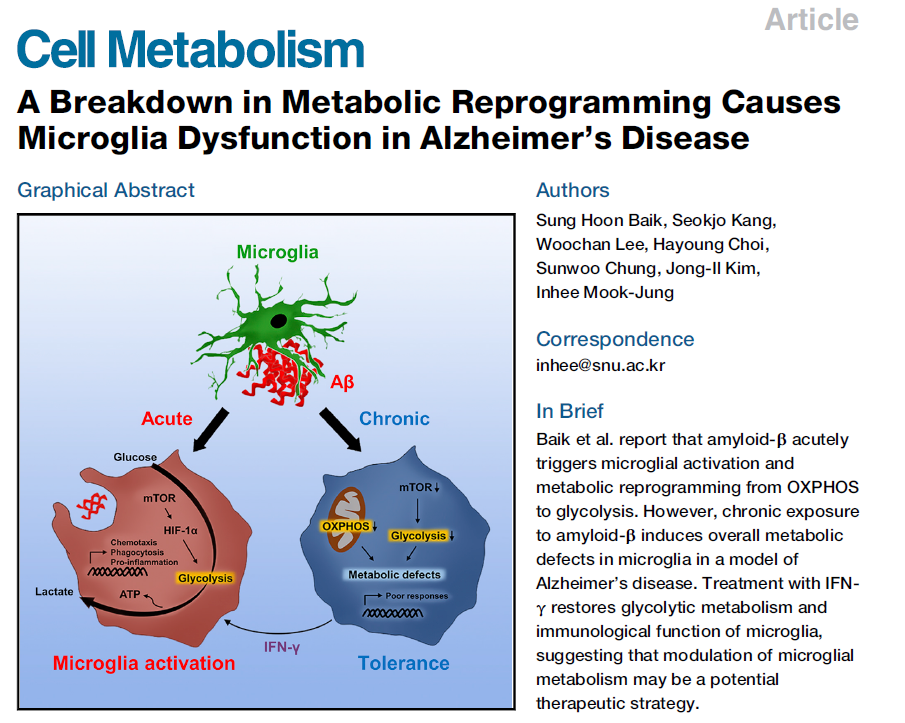
为研究小胶质细胞对Aβ的反应,培养新生小鼠脑组织中原代小胶质细胞(PMG),用不同形式的Aβ处理PMG 24个小时,包括Aβ单体(mAβ)、Aβ寡聚体(oAβ)和纤维型Aβ(fAβ),以大肠杆菌产生的脂多糖(LPS)作为阳性对照。结果显示,所有形式的Aβ均改变了小胶质细胞的形态。Aβ处理的小胶质细胞的吞噬活性比对照组增加一倍。此外,Aβ处理显著增加了促炎细胞因子蛋白(Fig. 1A)和mRNA(Fig. 1B)的表达,其作用与LPS相当,但对抗炎细胞因子水平无影响(Fig. 1B)。这表明,Aβ诱导小胶质细胞急性炎症与免疫反应增强有关,说明Aβ作为危险信号被小胶质细胞识别。
由于免疫细胞的状态可以通过细胞代谢情况进行评价,于是采用实时细胞外通量分析监测PMG在12小时内的代谢动力学。暴露于Aβ 2小时后,小胶质细胞实时细胞外酸化率(ECAR)(一种糖酵解测定方法)急剧上升达到平衡期并维持10小时,表明糖酵解代谢发生了根本转变(Fig. 1C)。通过测定糖酵解主要副产物乳酸的水平,进一步证实了Aβ诱导的小胶质细胞糖酵解水平增加(Fig. 1D)。与对照组相比,Aβ处理组小胶质细胞线粒体的最大呼吸能力显著降低(Fig. 1E)。活细胞成像结果也表明,在炎性免疫细胞(如小胶质细胞)中Aβ会导致线粒体分裂(Figure 1F),并参与破坏电子传递链。因此,在Aβ诱导的炎症激活过程中,小胶质细胞的代谢从OXPHOS转变为有氧糖酵解(Warburg效应)。
炎症细胞因子IL-1β在Aβ处理后2小时出现并逐渐增加,而此时糖酵解达到峰值(Fig. 1G),由此,研究人员假设糖酵解是启动和维持小胶质细胞炎症所必需的。为了验证这一点,用2-脱氧-D -葡萄糖(2-DG,一种抑制糖酵解的葡萄糖类似物)处理暴露于Aβ的PMG。结果显示,炎症细胞因子IL-1β和TNF-α在Aβ + 2-DG处理的细胞中表达水平明显低于仅Aβ处理的细胞(Figure 1H)。综上所述,Aβ可促进有氧糖酵解和炎症细胞因子的释放,同时抑制了与线粒体形态改变相关的OXPHOS,表明有氧糖酵解的代谢重编程是调节Aβ诱导的小胶质细胞炎症激活的关键过程。
Aβ诱导的糖酵解和炎症依赖于mTOR-HIF-1α通路
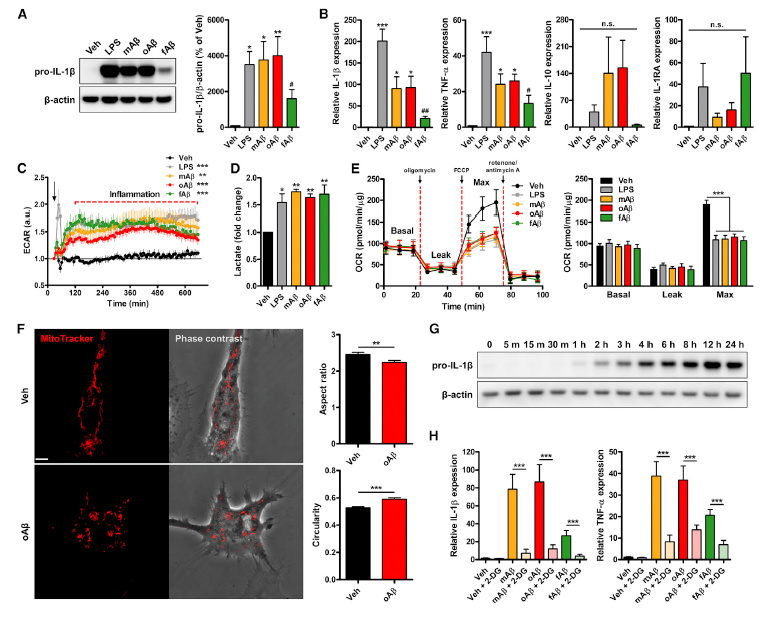
mTOR通路调节葡萄糖代谢作为感知细胞能量状态的部分机制。那么,mTOR通路是否参与了Aβ诱导的代谢重编程呢?研究人员对Aβ处理后PMG中AKT-mTOR-HIF-1α和AMPK-mTOR-HIF- 1α通路的状态进行检测分析。免疫印迹分析结果显示,Aβ诱导AKT磷酸化和AMPK去磷酸化,进而引发mTOR磷酸化(Fig. 2A),以及mTORC1下游的p70S6K和4E-BP1磷酸化。值得注意的是,Aβ显著提高HIF-1α的表达,其水平与LPS组相当(Fig. 2A)。这些结果表明,暴露于Aβ的小胶质细胞中促进糖酵解的mTOR-HIF-1α通路上调。此外,雷帕霉素(mTOR变构抑制剂)或二甲双胍(AMPK激活剂和mTOR抑制剂)可抑制mTOR通路,降低Aβ诱导的促炎细胞因子IL-1β和TNF-α的表达(Fig. 2B)。因此,Aβ诱导的小胶质细胞炎症依赖于mTOR通路。
Aβ可诱导小胶质细胞先天免疫耐受和代谢缺陷
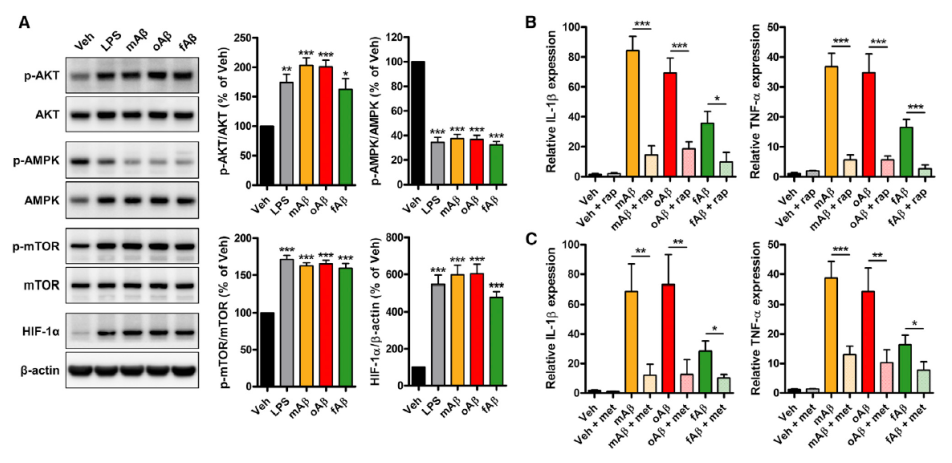
由于AD是一种慢性疾病,因此还需进一步考察Aβ对小胶质细胞激活过程的长期作用。oAβ或对照刺激PMG 24小时后,洗净药物继续培养3-5天,然后再用oAβ或对照刺激24小时。实验分为三组:Veh、急性组和慢性组。结果显示,慢性组促炎细胞因子IL-1β和TNF-α的mRNA和蛋白水平低于急性组,甚至与未受处理组水平相当,而慢性组抗炎细胞因子IL-10和IL-1RA的表达未受影响(Fig. 3A 和3B)。而且,慢性组小胶质细胞的吞噬活性显著降低(Fig. 3C),表明Aβ最终会诱导小胶质细胞出现先天免疫耐受性。诱导小胶质细胞急性炎症的AKT-mTOR- HIF-1α通路在慢性组中下调(Fig. 3D),最终导致乳酸产量下降到与未处理组相当的水平(Fig. 3E),说明糖酵解代谢出现缺陷。与急性组一样, Aβ耐受的小胶质细胞仍存在线粒体功能障碍(Fig. 3F)。此外,长期暴露于Aβ会轻微增加小胶质细胞坏死,但不会导致细胞凋亡。综上所述,Aβ耐受的小胶质细胞存在包括糖酵解和OXPHOS在内的细胞代谢缺陷,并导致小胶质细胞功能受损。
体内实验证实Aβ诱导急性炎症和耐受性
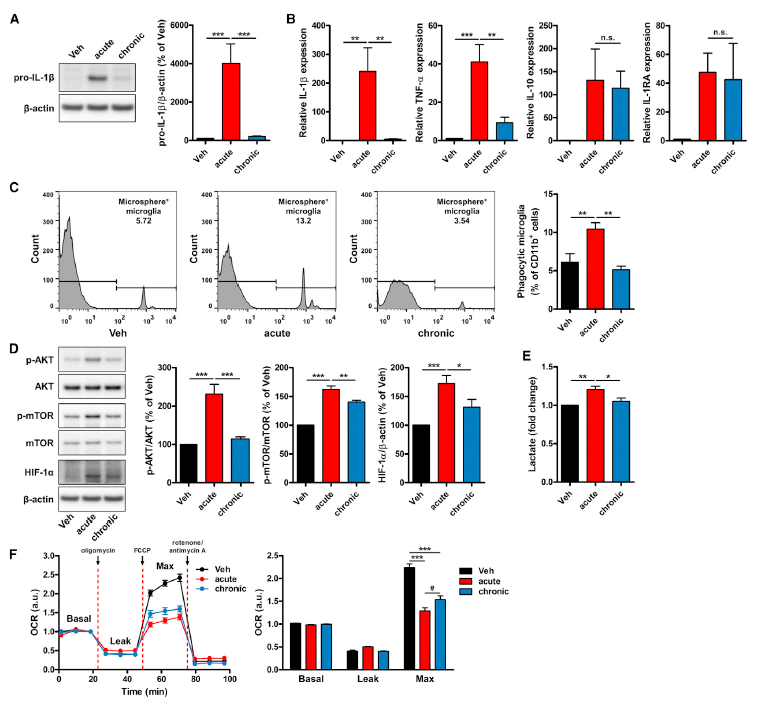
为研究小胶质细胞在体内对Aβ有何反应,研究人员对7.5个月野生型小鼠(WT)进行脑室内(ICV)注射PBS或oAβ,24小时后分离小胶质细胞并进行全基因组RNA测序(RNA-seq)。结果显示,与PBS处理的WT小鼠(WT + PBS)相比,Aβ处理的WT小鼠(WT + Aβ)的小胶质细胞中上调基因373个,下调基因72个(Fig. 4A)。上调基因富集出169条生物过程(BP),KEGG通路16条,而下调基因中没有。前15条BPs(Fig. 4A)和KEGG通路(图S4B)均与“炎症”和“免疫功能”有关。因此,体内急性暴露Aβ可诱导小胶质细胞炎症,增强免疫反应。
那么,7.5月龄5XFAD小鼠(AD转基因小鼠模型)大脑中的小胶质细胞对Aβ会有什么反应呢?研究发现,与PBS处理(5XFAD+PBS)相比,Aβ处理的5XFAD(5XFAD+Aβ)小鼠大脑中小胶质细胞中有187个上调基因和104个下调基因(Fig. 4B),并在上调基因中发现46条显著富集的BPs和12条KEGG通路。虽然5XFAD+Aβ小鼠中BPs与WT + Aβ小鼠有一定的重叠,但BPs的种类及其相关性是大大降低的(Fig. 4B)。经Aβ处理后,WT与5XFAD小鼠的前20个富集的BPs具有明显的差异(Fig. 4C)。与此同时, BPs的全基因组转录谱(“炎症反应”、“先天免疫反应”、“细胞因子反应”、“细胞趋化”和“免疫系统调节”;Fig. 4D),以及与炎症反应相关基因(Il1b、Tnf、Tlr4、Ccl7、Ccl2和Cxcl2;Fig. 4E)表明,与WT小鼠相比,5XFAD小鼠大脑中的小胶质细胞几乎不被激活,对Aβ的反应也较弱。
在WT和5XFAD小鼠中,Aβ对小胶质细胞基因的调控有何差异?结果显示,与5XFAD +Aβ小鼠相比,WT +Aβ小鼠的小胶质细胞中上调更显著的基因富集出785条BPs和52条KEGG通路。在前20个BPs中,“细胞代谢过程”、“初级代谢过程”、“有机物代谢过程”和“生物合成过程”,包括“碳水化合物代谢过程”、“碳水化合物衍生物的生物合成过程”最为显著(Fig. 4F)。此外,与“炎症”和“免疫功能”相关的基因本体论(GO)分类排在前20个BPs(Fig. 4F),并在KEGG通路中显著富集。综上所述,在代谢和免疫上,WT小鼠的小胶质细胞比5XFAD小鼠更易被Aβ激活,并且与WT小鼠相比,7.5月龄的5XFAD小鼠大脑中的小胶质细胞具有Aβ耐受性和代谢缺陷。
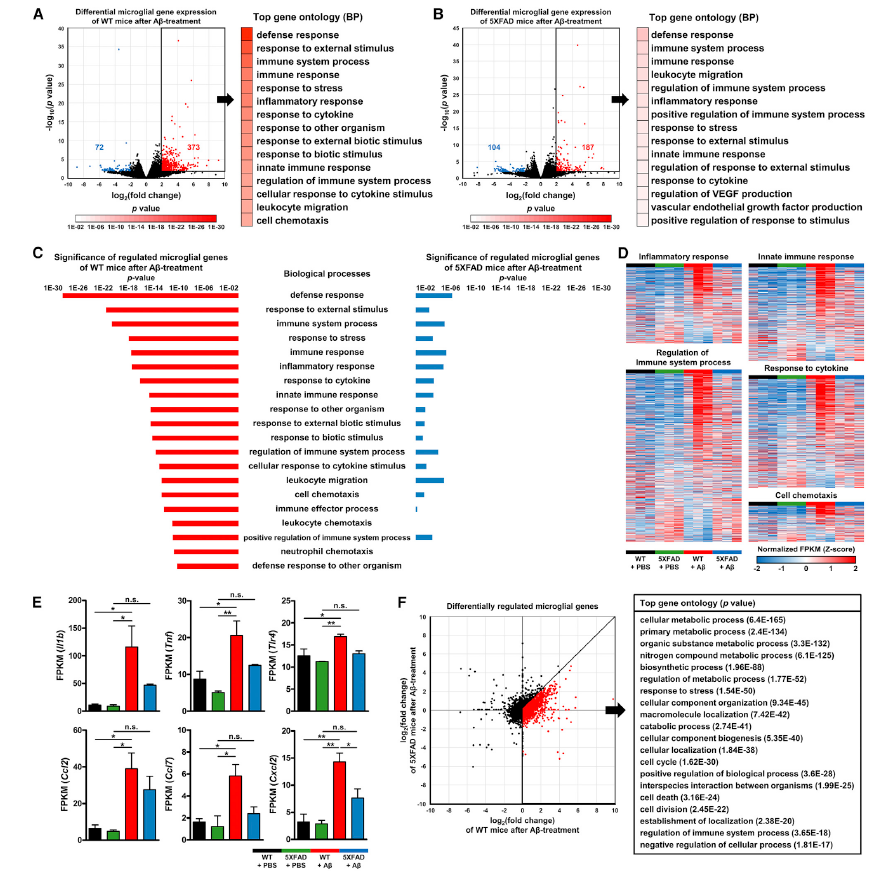
体内小胶质细胞的反应依赖于糖酵解代谢,AD转基因小鼠模型中存在缺陷
有研究表明,小胶质细胞在激光消融后迅速向损伤部位募集,因此,研究人员对小胶质细胞特异性表达绿色荧光蛋白(GFP)的Cx3cr1gfp/+小鼠进行了活体多光子显微镜(IV-MPM)延时脑成像。结果显示,消融后小胶质细胞立即向损伤部位扩展,这个过程在60分钟内达到了顶峰(Fig. 5A,PBS处理的对照小鼠)。小胶质细胞的这种反应是一种即时的、快速的免疫反应,但需要产能的突然激增,因此假设这种反应依赖于糖酵解。为了验证这一点,对Cx3cr1gfp/+小鼠全身注射2-DG阻断糖酵解后的小胶质细胞反应进行分析。有趣的是,2-DG阻断糖酵解后并不能消除小胶质细胞的运动稳态,而向损伤部位趋化的过程则明显减缓(Fig. 5A,2-DG处理的小鼠)。
采用相同的激光消融方法, ICV注射PBS或oAβ 24小时后,分析Cx3cr1gfp/+小鼠小胶质细胞运动过程。注射oAβ的小鼠中,损伤部位的募集过程明显稍微快一些(Fig. 5B)。6-8个月大的5XFAD/Cx3cr1gfp/+小鼠的小胶质细胞对激光诱导损伤的反应结果显示,AD转基因小鼠的小胶质细胞反应活性显著降低(Fig. 5C)。综上所述,AD转基因小鼠体内长期接触Aβ,会导致小胶质细胞对体内损伤的反应降低。研究人员推测,小胶质细胞功能损害可能是由Aβ诱导的代谢缺陷引起的。值得注意的是,在小胶质细胞运动过程中起着关键作用的嘌呤受体P2Y12在斑块相关的小胶质细胞中是下调的。而Aβ处理组和5XFAD组小鼠的小胶质细胞P2ry12的表达均未显著下降,Aβ处理的小鼠的小胶质细胞过程的募集速度要快于对照组小鼠。这些结果表明体内小胶质细胞反应是由糖酵解代谢驱动。
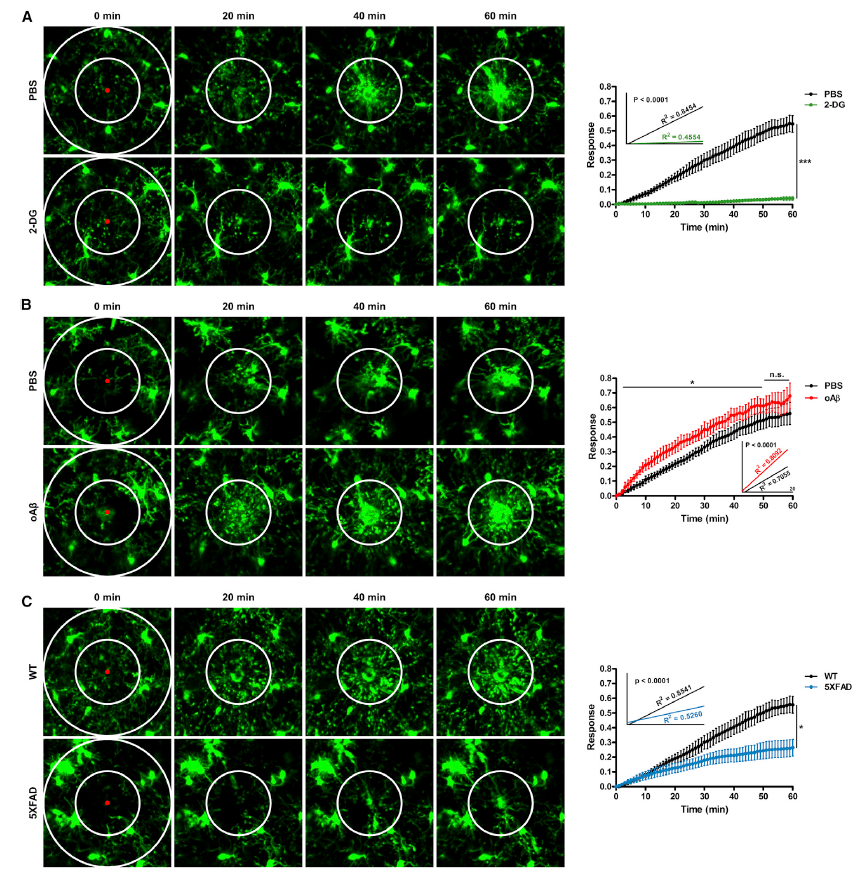
IFN-γ可以修复受损的细胞代谢、mTOR信号传导以及Aβ耐受的小胶质细胞的免疫功能
AD中的小胶质细胞因代谢障碍而功能失调,那么代谢增强是否可以挽救AD中受损的小胶质细胞功能?研究人员用IFN-γ(一种炎症细胞因子,能激活mTOR通路,促进先天免疫细胞的糖酵解代谢)处理小胶质细胞。结果显示,重组IFN-γ使oAβ诱导的小胶质细胞最大糖酵解能力增加一倍。大脑中编码IFN-γ受体的Ifngr1和Ifngr2基因在小胶质细胞中表达程度远高于其他类型细胞。有趣的是,AD转基因小鼠模型大脑中细胞因子IFN-γ的水平很低。因此,IFN-γ被认为是一种具有治疗AD潜力的“代谢促进”药物。那么IFN-γ促进Aβ耐受小胶质细胞代谢能否挽救受损的小胶质细胞功能呢?研究显示,与对照处理耐受PMG相比,IFN-γ处理可提高AKT-mTOR磷酸化水平和HIF-1α表达(Fig. 6A),从而改善受损的糖酵解代谢(Fig. 6B),随后炎症反应增强(Fig. 6C和6D)。IFN-γ注射全身是否也会影响5XFAD小鼠的小胶质细胞过程运动?6-8个月龄5XFAD/Cx3cr1gfp/+小鼠IV-MPM成像显示,IFN-γ诱导的代谢增强可以挽救激光损伤引起的受损小胶质细胞反应(Fig. 6E)。综上所述,重组IFN-γ处理Aβ耐受小胶质细胞,可促进受损的mTOR-HIF-1α通路和糖酵解代谢,恢复免疫反应包括促炎细胞因子的分泌、吞噬活性和体内趋化。
慢性IFN-γ干预可增强AD转基因小鼠的小胶质细胞功能减轻AD病症
AD小鼠模型中IFN-γ慢性干预有何作用?首先,利用IV-MPM成像技术对5XFAD/Cx3cr1gfp/+小鼠(6月龄)全身注射IFN-γ前后的大脑小胶质细胞和Aβ斑块进行监测。研究发现,IFN-γ干预增加了小胶质细胞对Aβ斑块的激活和募集,Aβ斑块周围小胶质细胞体积增加(Fig. 7A)。然后,对5XFAD小鼠(4.5 ~ 7.5月龄)进行长期(3个月)IFN-γ干预,并对处死后的脑组织进行分析。研究表明,IFN-γ比PBS组更能使5XFAD小鼠的小胶质细胞募集到Aβ斑块(Fig. 7B的箭头和7C)。值得注意的是,IFN-γ干预组所有小胶质细胞都含有较高数量的胞内Aβ(Fig. 7B的白箭头和7D),其中CD68+吞噬溶酶体增加,表明细胞变得更有活性和吞噬性。因此,在IFN-γ组中,小胶质细胞吸收的Aβ总量明显大于PBS组小鼠(Fig. 7E),小鼠Aβ斑块负担降低(Fig. 7F)。脑组织免疫印迹分析显示,IFN-γ处理引起的Aβ斑块减少与Iba-1升高有关,这说明小胶质细胞增生增强,但不能反映出APP或PS1表达改变(Fig. 7G)。小胶质细胞通过覆盖Aβ斑块来保护神经元免受Aβ诱导的神经毒性。研究发现,IFN-γ处理后Aβ斑块的小胶质细胞覆盖率增加。此外,在IFN-γ处理的小鼠中,突触素表达增加的趋势不明显(Fig. 7G;p = 0.0843),而神经元密度显著增加(Fig. 7H)。IFN-γ处理后,5XFAD小鼠认知功能的受损得到了恢复(Fig. 7I),说明促进体内代谢可通过增强小胶质细胞功能逆转AD病症。

小结
这项研究证明了代谢重编程是Aβ诱导小胶质细胞炎症的基础,Aβ耐受的小胶质细胞在5XFAD小鼠模型中表现出代谢功能障碍。研究人员证实,直接调节细胞代谢对小胶质细胞的表型变化有两个方面的影响:激活和失活,即抑制mTOR通路和糖酵解可显著降低Aβ诱导的小胶质细胞炎症反应,而用IFN-γ促进糖酵解代谢则恢复了小胶质细胞的运动,增加Aβ的吞噬作用。该研究揭示了细胞代谢通路与小胶质细胞功能表型之间的密切关系,但为了更好地理解大脑病理过程中小胶质细胞的代谢功能障碍,还需要进一步的研究。而对小胶质细胞生物能量通路的调控,可能是阿尔兹海默症和其他神经退行性疾病有前景的一种治疗策略。
参考文献
Baik et al., A Breakdown in Metabolic Reprogramming Causes Microglia Dysfunction in Alzheimer’s Disease, Cell Metabolism (2019), https://doi.org/10.1016/j.cmet.2019.06.005.
原文下载,请长按识别下方二维码

精彩回顾
2. Nature最新成果:质谱联用技术在阿尔兹海默症中的新突破



