文献解读
Nature Communication | 肠道菌群代谢物–苯基硫酸盐促进糖尿病肾病蛋白尿
糖尿病肾病(Diabetic kidney disease,DKD)是糖尿病常见并发症之一,是病人终末期肾病、心血管事件和死亡的主要原因,仅根据肾小球滤过率和蛋白尿很难鉴别哪些糖尿病病人是DKD高危的人群。因此,迫切需要寻找可在糖尿病早期鉴别DKD高风险人群的生物标志物。在肾脏中,有机阴离子转运多肽(OATP)家族负责转运阴离子和阳离子到尿液中,而SLCO4C1是人类肾脏中唯一的OATP成员。来自日本东北大学的Takaaki Abe研究团队等采用SLCO4C1过表达转基因大鼠,结合非靶向代谢组学技术发现肠道微生物来源的苯基硫酸盐(phenyl sulfate,PS)和蛋白尿存在显著相关性,抑制PS的产生可以减少糖尿病小鼠的蛋白尿。相关成果发表于国际知名期刊《Nature Communication》。
SLCO4C1-Tg糖尿病大鼠蛋白尿减少
作者在第0天采用链脲佐菌素(STZ)在SLCO4C1转基因大鼠(SLCO4C1-Tg)上诱导糖尿病模型。7天后,筛选血糖在300mg/dl以上的大鼠用于后续分析。WT对照组和SLCO4C1-Tg组的饮食摄入及体重是相似的(图1a)。给予STZ后血糖升高,造模期间两组血糖也较为类似,但第90天除外。两组间的肾功能也没有差异,但Tg组的蛋白尿在第7,30和63天显著低于WT组(图1a)。组织学分析显示WT组肾小球明显肿大,而Tg组相对减轻(图1b)。以上数据表明,肾脏过表达SLCO4C1可减少蛋白尿,而组织学没有太大改变。
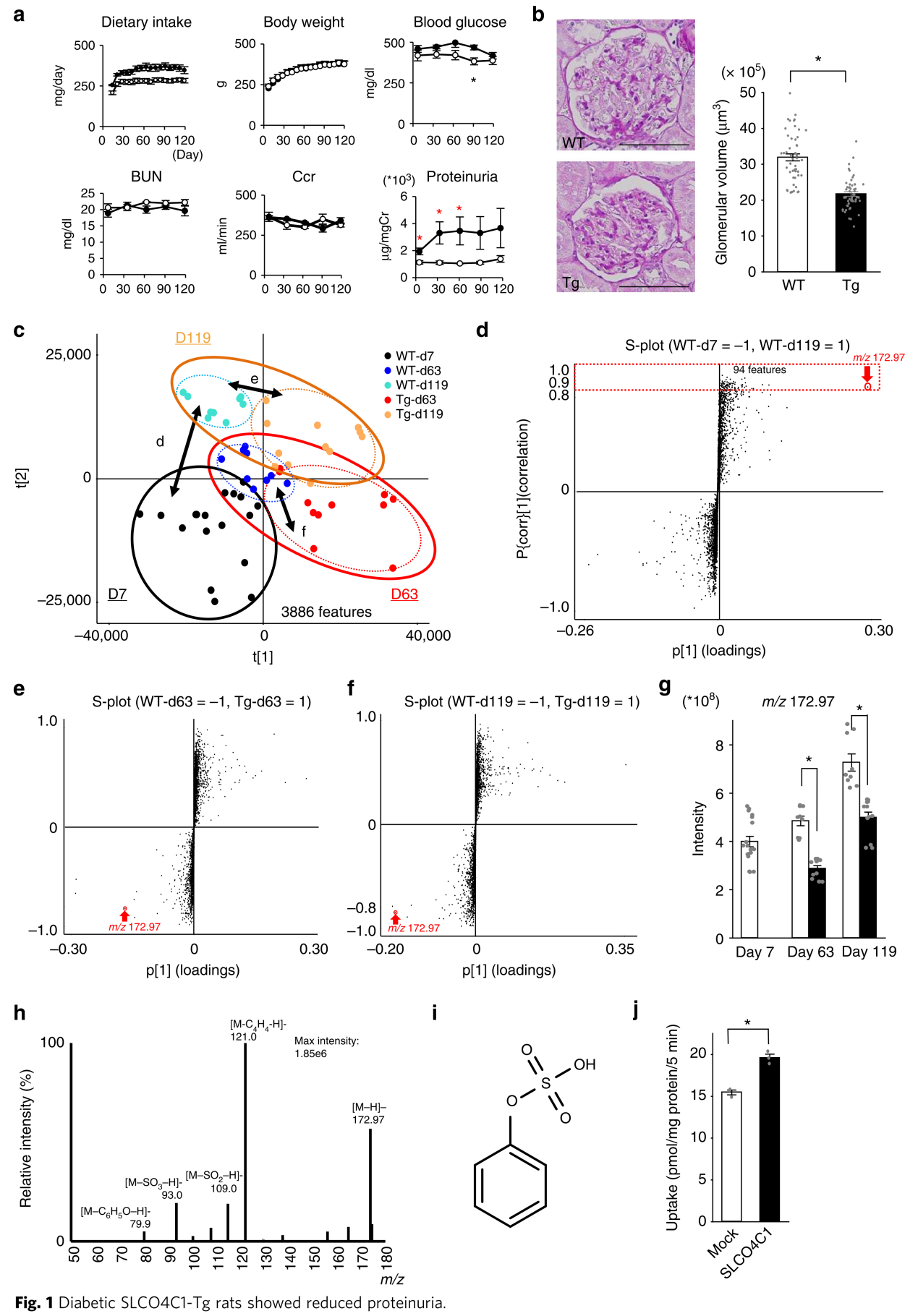
非靶向代谢组学发现PS是导致DKD蛋白尿的可能毒素
SLCO4C1是负责清除代谢物到尿液的转运子,因此作者推断SLCO4C1特异的配体排泄到尿液中,从而引起蛋白尿水平降低。作者接下来对两组的血浆进行了非靶向代谢组学分析。PLS-DA模型显示两组不同时间点以及WT和Tg组间均有明显的分离(图1c)。OPLS-DA模型被用于筛选两组间最稳健的差异代谢物。作者对比了WT组大鼠第7天(WT-d7)和第119天(WT-d119)血浆代谢组的差异,以反映糖尿病病程进展的变化。S-plot显示94个代谢特征在WT-d119组中显著增加(图1d)。在这些特征中,质荷比为172.97的代谢物对OPLS-DA模型有着明显强于其他特征的贡献(VIP=5.4)。后续分析表明该特征是唯一随着糖尿病的发展而增加,且在Tg组中降低的特征(图1e-g)。作者进一步利用Chemspider数据库、MS/MS二级质谱和标准品确定了该特征为PS(图1h,i)。
为了确认PS是否是SLCO4C1的配体,作者利用表达SLCO4C1的MDCK细胞和人近端管状HK2细胞进行了PS摄取试验,证实PS是SLCO4C1转运子的配体(图1J)。由此发现,PS随着糖尿病的进展而增加, 肾脏SLCO4C1过表达可降低蛋白尿和PS积累。
PS通过损伤足细胞诱导蛋白尿
为了确认PS是否在蛋白尿和糖尿病肾损害进展中起致病作用,作者对db/db小鼠口服给予50mg/Kg PS。6周后,血浆PS水平显著增加5倍(图2a)。由于PS是肠源的尿毒症毒素,作者也测定了其他肠源毒素的水平(对甲酚硫酸盐PCS、吲哚酚硫酸盐IS和TMAO),发现没有显著差异(图2a)。PS处理6周后,蛋白尿显著增加(图2b)。
由于足细胞损伤是引起蛋白尿的原因,作者进一步关注PS对足细胞的影响。电镜显示PS处理致足细胞足突消失增加,肾小球基底膜增厚(图2c)。作者又用分化的人尿足细胞样上皮细胞(HUPECs)验证PS对足细胞的毒性作用。PS浓度达到30μM时开始有毒性,而在100μM以后出现显著的细胞毒性(图2d)。已有报道表明PS可降低谷胱甘肽水平,致使细胞易受氧化应激的损伤。确实,100μm PS处理分化足细胞后,谷胱甘肽水平显著降低(图2e)。由于足细胞线粒体功能障碍和DKD发病机制相关,作者检查了PS对足细胞生物能量的影响。PS显著降低了线粒体基础呼吸、ATP生产、质子泄漏和最大呼吸能量(图2f),表明PS具有线粒体毒性。
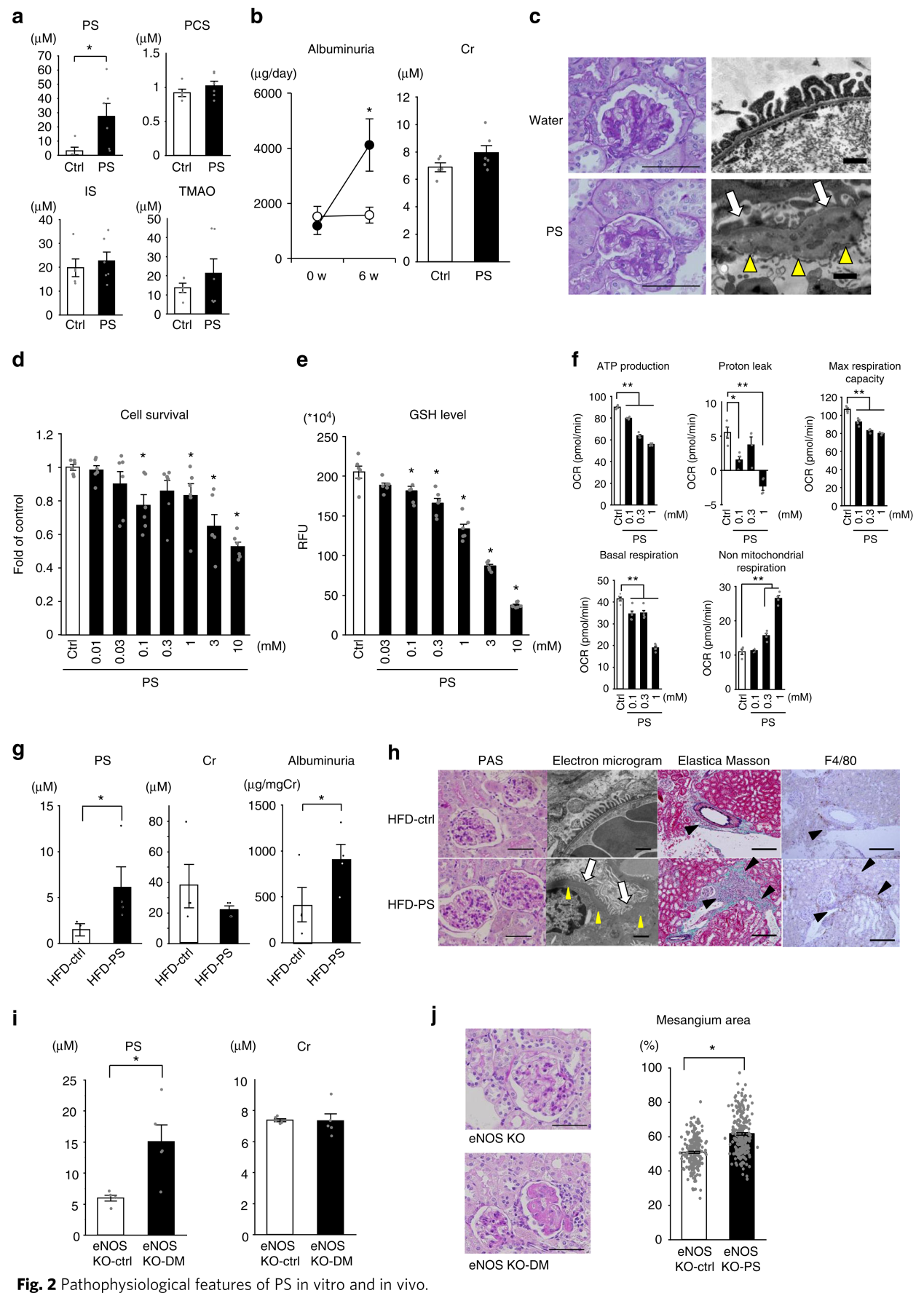
除了db/db小鼠模型,作者还在高脂饮食KKAy小鼠模型上验证了PS在糖尿病肾病中的作用。同样的,50mg/kg PS处理6周后,血浆PS水平和蛋白尿显著增加(图2g)。电子显微镜显示足细胞足突消失,肾小球基底膜增厚(图2h)。作者进一步测试了可模拟人类DKD的内皮型一氧化氮合酶缺失糖尿病小鼠模型(eNOS-KO)。该模型小鼠的血糖水平可在6个月后达460mg/dl。相比于eNOS-KO小鼠,eNOS-KO糖尿病小鼠蛋白尿和血浆PS水平显著增加(图2i),而肾功能都正常。组织学检查表明eNOS-KO糖尿病小鼠肾小球明显硬化(图2j)。以上数据表明,更高水平的PS会引起更严重的肾小球损伤。
PS是DKD患者早期蛋白尿的预测因子
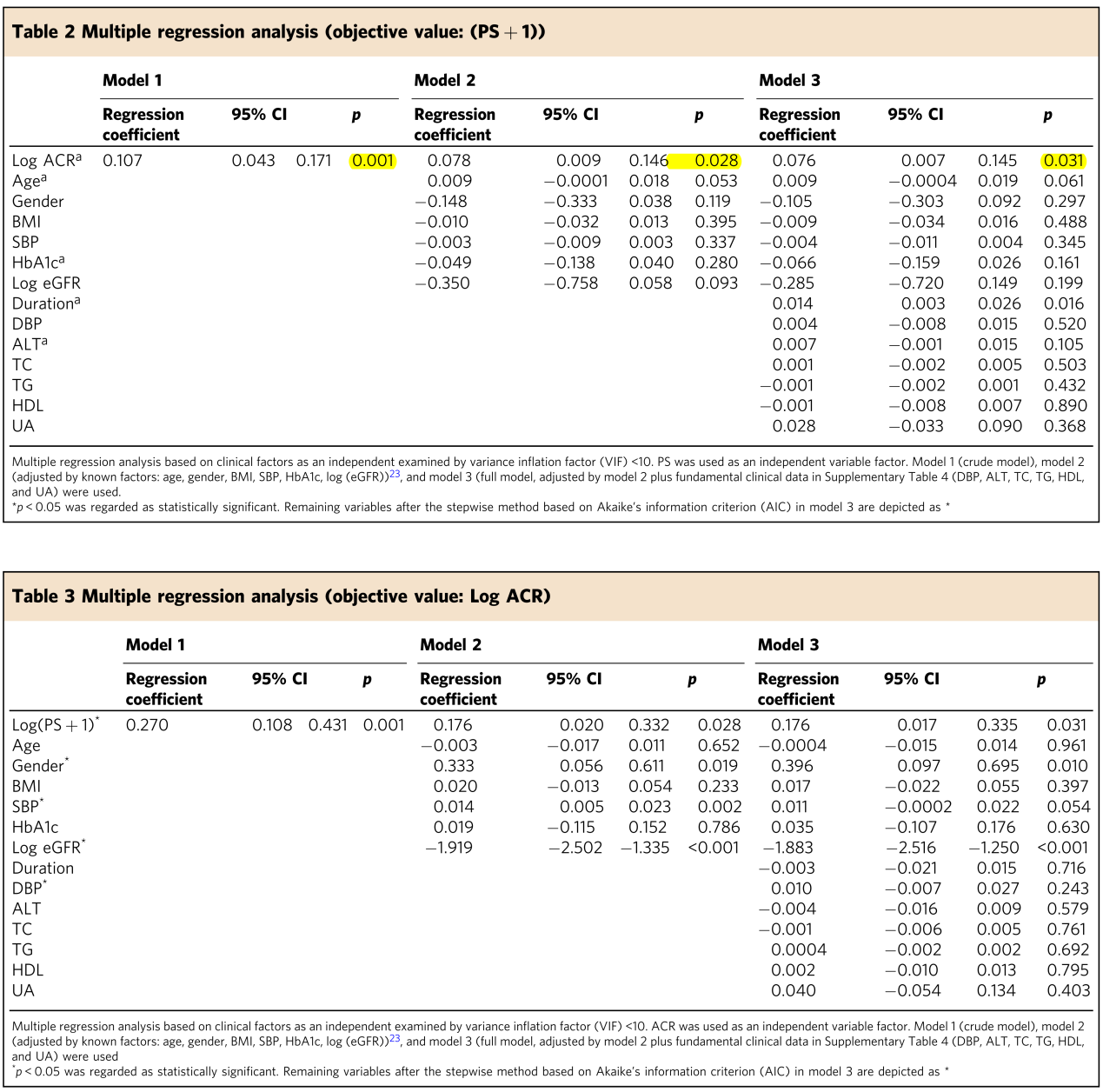
动物模型研究之外,作者又分析了362例糖尿病人群数据。血浆PS水平分布如图3a所示。Spearman相关分析显示PS和蛋白尿/肌酐(ACR)及估计的肾小球滤过率(eGFR)显著相关,与可溶性尿激酶型纤溶酶原激活受体(suPAR,已知和DKD发病及进展有关)无显著相关性(图3b-d)。接下来,作者采用多元回归分析,构建了3种模型:原始模型、已知影响因子矫正的模型(矫正因子:age, gender, BMI, SBP, HbA1c, log (eGFR))和所有临床指标矫正的模型。分析显示,ACR是唯一在三种模型中都和PS显著相关的因子(表2)。反过来,将ACR作为目标变量时,PC在三种模型中都和ACR显著相关(表3)。
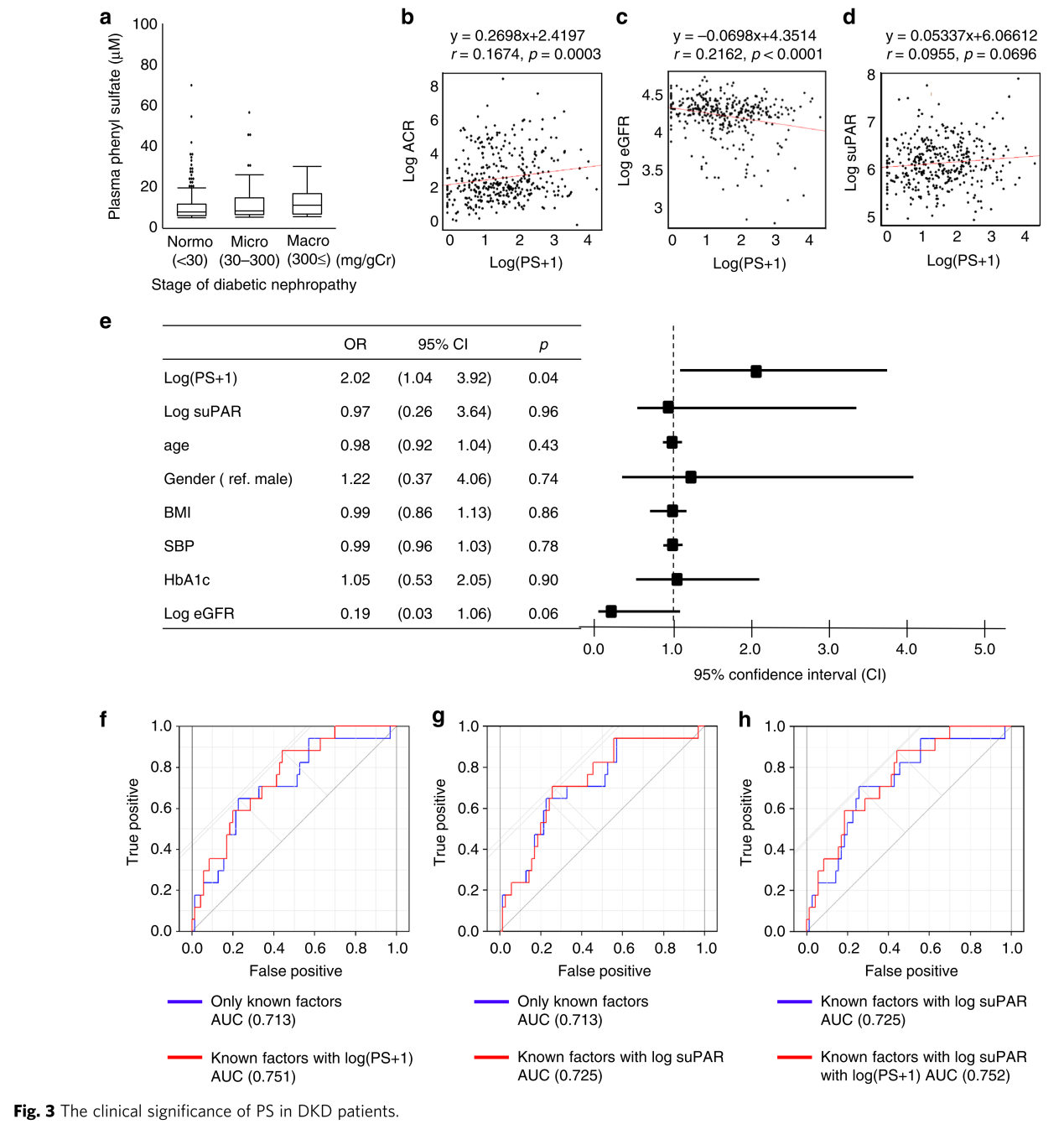
基于疾病的分期,作者进行了分层逻辑分析。由于大量蛋白尿患者较少,作者只分析了无蛋白尿和微量蛋白尿患者。在无蛋白尿组,PS和2年ACR变化量不相关,而在微量蛋白尿组,PS是所有3个模型中与2年ACR变化量相关的唯一因素,模型2中的优势比为2.02 (CI:1.04–3.92)(图3e)。然而,suPAR在两组中都不相关。ROC分析也显示只用已知因子时的c统计量为0.713,而结合PS可提高至0.751(图3f)。结合suPAR或者结合suPAR和PS分别提高c统计量至0.725和0.752(图3g,h)。综上,PS和ACR相关,且可预测DKD患者2年ACR恶化程度。
抑制PS微生物合成途径具有肾脏保护作用
PS的产生需要肠道菌群的参与,菌群独有的酪氨酸酚裂解酶(tyrosine phenol-lyase,TPL)将饮食中的酪氨酸转变为苯酚,后者在宿主肝脏中进一步代谢为PS(图4a)。TPL仅在少数肠杆菌科中表达,真核生物中没有此酶。因此,抑制TPL可能降低血浆PS水平,且无任何宿主毒性。作者考察了两种TPL抑制剂2-重氮酪氨酸和L-间酪氨酸对血浆PS、蛋白尿和肾功能的影响。口服给予db/db小鼠2-重氮酪氨酸一周(10mg/kg/天),血浆PS、IS和PCS显著降低(图4b)。两周后,随着糖尿病进展而增加的蛋白尿可被2-重氮酪氨酸回调(图4c)。类似的,L-间酪氨酸也可降低血浆PS和IS。这些数据表明TPL抑制剂2-重氮酪氨酸可减少蛋白尿、PS和IS水平,因而对糖尿病小鼠具有肾脏保护作用。
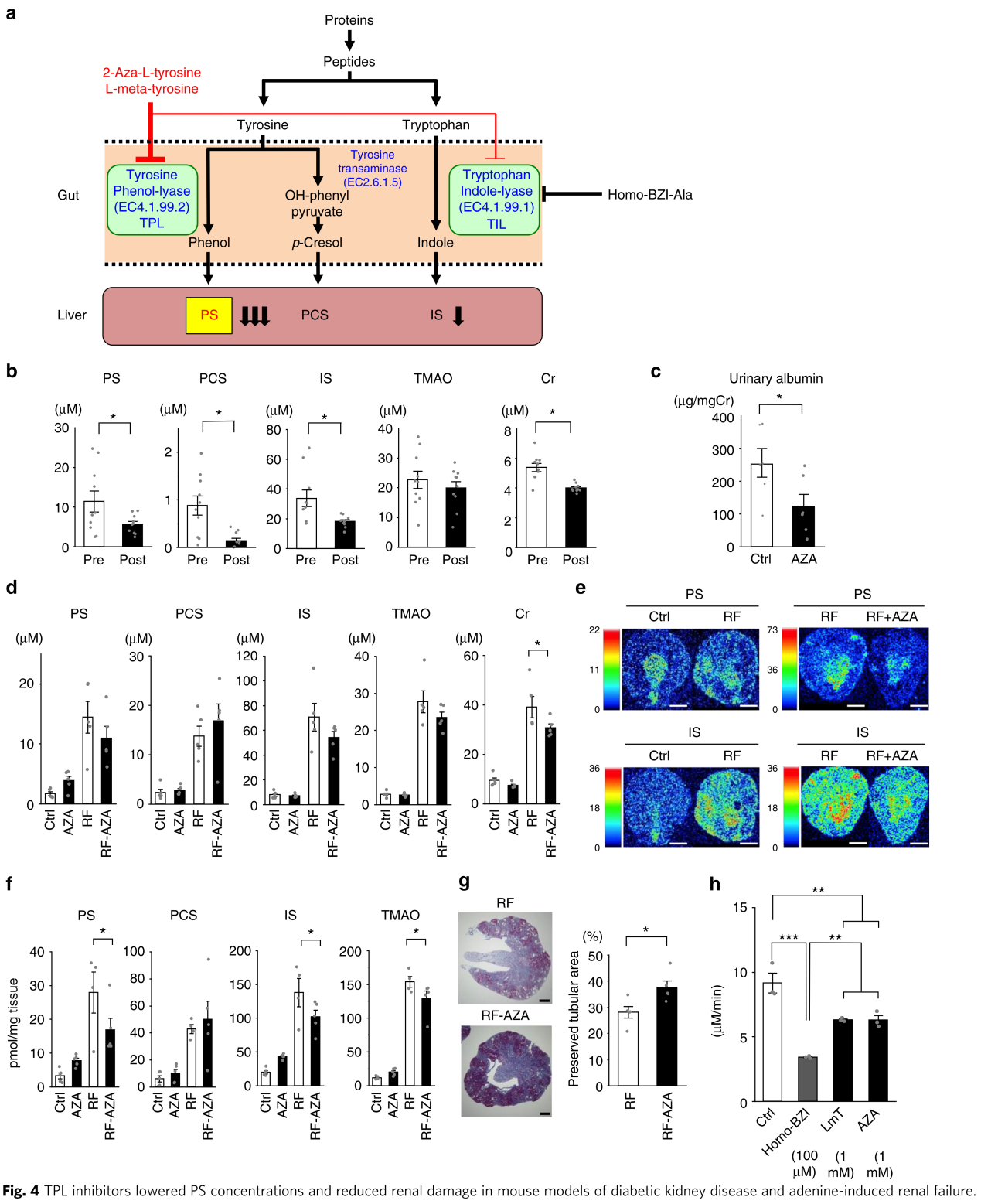
为了验证2-重氮酪氨酸的肾脏保护作用,作者又在腺嘌呤诱导的肾衰竭小鼠模型上对其进行评估。该模型小鼠血浆PS、IS、PCS和TMAO显著增加(图4d)。使用2-重氮酪氨酸处理后,血浆肌酐水平显著降低,PS和IS也有明显降低趋势,但不显著。质谱成像技术显示肾衰竭小鼠的肾皮质中PS和IS水平显著增加,而2-重氮酪氨酸处理后可回调(图4e)。基于LC-MS/MS的定量检测证实了以上发现(图4f)。另外,2-重氮酪氨酸处理可改善肾衰竭所致的管状区域损伤(图4g)。TPL抑制剂不仅能降低PS水平,还可降低IS。IS由色氨酸作为底物经色氨酸吲哚裂合酶(TIL)生成。TPL和TIL高度同源。因此,作者测试了TPL抑制剂对TIL活性的影响。2-重氮酪氨酸和L-间酪氨酸可显著降低TIL活性(图4h)。这些数据表明2-重氮酪氨酸可同时抑制TPL和TIL,降低血浆PS和IS水平,恢复肾损伤。
2-重氮酪氨酸仅微调肾衰竭小鼠的肠道菌群
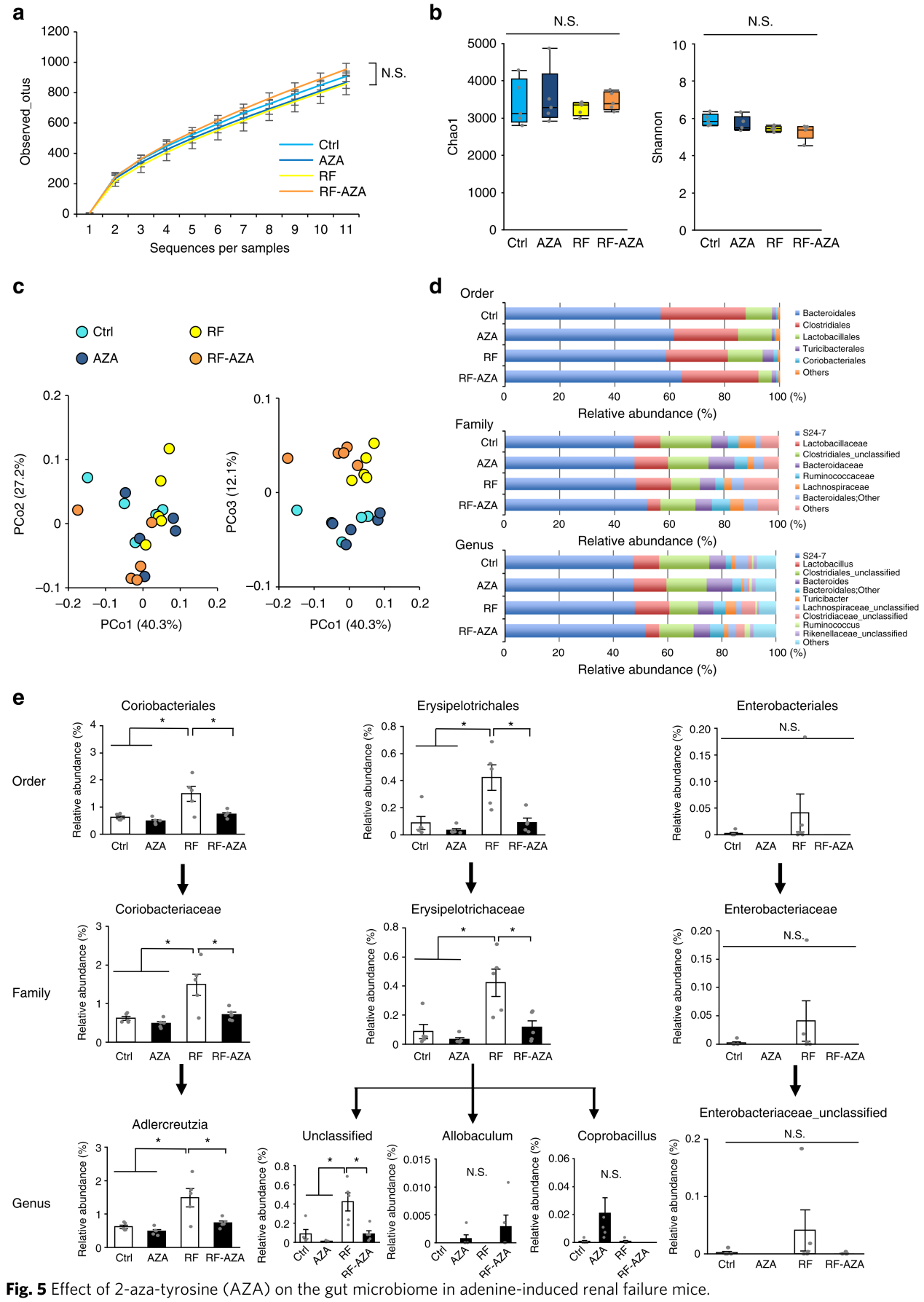
作者利用16S rRNA技术对肾衰竭小鼠粪便中的菌群结构进行了分析。α多样性稀释曲线、α多样性和PCOA分析都显示2-重氮酪氨酸对肠道菌群结构没有造成重大改变(图5a-c)。作者接下来关注与血浆PS正相关且2-重氮酪氨酸处理后降低的菌群,在目水平上, 合占90%以上的主要菌群不满足该标准(图5d),但丰度较小的两类(Coriobacteria和Erysipelotrichales)在肾衰竭小鼠中显著增加,2-重氮酪氨酸处理后明显降低(图5e),在科水平上同样如此。在属水平上,12个主要的属没有改变,但Adlercreutzia 和unclassified Erysipelotrichaceae与血浆PS呈正相关,提示这两个小类菌群可能在一定程度上影响血浆PS水平的变化。有TPL活性的Enterobacteriaceae科丰度低于0.1%,且和血浆PS无相关性。另外,终止给予L-间酪氨酸一周后,血浆PS水平重新恢复。这些结果表明TPL抑制剂没有显著改变主要的菌群,它们可能通过影响小分类菌群来降低PS的生成。
小结
本研究通过非靶向代谢组学技术发现肠道菌群来源的PS和DKD蛋白尿高度相关。PS可增厚肾小球基底膜,引起足细胞线粒体功能障碍和血管周围纤维增生,对肾脏的多重毒性导致蛋白尿增加。因此,血浆PS高水平的DKD患者应当降低PS以防止蛋白尿进展。PS不仅仅是早期诊断的生物标志物,还是DKD治疗的潜在靶点。PS来源于饮食中的酪氨酸,降低糖尿病患者的酪氨酸摄入可能减少PS的生成,从而减少蛋白尿,保护肾脏。此外,抑制微生物TPL酶可能是开发预防DKD药物的另一个方向。
参考文献
Koichi Kikuchi et al. Gut microbiome-derived phenyl sulfate contributes to albuminuria in diabetic kidney disease. NATURE COMMUNICATIONS, (2019), https://doi.org/10.1038/s41467-019-09735-4.



