文献解读
Nature Reviews Clinical Oncology | 代谢调节提高免疫治疗
在过去几十年里,免疫疗法的发展改变了癌症治疗模式。然而,大多数患者并没有从免疫治疗中获益,这可能是由于免疫抑制肿瘤微环境(TME)的重编程不足,从而限制了抗肿瘤免疫的疗效。多种代谢机制和营养感知机制可协调免疫细胞行为以响应TME中营养有效性。值得注意的是,肿瘤浸润的免疫细胞通常会由于肿瘤细胞代谢失调而引起代谢应激,从而导致抗肿瘤免疫反应受损。重新利用靶向代谢的抗癌药物可能通过TME的代谢重编程协同增强免疫治疗。目前,针对阻碍抗肿瘤免疫的代谢干预措施已经开发出来,且一些临床试验正在进行中。本文具体讨论了这些代谢通路如何调节抗肿瘤免疫,以及在免疫治疗背景下靶向干预这些通路的可能方法。

糖代谢
异常的生物能量活动使肿瘤细胞摄取大量葡萄糖通过糖酵解途径产生乳酸(即使在有氧充足的情况下也可产生大量乳酸),同时氧化磷酸化(OXPHOS) 速率相应的降低,这就是我们熟知的Warburg效应。乳酸通过单羧酸转运体(MCTs) 尤其是单羧酸-转运体4 (MCT4) 进入细胞外环境,从而形成酸性肿瘤微环境。过去十几年的研究发现,有氧糖酵解和由此产生的TME酸化对T细胞介导的抗肿瘤免疫反应和肿瘤浸润髓细胞的活性有很强的影响(图1)。受肿瘤细胞葡萄糖消耗率较高的影响,肿瘤浸润淋巴细胞(TILs)的mTOR活性、激活T细胞核因子(NFAT)信号以及酵解能力均出现降低导致抗肿瘤效应分子生成受损。此外,肿瘤细胞的糖酵解活性可诱导粒细胞集落刺激因子(G-CSF)和粒细胞-巨噬细胞集落刺激因子(GM-CSF)的表达,从而促进骨髓源抑制细胞(MDSCs)进入TME。此外,TME中葡萄糖缺乏与乳酸积累阻碍树突细胞(DC)成熟和巨噬细胞促炎症极化的代谢程序及信号传导,从而促进促肿瘤发生的骨髓样细胞发育,包括耐受性DCs和M2样巨噬细胞。肿瘤细胞产生的乳酸可能通过促进IL-23和IL-17介导的炎症而导致肿瘤发生。除了调节免疫反应外,肿瘤相关成纤维细胞(CAFs)产生的乳酸也被肿瘤细胞作为一种替代营养来源。
几项临床研究结果显示,肿瘤有氧糖酵解活性与宿主抗肿瘤免疫反应及免疫治疗效果呈负相关。例如,对过继性T细胞转移(ACT)免疫治疗不敏感的人类肿瘤有较高水平的有氧糖酵解活性。与低糖酵解活性肿瘤相比,高糖酵解活性肿瘤的T细胞肿瘤浸润和细胞毒性水平较低。黑色素瘤患者中,肿瘤乳酸脱氢酶A(LDHA)和乳酸水平与T细胞活性和总生存率的标志物呈负相关,来自311例患者的临床资料表明,血清LDH水平大于1000 IU/l可预测转移性疾病终末期。与这些研究结果一致,在小鼠模型中的研究结果发现,LDHA介导的乳酸生成会抑制肿瘤浸润T细胞和NK细胞的IFNγ表达,从而促进肿瘤生长和免疫逃逸。同样,肿瘤内乳酸浓度与肿瘤总生存率呈负相关。这些成果表明糖酵解不仅为肿瘤细胞提供内在生长优势,而且还具有消除癌症免疫监视的肿瘤细胞外在作用。因此,针对糖代谢和/或乳酸生成和分泌进行干预是一种具有吸引力的抗癌治疗策略,然而,这些干预方法特别是对同样可维持T细胞功能的糖酵解途径的干预(图1)可能同时削弱免疫反应。相反,靶向干预糖酵解途径也可能抑制IL-17、IL-6和IL-23介导的促肿瘤炎症反应,从而限制肿瘤的发生。因此,为了确保持续有效的抗肿瘤免疫,探索靶向干预糖酵解途径在不同肿瘤发生阶段是否会导致不同的治疗反应,需要重新考虑肿瘤治疗的代谢途径。
氨基酸代谢
谷氨酰胺和谷氨酸
肿瘤细胞的代谢需求也可以通过上调谷氨酰胺回补而获取能源。值得注意的是,乳酸可以通过缺氧诱导因子2α(HIF2α)促进肿瘤细胞谷氨酰胺转运体ASCT2和谷氨酰胺酶1(GLS)的表达,以诱导肿瘤谷氨酰胺分解增加。肿瘤细胞谷氨酰胺回补增加导致氨的释放增加,而暴露在氨中可以激活邻近细胞的自噬,如癌症相关成纤维细胞(CAFs)。有趣的是,CAFs被氨激活的自噬可通过促进可被肿瘤细胞代谢的谷氨酰胺释放来进一步促进肿瘤细胞生长。此外,谷氨酰胺代谢产物谷氨酸和α-酮戊二酸,以及天冬氨酸可以调节肿瘤细胞代谢、表观遗传、核苷酸合成和氧化还原平衡。因此,以谷氨酰胺回补为靶点的多种化合物已被开发用于抗癌治疗。除了肿瘤细胞,活化的T细胞和巨噬细胞也可上调谷氨酰胺代谢,以维持细胞存活和免疫反应。谷氨酰胺剥夺可抑制T细胞增殖和细胞因子的产生,然而,体外激活T细胞时限制谷氨酰胺被证明能促进记忆CD8+T细胞分化。GLS表达沉默也被证明可促进CD4+T辅助细胞1(TH1)和CD8+细胞毒性T淋巴细胞(CTLs)的分化和功能,但会损害TH17细胞分化。因此,对肿瘤细胞谷氨酰胺代谢的干预同时会影响TME的免疫状态和抗肿瘤免疫效果(图1)。目前还不清楚谷氨酸介导的信号转导是否可以被用来增强免疫治疗,还需进一步确定谷氨酰胺如何调控TME细胞中谷氨酰胺代谢以及谷氨酰胺调控T细胞的潜在机制。
精氨酸
精氨酸代谢在T细胞活化和免疫反应调节中也有重要作用。在炎症反应消除过程中,免疫调节细胞通过精氨酸酶1 (ARG1)的表达促进精氨酸降解(图1)。在TME中积累的表达ARG1的免疫调节细胞包括M2样肿瘤相关巨噬细胞(TAMs)、耐受树突状细胞(DCs)和Treg细胞可能会通过精氨酸降解,进而限制T细胞摄取该氨基酸从而抑制抗肿瘤免疫。因此,补充精氨酸和防止精氨酸在TME中降解是重新激活T细胞和NK细胞介导的免疫反应的有效策略。
色氨酸
炎症还可以通过吲哚胺2,3-双加氧酶(IDO)和色氨酸2,3-双加氧酶(TDO) 等酶介导的色氨酸代谢得到解决。肿瘤组织中高水平的IDO和TDO被认为会降低TME中色氨酸的可用性,进而抑制T细胞的杀瘤功能。除了剥夺T细胞所需色氨酸外,IDO和TDO还将色氨酸分解为犬尿氨酸,犬尿氨酸的累积可促进外周Treg细胞数量的增加,降低效应T细胞增殖(图1)。巨噬细胞IDO表达也通过产生犬尿氨酸为NAD+的合成提供原料,从而维持其抗炎和吞噬功能。这一发现表明,抑制IDO可能减轻TAMs的M2样表型。考察肿瘤中IDO表达水平,以及治疗前IDO表达与T细胞浸润的关系,可能是优化该治疗方法的关键。值得注意的是,在巨噬细胞中,犬尿氨酸的产生可以维持线粒体适应度和OXPHOS。此外,IDO抑制可能不仅在免疫抑制和/或肿瘤前TAMs中损害NAD+的生成,而且在CD8+TILs中也可能损害NAD+的生成。重要的是,NAD+的产生是维持T细胞免疫反应的一个关键事件。
脂肪酸和胆固醇代谢
肿瘤细胞通常会提高从头合成脂肪酸的速度为细胞膜上的磷脂和信号分子的生成提供能量。此外,脂肪细胞和脂肪细胞来源的成纤维细胞在TME中被发现,并贡献于TME中脂质含量的增加。肿瘤浸润髓细胞(包括MDSCs、DCs和TAMs)中的脂质积累会通过代谢重编程使这些免疫细胞向免疫抑制和抗炎表型倾斜。有效的TCR聚集和免疫突触的形成对T细胞功能至关重要,而这依赖于细胞膜的脂质组成。此外,不同脂肪酸对CD4+T细胞的分化和增殖有不同影响,如长链脂肪酸月桂酸可维持促炎Th1细胞和Th17细胞分化,短链脂肪酸丙酸则促进Treg细胞发育。因此,TME中存在的脂质种类可能改变效应细胞CD4+T细胞的浸润模式,并可能决定靶向脂质代谢治疗肿瘤的效果。M1型和M2型巨噬细胞之间的脂质代谢也不同,比如脂肪酸合成主要发生在M1型巨噬细胞中,而M2型巨噬细胞依赖于脂肪酸氧化(FAO)来满足其生物能量需求。不过,抑制FAO或增加脂肪酸合成是否能提高巨噬细胞的抗肿瘤活性目前仍无定论。
代谢调控在免疫治疗中的意义
训练型免疫力是一种特殊的免疫反应,通过训练刺激物(如β-葡聚糖)长期刺激增强先天免疫细胞的活性可诱导表观遗传重编程。例如,通过训练刺激使先天免疫细胞产生高水平促炎细胞因子预防各种感染。训练刺激已在不同试验中得到应用,其目的是引起抗肿瘤反应(表1)。考虑到先天免疫细胞在免疫抑制TME形成过程中具有重要作用,在TAMs和/或肿瘤浸润DCs中刺激训练免疫可能通过重新编程TME代谢使其更具免疫刺激作用从而与其他免疫疗法产生协同作用,如α-酮戊二酸、乙酰辅酶A、琥珀酸、延胡索酸、NAD+都是免疫训练关键调节器,其他代谢干预也可能协同训练刺激增加抗肿瘤免疫力。
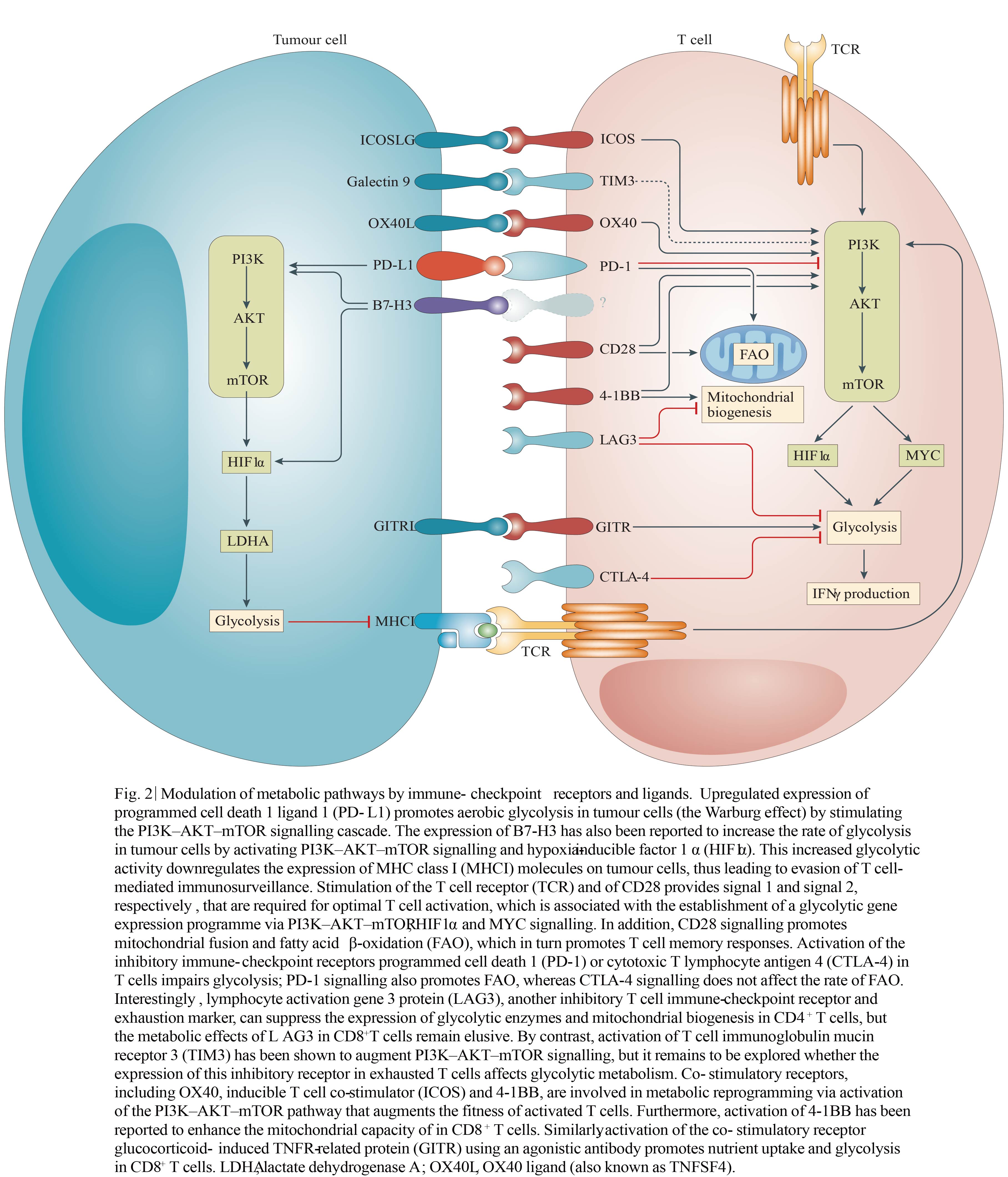
免疫检查点抑制剂(ICIs)是肿瘤治疗的一个突出进展。该疗法最初是为了增强T细胞活化的信号通路而开发,而新的证据表明,ICIs也会影响T细胞的代谢(图2)。几项研究的结果表明,免疫检查点结扎或抑制会影响TME中肿瘤和T细胞间的代谢对话和竞争。例如,PD-1与PD- L1或PD- L2的相互作用通过抑制PI3K-AKT-mTOR通路而损伤T细胞的代谢重编程,包括有氧糖酵解和谷氨酰胺分解的上调。PD-1信号通过刺激AMPK活性和诱导脂肪酸氧化限速酶肉碱棕榈酰转移酶1A (CPT1A)的表达促进T细胞中脂肪酸氧化代谢。除了调节肿瘤浸润淋巴细胞(TILs)代谢谱,免疫检查点还可以直接影响肿瘤细胞的代谢。PD-L1和B7-H3(也称为CD276)在肿瘤细胞中通过激活PI3K-AKT-mTOR通路来刺激有氧糖酵解。因此,抑制PD-1–PD-L1轴可促进TILs的重新活化和代谢适应,同时抑制肿瘤细胞的有氧糖酵解产生协同抗癌作用。与抑制性免疫检查点受体引起的代谢损伤相反,协同刺激分子通过刺激控制转录重编程和代谢开关的信号通路来维持T细胞的活化。例如,CD28信号通过同时刺激有氧糖酵解和促进线粒体融合从而有效地产生乙酰辅酶A来增强T细胞的代谢 (图2)。越来越多的证据表明ICIs和刺激受体的协同刺激分子(如竞争性抗OX40或抗GITR抗体)对T细胞代谢有重要影响。
小结
(1)TME会给浸润免疫细胞施加代谢压力,导致局部的免疫抑制以及肿瘤免疫逃逸;
(2)针对肿瘤细胞异常代谢特性的代谢干预措施可能会重编程TME的免疫状态;
(3)免疫检查点调节T细胞的活化和功能部分是通过影响T细胞代谢重编程和线粒体适应性介导;
(4)靶向TME中活跃代谢通路的药物可能会通过减轻TILs的代谢压力而与免疫检查点抑制剂产生协同作用。
了解和利用TME中的“代谢对话”有利于提高免疫疗法的低应答率。尽管各种代谢物调节剂和免疫疗法组合已经在临床中展开试验 (表1),但更好地了解肿瘤免疫逃逸的代谢机制和免疫细胞的代谢需求对于充分开发联合疗法至关重要。值得注意的是,代谢编程也影响抗原的表达和识别。因此,代谢干预不仅能改善免疫细胞对高度免疫遗传性癌症的响应,也能增加癌症细胞的免疫原性,从而扩大免疫疗法有效治疗癌症的范围。


参考文献
Xiaoyun Li et al. Navigating metabolic pathways to enhance antitumour immunity and immunotherapy. Nature Reviews Clinical Oncology (2019).



