文献解读
Science | 肿瘤转移到淋巴结需要YAP依赖的代谢适应
在癌症患者中,肿瘤转移到前哨淋巴结(sentinel lymph nodes, LNs)可以预测疾病进展并常常指导治疗决策。但以往关于肿瘤转移的研究大多集中在远端转移,而忽略了肿瘤细胞在LNs中的生存和生长机制。越来越多的证据表明LNs是肿瘤进一步扩散的立足点,因此阐明肿瘤淋巴结转移的潜在机制至关重要。为了研究这背后的可能机制,来自韩国高等科学技术学院的Gou Young Koh研究团队利用肿瘤小鼠模型,采用转录组和代谢组学技术发现LN转移需要肿瘤细胞经历Yes相关蛋白(YAP)依赖的代谢转变,即优先利用脂肪酸氧化供能,相关成果发表于国际知名期刊《Science》。
作者首先对LNs转移的三个阶段进行了转录组学分析,分析了原位癌,微转移和宏转移肿瘤引流淋巴结中的绿色荧光蛋白标记(GFP+)B16F10黑色素瘤细胞(图1A)。RNA-seq的热图显示肿瘤进展到LNs转移过程中,转录组发生了广泛的变化(图1B)。在LNs微转移和宏转移瘤的上调基因与脂质生物学相关,如胆汁酸代谢、脂肪生成、脂肪酸代谢、胆固醇稳态和氧化磷酸化(图1C-F)。对这些上调基因进行通路分析显示LN转移瘤刺激脂肪酸氧化(fatty acid oxidation, FAO)和过氧化物酶体增殖物激活受体α信号通路(PPAR-α)。
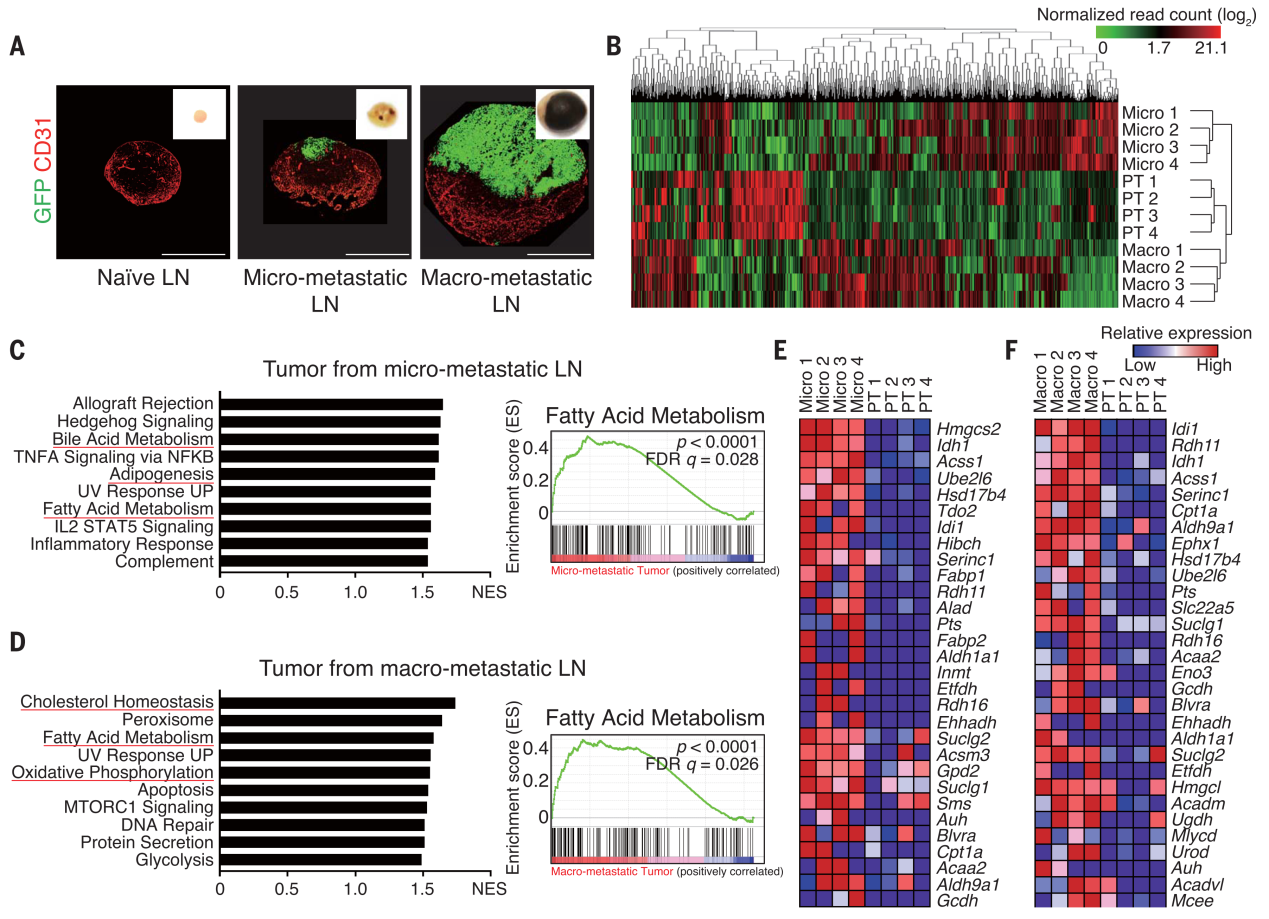
Figure 1. LN-metastatic tumors undergo transcriptomic changes toward increased lipid metabolism.
和转录组结果一致,代谢组学分析显示小鼠初始LNs中的脂肪酸水平高于健康对照小鼠的足垫处(原发肿瘤植入部位)。此外,与原发肿瘤相比,LN转移瘤显示出更大程度的脂肪酸积累(图2A),提示转移瘤在脂质丰富的LN中更倾向于利用脂肪酸氧化来供能。作者进一步采用体内富集选择方法获得LN实质内旺 盛生长的高转移B16F10亚群细胞,经培养基扩增后重新接种到足垫。经过三轮体内选择,易LN转移的适应型B16F10亚群细胞对LNs的转移活性高于最初的亲代B16F10细胞。此外,与葡萄糖或谷氨酰胺氧化相比,适应型细胞更倾向于依赖FAO作为能量生产的主要途径(图2B),且在培养基中添加脂肪酸时,它们表现出增强的FAO能力。LN转移瘤的FAO速率约为原发肿瘤或肺转移肿瘤的4倍,并与棕色脂肪组织相当(图2C)。
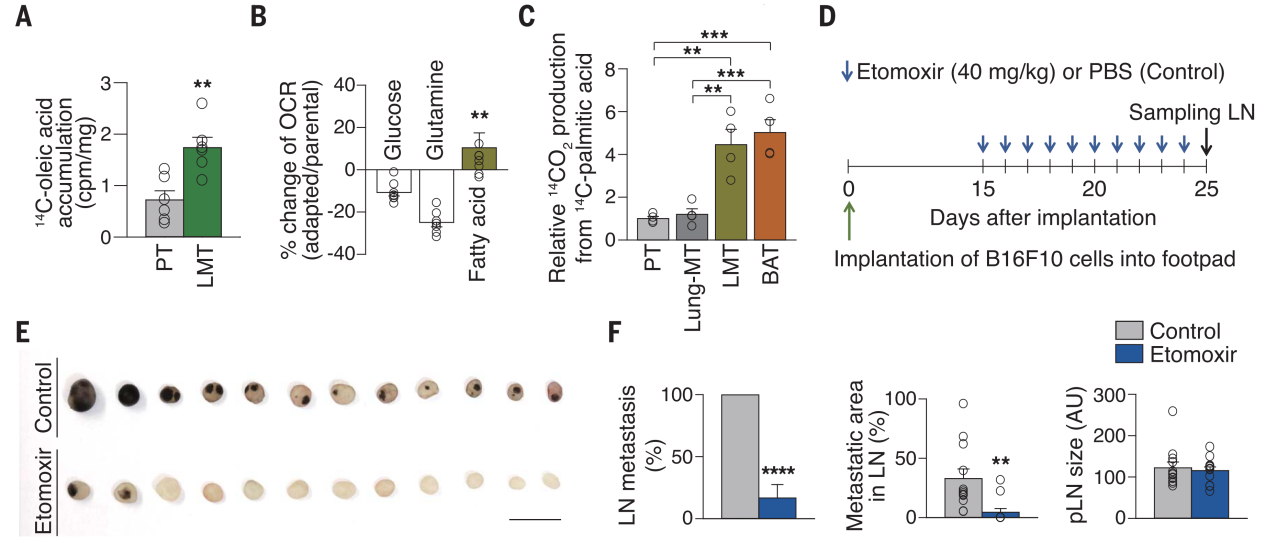
Figure 2. Enhanced FAO is required for LN metastasis.
为了证明FAO对肿瘤LN转移的重要性,作者使用了B16F10黑色素瘤足垫植入小鼠模型(图2D),并在小鼠大腿前外侧给予乙莫克舍(etomoxir,临床认证的FAO抑制剂)。尽管乙莫克舍不影响原发肿瘤的大小或小鼠体重,但它在不影响肿瘤引流LN大小的情况下明显抑制了LN转移(图2D-F)。它还能显著抑制原发性B16F10黑色素瘤手术切除后的LN转移。乙莫克舍在两种乳腺癌模型(MMTV-PyMT转基因小鼠模型和原位4T1模型)中也可显著抑制LN转移。另外,当B16F10细胞或4T1细胞直接接种到LN中时,乙莫克舍抑制了肿瘤的生长。然而在全身性的B16F10细胞或4T1细胞注射模型中,乙莫克舍不影响血源性的肺转移。以上结果表明肿瘤细胞中以FAO供能为主的代谢转变是肿瘤引流LNs细胞转移生长所必需的。
为了明确在LN转移肿瘤中触发代谢转变的分子机制,作者重新回顾了转录组数据。在转移肿瘤中诱导的致癌基因里,只有敲低YAP可致转移适应型细胞FAO显著下降(图3A)。同时,敲低YAP不会影响葡萄糖或谷氨酰胺氧化(图3B)。YAP靶基因在LN转移瘤中是被诱导表达的(图3C)。另外,逆转录病毒介导的YAP过表达可导致FAO水平在培养B16F10细胞中增加2.4倍,而LN中B16F10黑色素瘤生长增加2.3倍。这些结果表明YAP基因的激活是介导LN转移瘤FAO活化的关键分子信号。

Figure 3. YAP activation is critical for enhanced FAO and tumor LN metastasis.
鉴于细胞核定位的YAP是YAP的活化形式,作者分析了癌转移LN中的YAP定位模式。在LN转移黑色素瘤侵袭前缘的肿瘤细胞中,YAP主要定位于细胞核(图3D-F,I)。在MMTV-PyMT乳腺癌模型中,LN转移瘤侵袭前缘的肿瘤细胞中也发现了类似的YAP定位模式(图3G-I)。相反,在两种肿瘤小鼠模型的原位肿瘤和肺转移肿瘤中,YAP主要定位于细胞质(图3J)。另外,在淋巴管中的转移肿瘤细胞也表现出基于细胞质的YAP定位模式。因此,YAP的激活仅局限于到达LNs的肿瘤细胞。
为了确定LN微环境是否触发了YAP的激活,作者将B16F10细胞直接接种到小鼠腹股沟LNs中。在接种3天后,YAP主要定位于侵袭性前缘黑色素瘤细胞的细胞核中。作者进一步采用多西环素(doxycycline)敲低YAP,以考察YAP耗竭对LN转移的影响。为了保证肿瘤转移后YAP是耗竭的,小鼠在黑色素瘤细胞接种两周后被给予多西环素饮食(图3K)。YAP耗竭强烈地抑制了LN转移,而没有显著改变原位肿瘤或肿瘤引流LNs的大小(图3K-M)。在手术移除原位肿瘤后,YAP耗竭也明显抑制LNs转移瘤的生长。将B16F10黑色素瘤细胞或4T1乳腺癌细胞直接接种到LN中,YAP耗竭可延缓肿瘤的生长,但对血源性肺转移没有实质影响。综上表明YAP激活在有效的LN转移中扮演着至关重要的角色。
那么,YAP在LN转移肿瘤中被激活的分子机制是什么?尽管缺氧和细胞增殖都已被明确与YAP激活相关,但作者发现它们和YAP核定位没有明确的联系。鉴于YAP核定位局限于肿瘤侵袭前缘细胞,作者假设LN微环境中存在特定的信号配体可激活YAP。作者发现相比于正常组织(足垫组织和初始LNs),在LN转移黑色素瘤中多个胆汁酸显著升高(图4A)。相反,它们的前体小分子胆固醇在这些组织中的水平是相似的。另外,相比于健康正常小鼠,LN转移肿瘤小鼠的全身淋巴液中包含更高浓度的胆汁酸。转录组数据也显示相比于原位肿瘤,LN转移肿瘤中的胆汁酸代谢基因高度表达(图4B)。

Figure 4. LN-metastatic tumors produce bile acids that can activate YAP, and YAP activation is correlated with melanoma LN metastasis and patient survival.
除了帮助消化脂肪,胆汁酸也已报道可作为激活YAP的信号分子。那么在LN转移肿瘤中升高的胆汁酸是否能够激活YAP?作者发现在体外用TDCA处理适应型B16F10细胞可在30分钟内诱导YAP去磷酸化(活化)(图4C)。皮下注射TDCA可使LN转移黑色素瘤的生长速度相比于PBS对照组提高约2.5倍。胆固醇处理也能诱导适应型B16F10细胞YAP去磷酸化,但动力学更慢(图4D),而这种效果可以被CYP7A1(胆固醇代谢为胆汁酸的关键限速酶)的耗竭阻断(图4E)。作者还发现培养的适应型B16F10细胞以CYP7A1依赖的方式从胆固醇生成多种胆汁酸。另外,相比于LN中的正常B16F10细胞,CYP7A1耗竭的B16F10细胞生长被抑制,YAP核定位减少。作者进一步鉴定出核维生素D受体(VDR)作为胆汁酸活化受体,可能介导胆汁酸诱导的LNs中YAP活化和肿瘤生长。以上数据表明,LN转移肿瘤累积胆汁酸,通过VDR激活YAP,导致肿瘤细胞FAO活化并成功适应LN微环境。
最后,作者对21例黑色素瘤患者的LN转移瘤进行了研究。约一半的肿瘤转移LN表现出以YAP细胞核定位为主的模式,尤其是在侵袭性前缘(图4F)。相反,从相同患者分离出的原位黑色素瘤没有表现出YAP细胞核定位的模式。值得一提的是黑色素瘤患者肿瘤转移LN的YAP细胞核定位模式与远端无转移生存率降低有关(图4G),且与患者的年龄和原位肿瘤厚度无关。因此,YAP激活是区分LNs转移肿瘤和高风险远端器官转移的关键生物标志物。
小结
肿瘤细胞的有氧糖酵解(Warburg效应)是癌症公认的特征。但不同的肿瘤可能依赖不同的代谢通路,如谷氨酰胺水解、支链氨基酸氧化和肌酸的使用,这取决于它们所处的微环境。这种灵活的能量选择可能允许癌细胞在含有不同营养成分的转移部位存活。本研究通过对LN转移瘤与原发性肿瘤的比较,发现肿瘤在LN转移过程中发生了向FAO的代谢转移。作者通过选择性刺激FAO,发现YAP可能被积累的胆汁酸激活,是肿瘤LN转移的关键驱动因素。可见肿瘤转移至肿瘤引流淋巴结通过YAP依赖性方式调节FAO通路来适应LN微环境,即利用LNs中丰富的脂肪酸作为能量来源。通过代谢组学和转录组学分析,出乎意料地发现胆汁酸是作为肿瘤转移LN中YAP活化的潜在分子触发器。因此,LN中特殊的微环境,即丰富的脂肪酸和胆汁酸,可同时促进肿瘤的适应和代谢转变。对于多种小鼠和人类肿瘤,LNs是远端转移的首选途径。选择性抑制淋巴结转移可防止或减少肿瘤细胞向远端器官的扩散。本文中的研究结果表明针对FAO和YAP为靶点的治疗可能是抑制肿瘤淋巴结转移和随后的远端转移的一种策略,但这些发现是否适用于临床癌症患者还有待进一步研究。
参考文献
Lee et al ., Tumor metastasis to lymph nodes requires YAP-dependent metabolic adaptation. Science 363 , 644 – 649 (2019).



