文献解读
Circulation | 短链脂肪酸–丙酸盐预防高血压心血管损害
肠道微生物群相关代谢物对宿主心血管健康有重要影响,异常的细菌群落与高血压、动脉粥样硬化有关,细菌相关代谢物介导与宿主的互作并通过再吸收和分布影响肠道健康、免疫系统、血管和心脏等。高血压被认为是最突出的健康风险因素,可诱发高血压性心脏病和动脉粥样硬化等多种心血管疾病。动脉高压及其器官后遗症常表现为T细胞介导的炎性疾病,实验性抗炎治疗已被证明可以改善高血压终末器官损伤。短链脂肪酸(SCFA)在结肠中由细菌发酵产生,具有维持肠道完整性和免疫细胞功能及较强的抗炎作用。德国MaxDelbruck分子医学中心Dominik研究团队针对短链脂肪酸(SCFA)抗炎和调节性T细胞(regulatory T cells, Treg)促进作用的认识,提出“丙酸盐可保护心脏和血管免受血管紧张素II(AngII)诱导的损伤”的科学假说,建立WT小鼠输注AngII 14天的高血压模型和ApoE-/-小鼠输注AngII 28天的动脉粥样硬化模型,并用丙酸钠干预模型小鼠,氯化钠作为对照,采用病理组织学、超声心动图、体内电生理、免疫荧光和流式细胞术评估丙酸盐对高血压心脏损伤和动脉粥样硬化的影响,相关研究成果发表于国际知名期刊《Circulation》。
丙酸盐可预防血管紧张素II诱导的全身炎症反应
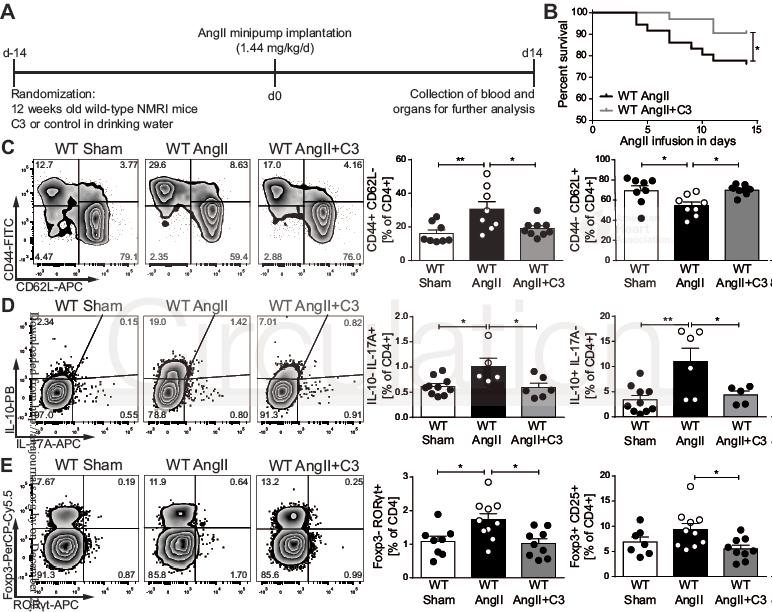
WT小鼠经AngII处理两周同时采用200mM丙酸钠(C3)进行干预,等浓度氯化钠溶液作为对照(Sham)(图1)。为了明确外源性C3的作用,给小鼠喂食无纤维的纯化饲料以减少肠道内源性SCFA的产生。相比对照组,C3组小鼠存活率显著提高(图1B)。进一步采用流式细胞术探讨C3对全身炎症的作用。相比假手术组,AngII组脾脏CD4+效应记忆T细胞(TEM; CD44+CD62L–)升高,CD4+早幼T细胞(TN; CD44– CD62L+)减少,说明AngII组发生显著的炎症反应,C3阻止了TEM的增加和TN的减少(图1C)。脾Th17细胞分析结果显示AngII输注后CD4+IL-17A+ IL-10–和CD4+RORγt+Foxp3–频率增加(图1D-E),且经C3干预后回归正常,而脾Th1则没有受到影响。有趣的是,AngII可升高Treg细胞频率 (CD4+CD25+Foxp3+和CD4+IL-10+IL-17A–),表明Treg对高血压刺激的代偿性应答,这在C3干预时尚未观察到(图1C-D)。
C3是否也会影响高血压小鼠的免疫稳态向动脉粥样硬化发展?给予具有动脉粥样硬化倾向的ApoE-/-小鼠正常饮食及AngII 4周,并给予C3干预或氯化钠溶液 (图2A)。C3干预可保护 ApoE-/-小鼠免于AngII诱导的主动脉破裂,从而降低死亡率(图2B)。与未发生动脉粥样硬化的高血压小鼠的结果一致,C3降低了AngII输注ApoE-/-小鼠脾脏TEM数量,增加了脾脏TN数量(图2C),而脾中央记忆T细胞(TCM)无显著调控(图S1G)。此外,C3治疗显著降低了CD4+Foxp3–RORγt+ Th17细胞,而CD4+CD25+ FoxP3+ Treg没有变化(图2D)。以上数据表明,无论是否伴有动脉粥样硬化,C3均可改善高血压小鼠的全身炎症反应。
丙酸可减轻血管炎症和动脉粥样硬化
血管壁炎症是动脉粥样硬化的标志,且在AngII水平升高的情况下更加明显。采用流式细胞术分析了AngII输注ApoE-/-小鼠主动脉免疫细胞数可探究C3是否能调节动脉粥样硬化炎症反应。C3干预后主动脉CD4+, CD8+ T细胞和F4/80+巨噬细胞数量减少(图3A)。与脾免疫细胞相似,C3可降低主动脉CD4+ TEM,升高CD4+ TN频率,而CD4+ TCM未改变(图3B)。头臂动脉粥样硬化斑块(BCA)免疫组化染色进一步验证了该结果。C3组小鼠BCA切片中CD3+T细胞和F4/80+巨噬细胞较少(图3C-D)。为了确定这些有益影响是否会转化为动脉粥样硬化损害负担的减轻,对整个主动脉进行了油红O染色,C3组主动脉粥样硬化损害负荷显著降低(图3E),BCA的狭窄程度也明显降低(图3F)。此外,在C3组中,肥厚指数和间质纤维化明显减弱(图3G-H),但血清总胆固醇、甘油三酯、高密度脂蛋白或低密度脂蛋白胆固醇水平无明显变化(表S1)。综上所述,在AngII输注ApoE-/-小鼠中,C3治疗降低了血管炎症、动脉粥样硬化损害的负担以及不依赖于血脂水平的心脏重构。
丙酸钠改善心脏免疫细胞浸润和重构
除了血管损伤,高血压还会诱发心脏产生炎症反应,从而促进心脏重构。流式细胞术检测WT小鼠AngII输注第14天心脏浸润淋巴细胞,发现心脏CD4+, CD8+ T细胞和F4/80+巨噬细胞数量明显增加,经C3处理后明显减少(图4A-E)。通过对心脏冷冻切片的CD4和CD8免疫荧光分析亦可以证实这些结果(图S3A-B)。进一步分析Th17, Treg, Th1亚群在浸润心肌T细胞中的比例。C3处理阻止了AngII诱导的心脏CD4+RORγt+ Foxp3–频率的增加,而各组之间CD4+ FoxP3+ RORγt–T细胞和CD4+ T-bet+ T细胞的比例相似(图4F,S3C)。qPCR检测心脏组织IL-10 mRNA水平,与CD4+脾细胞IL-10表达一致,C3抑制了AngII诱导的IL-10表达增加(图S3D)。
AngII输注14天后,心肌肥厚指数升高,但C3治疗后得到缓解(图4G),通过超声心动图发现AngII输注后左心室壁厚度增加,C3治疗后显著减少(图4H)。AngII可诱导心脑利钠肽(Nppb)和β-肌球蛋白重链(Mhy7) mRNA表达增加,通过qPCR可见C3治疗后得到逆转 (图4I-J)。通过纤维连接蛋白和I型胶原免疫荧光检测发现C3还可以阻止AngII诱导的心肌间质和血管周围纤维化的增加(图4K-L)。使用成纤维细胞特异性蛋白(FSP)-1免疫荧光分析显示心肌成纤维细胞数量也受到类似的调节(图4M)。SCFA被认为对组蛋白去乙酰化酶(HDAC)有抑制作用,而抑制HDAC可抑制AngII诱导的心肌肥厚和纤维化,C3并不会降低心房肽Nppa(HDAC诱导心肌肥厚标志物)的表达,表明C3对AngII诱导的心肌肥大是HDAC非依赖性的(图4S)。
丙酸盐的作用取决于Treg
C3已被报道可以促进Treg的生成和功能。为了验证“C3在AngII诱导的高血压WT小鼠中的作用是基于Treg依赖性的”这一假设,通过注射抗CD25抗体(AngII输注1,2,5天)促使C3处理的WT小鼠耗尽Treg以评估炎症和心脏纤维化。在AngII输注的第14天,与IgG对照组相比,脾Treg仍然显著耗尽(图5A)。与未消耗的小鼠相比,Treg消耗的AngII输注WT小鼠在用C3处理后表现出脾CD4+ IL-17A+细胞频率显著增加(图5B),C3对Treg耗竭小鼠脾脏CD4+ TEM频率的抑制作用消失(图5C),而TCM或TN未改变(图S5E-F),心脏切片CD4+和CD8+淋巴细胞明显增多(图5D-E)。与注射IgG的小鼠相比,经Treg消耗C3处理的AngII输注小鼠超声心动图和肥大指数无明显升高(图5F, S5G)。然而,Treg缺失小鼠的心脏显示间质和血管周围纤维化明显增加,以及FSP-1+细胞数量增加(图5G-I)。上述发现提示Treg可能部分介导C3的心脏保护作用。
丙酸钠有适度降压作用
研究表明C3可能会直接影响血管舒缩功能,那么长期口服C3是否会影响输注AngII的WT小鼠的血压?结果显示,C3组小鼠初期收缩压和舒张压不受影响,但在AngII输注后第二周收缩压和舒张压降低,从第11天和第12天开始均有统计学意义(图6A,C),分别计算两周AngII输注时曲线下面积(AUC),仅第二周收缩压和舒张压有显著差异(图6B,D)。这一现象在ApoE-/-模型中得到证实,C3组小鼠在AngII输注最后一周收缩压的尾袖测量值显著降低(图S6A)。在降低血压的同时,C3治疗还显著改善了两种小鼠模型的内皮功能障碍(图S6B, C)。为了阐明C3的降压效果是否直接受Treg的影响,采用放射性元素测定接受抗CD25抗体或IgG的C3处理AngII输注WT小鼠的血压,在AngII输注的初始和后期,收缩压和舒张压是相似的(图S6E, F)。因此,慢性C3治疗降压作用不能归结为单一的机制。
丙酸降低了室性心律失常的易感性
为了进一步探索C3对AngII诱导的心脏重塑的有益作用是否改善心脏功能,通过体内心脏电生理学研究评估了用C3或对照处理的AngII输注的WT小鼠对室性心律失常的易感性。室性快速心律失常与高血压性心脏病的预后相关,C3处理小鼠对室性快速心律失常的易感性显著降低,而85%的对照组小鼠可触发持续性快速心律失常(图7A, B)。免疫荧光显示,输注AngII后间隙连接蛋白 (Connexin, Cx) 43从闰板转移到心肌细胞的外侧边缘(图7)。因此,与注射氯化钠的假手术组小鼠相比,注射AngII后Cx43与N-钙黏着蛋白(定位于闰板)共定位的程度降低,可通过C3治疗修复(图7C),这些数据显示C3改善了心脏电重构。
小结
丙酸盐通过维持免疫稳态来预防高血压和动脉粥样硬化小鼠的靶器官损伤。C3可明显减轻全身炎症反应,显著降低室性心律失常的敏感性,减少动脉粥样硬化和高血压心脏重构,其对靶器官的保护作用部分依赖于Treg,Treg的消耗可以通过增加Th17和TEM 频率来平衡丙酸钠对全身和心脏炎症、心脏纤维化的作用。因此丙酸钠可能对改善心血管健康至关重要,口服丙酸钠可影响T辅助细胞稳态,减少心肌肥厚和纤维化、心律失常的易感性和动脉粥样硬化损害的负担。目前高血压指南建议在任何药物抗高血压治疗之前应先改变生活方式,而饮食中增加丙酸盐是一种经济的干预手段,将可能是一种预防靶器官高血压损害的新方法。
高血压通过引起一系列的病理器官后遗症而引起心血管疾病,高血压组织损伤在很大程度上是由不同的免疫细胞介导,高血压刺激如AngII可促进T细胞和巨噬细胞的活化,进而可能浸润靶器官如心脏和血管,造成组织损伤。效应记忆T细胞(TEM)的增加提示高血压患者存在慢性炎症反应。辅助T细胞亚群Th17和Th1可能通过释放促炎细胞因子白细胞介素(IL) -17和干扰素-γ(IFN-γ)促进高血压靶器官损伤。而调节性T细胞(regulatory T cells, Treg)通过分泌抗炎的IL-10来平衡组织炎症。因此,高血压靶器官损伤的程度不仅取决于血流动力学负荷,还取决于促炎和抗炎免疫细胞的平衡。研究显示实验和临床抗炎方法可以改善高血压炎症组织损伤和动脉粥样硬化,通过过继转移增强Treg可减少效应T细胞并改善心脏损害、高血压、血管损伤和动脉粥样硬化。
参考文献
Hendrik Bartolomaeus, et al. The Short-Chain Fatty Acid Propionate Protects from Hypertensive Cardiovascular Damage. Circulation, 2018,10.1161/118.036652.
往期推荐
2. GUT : 丁酸盐通过肠-脑神经回路降低食欲并激活棕色脂肪组织



