文献解读
绘谱导读 | 色氨酸-吲哚代谢物介导肿瘤免疫治疗和肾脏保护新功能
【导读聚焦】
吲哚是色氨酸通过肠道菌群的代谢产生的主要产物。吲哚类代谢物已被证实可以激活特定的免疫系统,如芳烃受体(AhR),从而调节免疫细胞的活性有效改善代谢和免疫相关疾病。色氨酸-肠菌-吲哚代谢轴已成为近几年的研究热点,本期绘谱导读介绍两篇论文,报道了吲哚代谢物的新功能。
01
Signal Transduct Tar | 靶向肠道约氏乳杆菌逆转慢性肾脏疾病
慢性肾脏病(CKD)是难治的全球性疾病,肾纤维化是其最终病理特征。肠道微生物失调及其代谢物在CKD中起重要作用,但具体机制尚不清楚。本研究从健康人、CKD患者及动物模型中分离肾功能相关细菌及代谢产物,发现约氏乳杆菌产生的吲哚-3-醛(IAld)通过抑制芳香烃受体(AHR)途径影响肾纤维化,为CKD的微生物-代谢调控机制提供了新的见解。
1. 首先,通过对比健康受试者与CKD患者的临床参数,发现年龄和体重与CKD进展无显著关联,而收缩压、舒张压、肾功能指标(如血清肌酐、胱抑素C等)以及贫血相关指标(如红细胞计数、血红蛋白和血小板)与CKD进展显著相关。
2. 使用高通量测序技术分析肠道微生物群,发现CKD患者存在显著的微生物生态失调。Chao和ACE指数与CKD进展呈正相关,而Shannon指数与CKD中期阶段负相关。主坐标分析显示,随着CKD进展,肠道微生物群逐渐偏离健康对照组。进一步分析显示,多个细菌分类水平上的丰度与CKD进展显著相关,特别是乳酸杆菌科及其下属的约氏乳杆菌(Lactobacillus johnsonii),其丰度在CKD患者中显著降低,并与肾功能下降呈正相关。
3. 通过UPLC-HDMS代谢组学技术发现CRF(慢性肾功能衰竭)大鼠和CKD患者血清代谢谱的显著变化。CRF大鼠和CKD患者血清中色氨酸及其代谢物显著扰动,特别是微生物衍生的吲哚衍生物如IAld和5-甲氧基色氨酸,在CRF大鼠和CKD患者中均表现出与肾功能下降(如eGFR、血清肌酐等)显著相关的变化趋势。进一步相关性分析表明,这些代谢物的变化与肠道微生物群的失调密切相关,特别是约氏乳杆菌的减少与血清IAld水平的降低呈正相关。
4. 为了验证微生物和代谢物在CKD进展中的作用,本研究进行了约氏乳杆菌和IAld的干预实验。结果显示,约氏乳杆菌治疗能够显著改善CRF大鼠的肾功能和纤维化,同时增加血清IAld水平。IAld治疗也表现出类似的肾保护作用,并显著抑制了芳香烃受体(AHR)及其下游靶基因的表达。进一步的研究表明,IAld和约氏乳杆菌的肾保护作用与抑制AHR信号通路有关,这一发现为CKD的治疗提供了新的靶点。
参考文献
Miao H, Liu F, Wang YN, et al. Targeting Lactobacillus johnsonii to reverse chronic kidney disease. Signal Transduct Target Ther. 2024.
请扫描二维码阅读原文
02
Signal Transduct Tar | 阿卡波糖通过调节肠道微生物群增强针对实体瘤的免疫疗法的疗效
免疫检查点抑制剂(ICIs)在癌症免疫治疗中有重要作用,但存在疗效不佳的情况,肠道菌群被认为可影响其疗效。阿卡波糖是一种口服降糖药,可调节肠道菌群,本研究旨在探讨阿卡波糖能否增强抗PD-1疗法对实体瘤的疗效及其机制,特别关注代谢组及色氨酸相关研究。
1. 建立MC38结肠癌和B16黑色素瘤小鼠模型,分为对照组、抗PD-1组、阿卡波糖组和联合治疗组,还建立了AOM/DSS诱导的结肠癌模型。阿卡波糖与抗PD-1联合使用可显著抑制肿瘤生长,增加肿瘤坏死和细胞凋亡,改善肿瘤微环境。
2. 采用16S rRNA测序分析肠道菌群,口服阿卡波糖(500mg/kg)可增加肠道菌群的α-多样性,改变菌群组成,增加有益菌如双歧杆菌、乳酸杆菌和阿克曼氏菌的相对丰度。
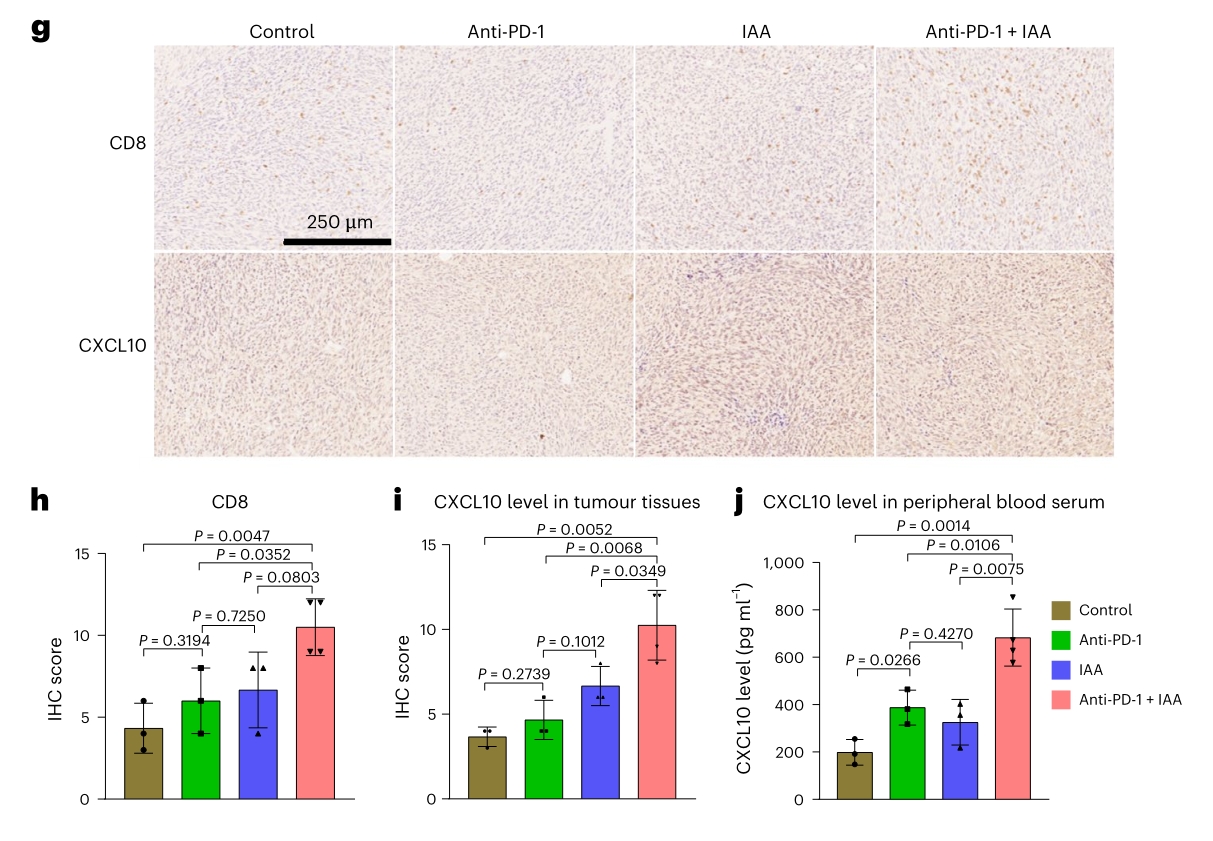
3. 联合治疗增加了肿瘤中CD8+T细胞的浸润,通过CXCL10-CXCR3通路促进CD8+T细胞的招募。肠道菌群耗竭和粪便菌群移植实验表明阿卡波糖的作用依赖于肠道菌群。
4. 血清代谢组分析显示,阿卡波糖改变了多种代谢途径,其中与色氨酸代谢相关的途径显著富集。靶向代谢组学分析表明,吲哚乙酸(IAA)在联合治疗组中显著增加,且与CD8+T细胞相关的趋化因子呈正相关。IAA可增强抗PD-1疗法的抗肿瘤效果,增加肿瘤中CXCL10的水平和CD8+T细胞的浸润。
参考文献
Zhang SL, Wang X, et al. Acarbose enhances the efficacy of immunotherapy against solid tumours by modulating the gut microbiota. Nature Metabolism. 2024
请扫描二维码阅读原文
END