文献解读
Nature重磅 | “心死”还能复生?抑制脂肪酸氧化可实现心脏再生!
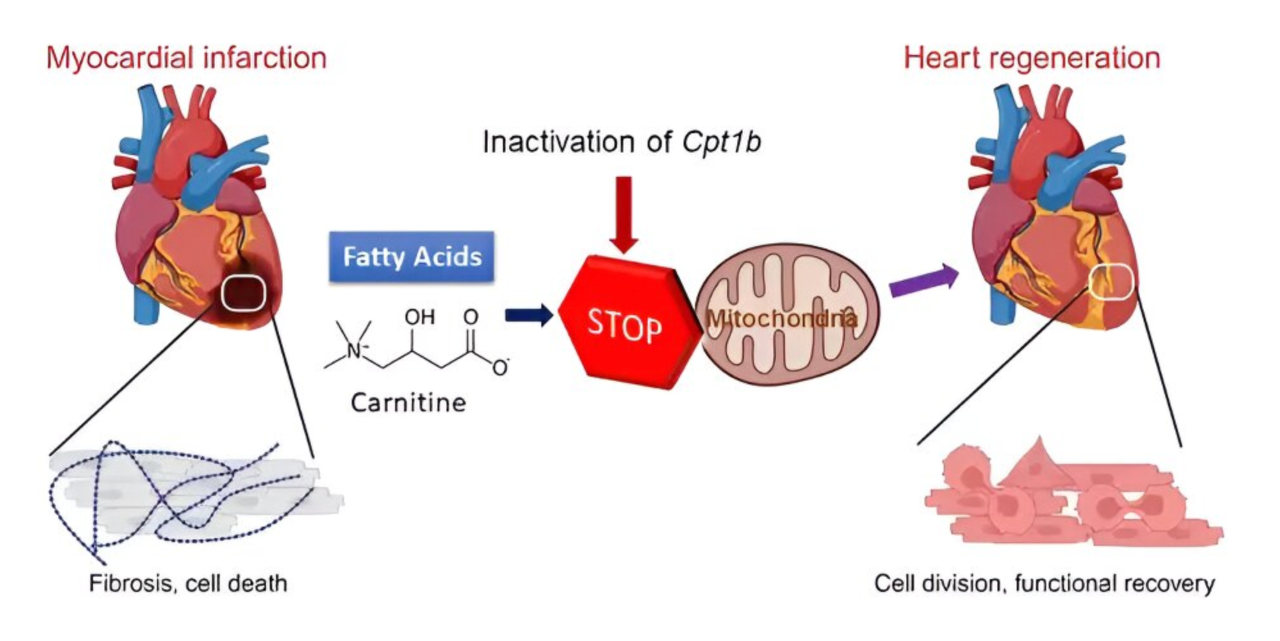
在出生后很短的时间内,人体心脏的心肌细胞(Cardiomyocytes,CMs)即发育成熟其特征是从糖酵解到脂肪酸氧化(FAO)、染色质重构和退出细胞周期的代谢转变,此后心脏就几乎完全丧失了再生能力。这意味着一旦发生心肌损伤,细胞无法再生修复,将导致心脏功能的永久性丧失。来自德国马克斯·普朗克心肺研究所袁学军研究员和Thomas Braun教授团队首次揭示,通过重塑心肌细胞的能量代谢方式,可逆转其表观遗传性状并解除其增殖障碍,从而实现心脏再生。这项开创性科学突破,有望为心肌梗死等心脏病带来全新治疗方法,该重磅科学成果发表于Nature。

技术路线

心脏能够再生的动物主要通过糖酵解方式将糖类作为CMs的燃料。人类心脏在发育早期阶段也是主要使用糖酵解,只是在出生后转向脂肪酸氧化。随着出生后心脏的能量代谢方式的转换, CMs的许多基因的活性发生了变化,其细胞分裂活性丧失。能量产生过程中的代谢物对调节基因活动的酶的活性发挥着重要作用。因此,研究者希望从这一能量代谢方式的转变中寻找促进心脏再生的方法,通过重新编程能量代谢来触发基因活动的改变,从而使CMs的细胞分裂能力得到恢复。
Cpt1b缺失的CMs成熟度降低
已报道肉碱棕榈酰基转移酶Cpt1b基因对小鼠的脂肪酸氧化至关重要,构建Cpt1b基因条件性敲除小鼠,让该基因在小鼠心肌细胞中特异性失活,从而抑制心肌细胞中的脂肪酸氧化。结果显示,在心肌细胞Cpt1b基因失活的小鼠中,小鼠的心脏再次开始生长,心脏中的心肌细胞数量几乎增加了一倍。

图1. Cpt1b缺失的CM成熟度降低
Cpt1b介导的脂肪酸氧化(FAO)阻断可促进心脏再生
随后,在Cpt1b敲除小鼠上诱导缺血-再灌注(I-R)损伤模型,诱导其心脏病发作。这种缺血-再灌注损伤模型可以与因冠状动脉闭塞而心脏被放置支架的心脏病人相似。而Cpt1b基因失活的效果非常显著——心肌梗死后常见的疤痕在几周后几乎消失,小鼠的心肌收缩能力也几乎恢复到了梗死前的水平。
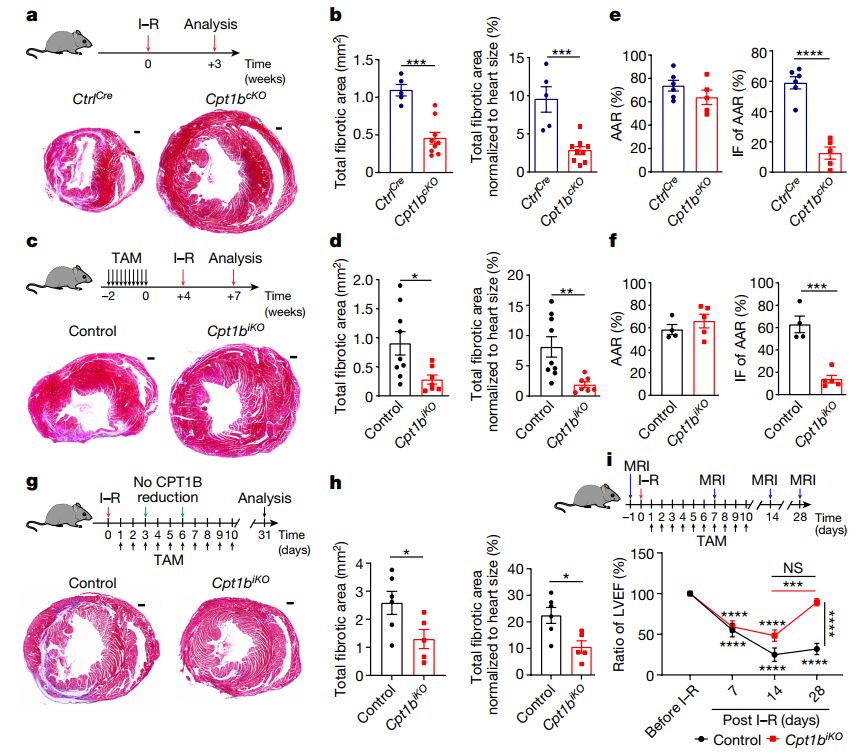
图2. Cpt1b介导的FAO阻断可促进心脏再生
FAO阻断可重塑CM的代谢并提高α-KG水平
研究团队进一步探究其背后机制,在Cpt1b基因失活的小鼠心肌细胞中进行代谢组学检测,发现由中链和长链脂肪酸衍生的酰基肉碱水平显著降低,而游离肉碱水平则显著增加,乙酰-CoA 和大多数三羧酸循环代谢产物(如柠檬酸、琥珀酸和苹果酸)水平并无显著变化,表明在阻断FAO的情况下,CMs 使用不同的能量生成方式。于是推测,葡萄糖氧化的增加在一定程度上补偿了Cpt1b缺失的CMs中FAO的损失,从而产生乙酰-CoA。
Cpt1b缺失的CMs中另一个潜在能量来源是氨基酸。检测到参与氨基酸循环的代谢物大量富集,包括氮循环和尿素循环。回补三羧酸循环的几种氨基酸的中间产物(如乙酰-CoA、琥珀酰-CoA 和富马酸)也有所增加。还发现支链氨基酸(BCAA)分解代谢产生的代谢物水平显著升高,包括α-酮异戊酸和α-酮-β-甲基戊酸。作为琥珀酰-CoA前体的丙酰基-CoA和甲基丙二酰基-CoA 的含量也有所增加。于是推测,在Cpt1b缺失的CMs中,葡萄糖氧化和BCAA分解代谢的增强有效地补偿了脂肪酸衍生的乙酰-CoA进入三羧酸循环的代谢通量的受损。
同时,在Cpt1b缺失的CMs中,α-酮戊二酸(α-ketoglutarate,α-KG)的水平增加了近20倍。由于谷氨酰胺和谷氨酸的浓度都没有下降,谷氨酰胺和谷氨酸直接转化为α-KG不足以解释α-KG的积累。相反,异柠檬酸水平显著降低,同时催化异柠檬酸转化为α-KG的IDH1、IDH2和IDH3A水平升高。还发现α-KG转化为琥珀酰-CoA的α-KG脱氢酶复合物的关键成分OGDH的酶活性降低。总之,抑制FAO后,合成增加和代谢减少协同作用,使CMs中的α-KG累积。
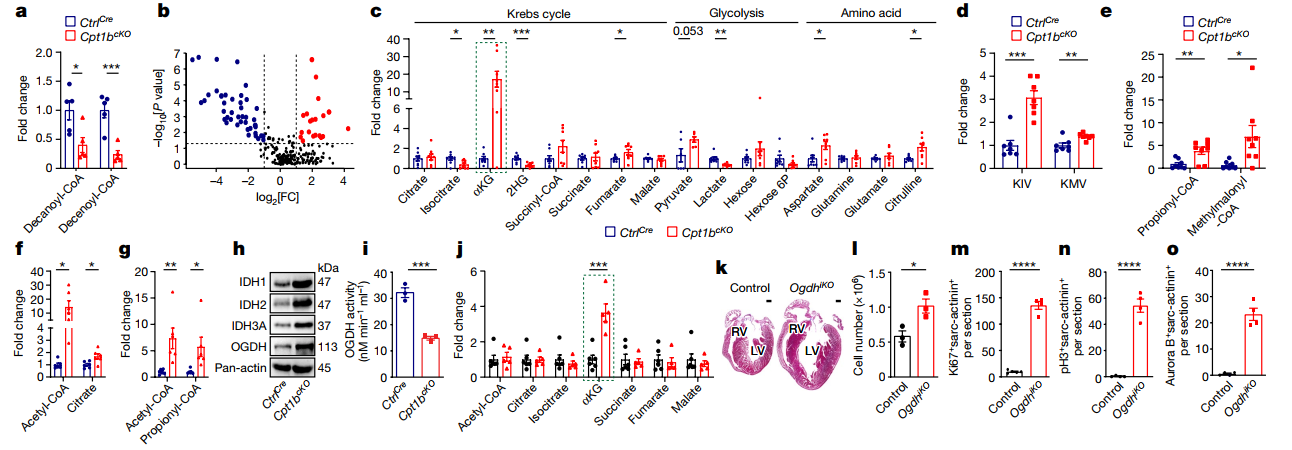
图3. FAO阻断可重塑CMs的代谢并提高α-KG水平
α-KG积累诱导H3K4me3去甲基化
α-KG是组蛋白去甲基化酶(包括赖氨酸去甲基化酶,KDMs)的重要辅助因子。研究者探究α-KG在Cpt1b缺陷CM中的积累是否会影响组蛋白甲基化。分析不同的组蛋白赖氨酸甲基化修饰,结果显示只有H3K4me3的水平降低。α-KG积累激活了 H3K4me3特异性去甲基化酶的活性,该酶随后清除了心脏分化和成熟所需的基因中的H3K4me3,从而使Cpt1b缺陷的CM转化为更不成熟、更适合增殖的状态。
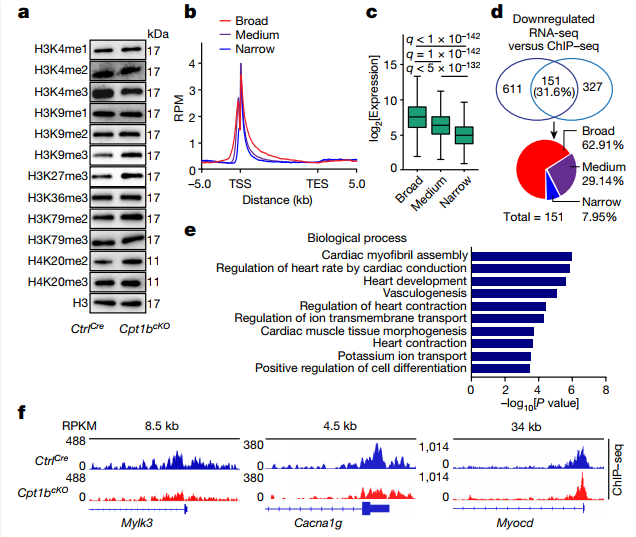
图4. αKG积累诱导H3K4me3去甲基化
α-KG积累激活KDM5促进增殖
用α-KG依赖性H3K4me3去甲基化酶KDM5(赖氨酸特异性去甲基化酶5) 的特异性抑制剂CPI-455或α-KG29的竞争性抑制剂 R2HG处理新生CM,可防止α-KG过表达诱导的细胞周期活性增强。Kdm5b的过表达实验表明,Kdm5b可显著降低 H3K4me3水平并增加CM细胞周期活性。通过RNA干扰敲除Kdm5b可有效拮抗α-KG的促增殖效应,逆转因α-KG处理而降低的H3K4me3水平,从而增加与CMs成熟相关的几个关键基因(Tnni3、Mylk3 和 Myocd)的表达。
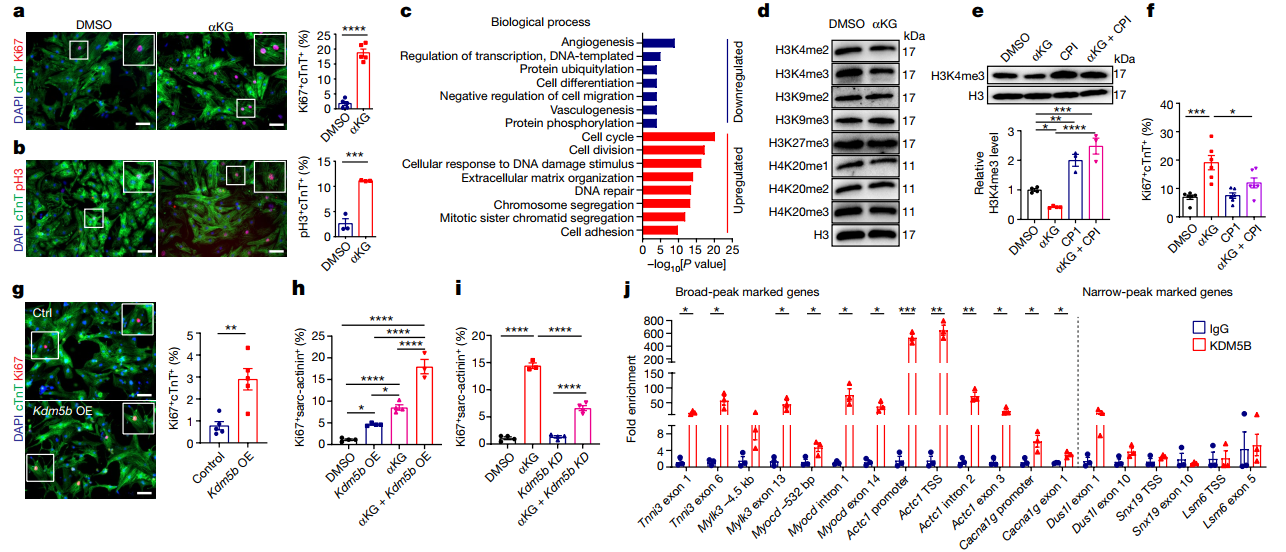
图5. α-KG积累激活KDM5促进增殖
小结
本研究通过Cpt1b突变使心肌细胞中的脂肪酸氧化失活可提高对缺氧的抵抗力,并刺激心肌细胞增殖,使缺血再灌注损伤后的心脏再生成为可能。在Cpt1b突变的心肌细胞中,能量代谢发生显著改变,α-酮戊二酸积累,导致赖氨酸去甲基化酶 KDM5被激活,促进心肌细胞的H3K4me3结构域去甲基化,从而降低其转录水平,使心肌细胞转入不太成熟的状态,从而促进增殖。提示通过药物阻断CPT1B酶(Cpt1b基因的表达产物)的活性,开发一种CPT1B酶的抑制剂,最终可能用于人类的治疗。
参考文献
Inhibition of fatty acid oxidation enables heart regeneration in adult mice. Nature. 2023
请扫描二维码阅读原文

绘谱帮你测
细胞乃至组织器官功能的代谢调控日益成为生物医学关注的科研热点,该研究涉及的三羧酸循环、脂肪酸、辅酶A、尿素循环等代谢物麦特绘谱均可检测。麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及咧咪衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章350+篇,累计影响因子4000+,平均IF>10,包括Science, Nature, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等顶级期刊。


