文献解读
Nature Cell Biology | 肠道细菌代谢物通过抑制铁死亡来促进结直肠癌
肠道菌群维持着新陈代谢的平衡,有证据表明,肠道微生物通过产生致癌代谢物参与肿瘤的发生和进展,但潜在机制尚不清晰。铁死亡(Ferroptosis)是一种铁依赖性的新型细胞程序性死亡方式,由过度堆积的过氧化脂质诱导发生,受到谷胱甘肽过氧化物酶4 (GPX4)、铁死亡抑制蛋白1 (FSP1)、四氢生物蝶呤(BH4)和二氢乳清酸脱氢酶(DHODH)的严格调控。越来越多的研究表明,铁死亡与癌症免疫治疗和肿瘤抑制有关,多种内源性代谢物可调节铁死亡。

2024年1月2日,山东大学初波教授、中国科学技术大学朱书教授、东南大学柴人杰教授、哥伦比亚大学顾伟教授在Nature Cell Biology在线发表题为“Gut microbial metabolite facilitates colorectal cancer development via ferroptosis inhibition”的研究论文,该研究首次揭示了肠道微生物厌氧消化链球菌Peptostreptococcus anaerobius(P. anaerobius)分解色氨酸产生吲哚-3-丙烯酸(IDA),通过抑制肿瘤铁死亡的发生促进结直肠癌的疾病进程,并明确潜在的分子机制:IDA作为芳香烃受体AHR的内源性配体,在转录水平上调ALDH1A3(乙醛脱氢酶1家族成员A3)的表达,ALDH1A3以视黄醛为底物产生NADH,NADH为FSP1催化产生还原性辅酶Q10提供原料,最终发挥抵抗铁死亡的作用。该研究为临床肿瘤铁死亡疗法的开发和应用提供了新的药物研究靶点和治疗策略。
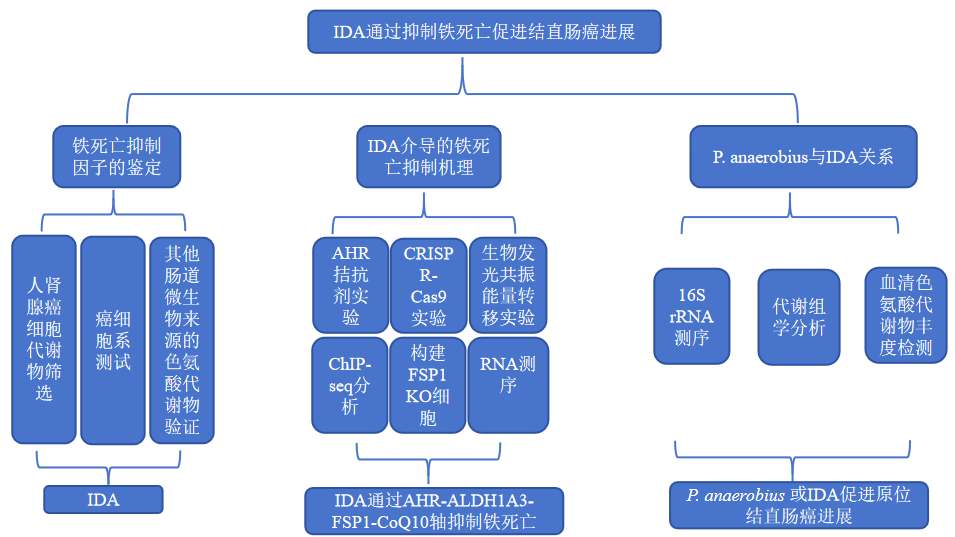
技术路线图
IDA是铁死亡抑制因子且可促进结直肠肿瘤发展
通过对786-O人肾腺癌细胞代谢物进行筛选,发现肠道微生物群色氨酸代谢产生的IDA可以显著抑制铁死亡。IDA处理的癌细胞对铁死亡具有强大的抗性,色氨酸其他代谢物则作用较弱。通过异种移植发现,IDA可显著降低了脂质过氧化水平并促进肿瘤进展。
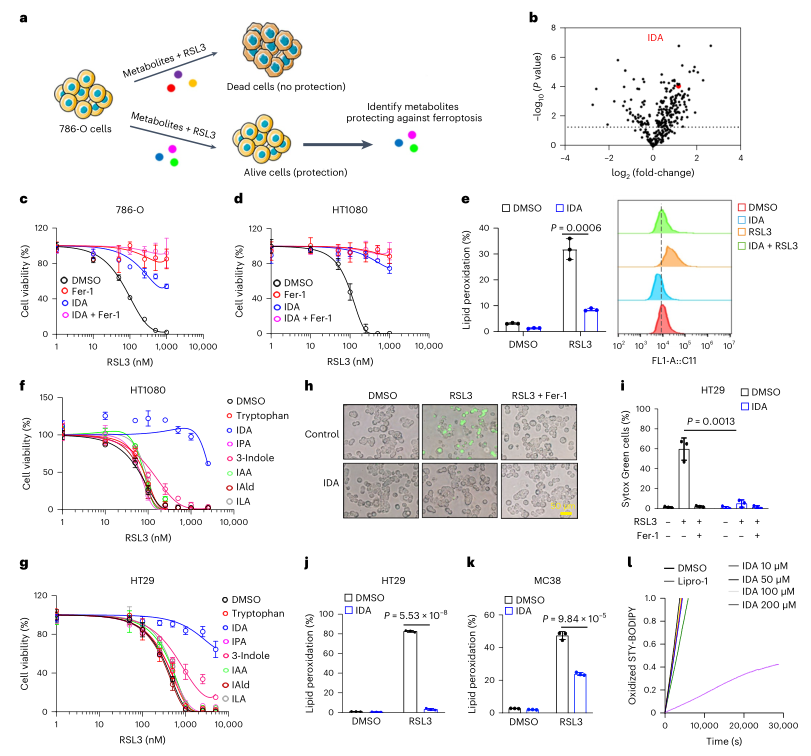
图1. IDA作为铁死亡抑制因子的鉴定
AHR和FSP1是IDA介导的铁死亡抑制所必需的
通过使用AHR拮抗剂以及敲除AHR,发现均可显著消除IDA调节的铁死亡抑制。由于FSP1利用NAD(P)H催化生成还原性辅酶Q10,保护细胞免于铁死亡。为了验证FSP1是否有助于IDA调节的铁死亡抗性,在HT29和HT1080细胞中生成了FSP1−/−克隆,发现两种细胞中FSP1的缺乏在很大程度上削弱了IDA- AHR轴的保护作用。接下来,通过非靶向脂质组学检测,发现IDA不影响磷脂含量。此外,在FSP1 KO细胞中,IDA的作用在很大程度上被消除,表明IDA-AHR轴介导的铁死亡抑制依赖于FSP1。
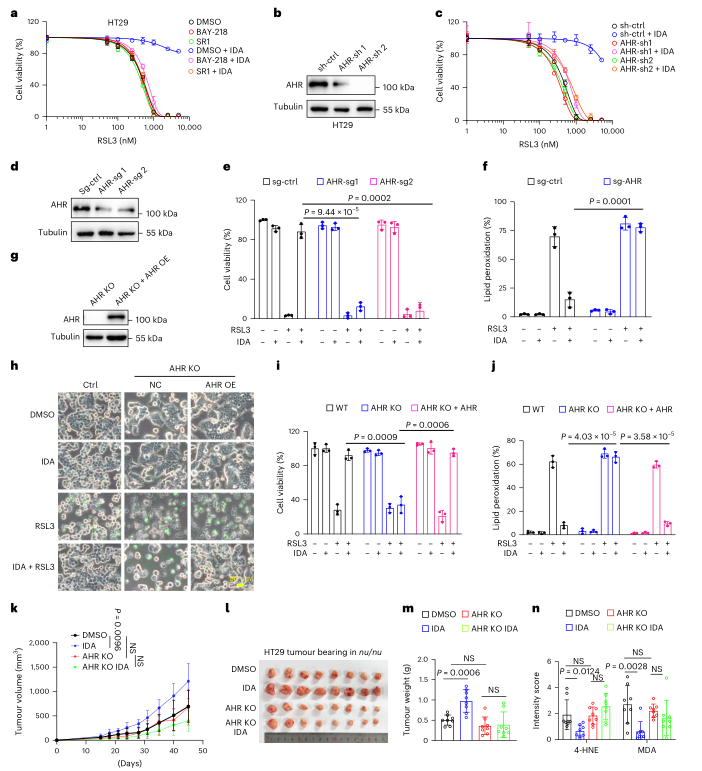
图2. AHR是IDA介导的铁死亡抑制所必需的
IDA通过AHR-ALDH1A3-FSP1-CoQ10轴抑制铁死亡
对IDA处理的HT29细胞进行RNA测序发现,ALDH1A3是显著上调,且NADH脱氢酶复合体途径在IDA处理的细胞中特异性富集。阻断ALDH1A3的表达,并检测铁细胞死亡的水平发现LDH1A3的缺失明显使细胞对脂质过氧化诱导的铁中毒敏感,还会会损害IDA抑制铁死亡的能力。并发现ALDH1A3的缺失大大抑制了肿瘤的进展,阻断了IDA促进的肿瘤生长。
体外实验表明,纯化的ALDH1A3可以通过视黄醛产生NADH,而ALDH1A3缺失显著降低了NADH水平。在ALDH1A3 KO细胞中补充NADH可恢复铁致细胞死亡。
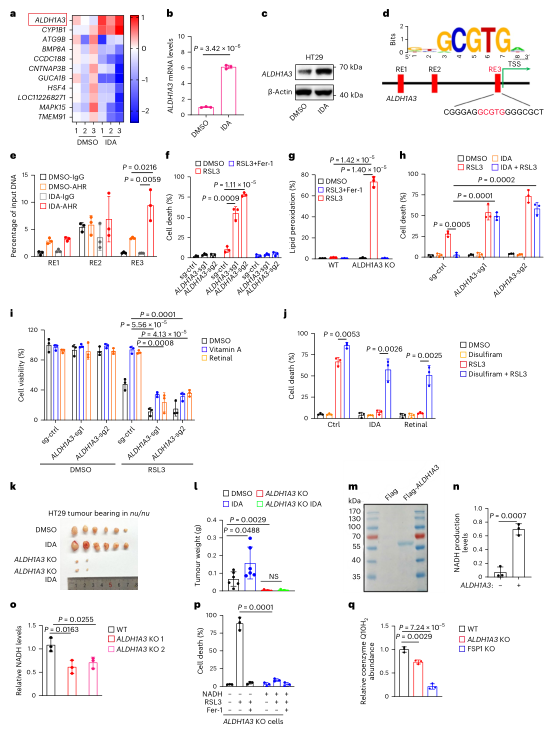
图3. IDA通过AHR-ALDH1A3-FSP1-CoQ10轴抑制铁死亡
P. anaerobius是IDA生物合成的主要因子
通过16S rRNA测序和代谢组学分析,发现P. anaerobius在CRC患者中显著富集,且CRC患者粪便中的IDA含量远高于健康人,该菌的丰度与粪便中的IDA水平呈正相关。之后,在厌氧条件下培养P. anaerobius,并使用液相色谱-质谱技术检测上清液中各种色氨酸衍生物的水平,结果发现该菌有效地利用色氨酸产生高水平的IDA和IPA 。此外发现添加P. anaerobius上清液的HT29细胞中,铁死亡明显受到抑制,ALDH1A3和CYP1A2水平显著升高。进一步在体内进行了P. anaerobius的瘤内注射,检测肿瘤内IDA浓度(约5μM)有效降低CRC铁死亡,说明IDA的生理浓度足以消除体内脂质过氧化和铁死亡。
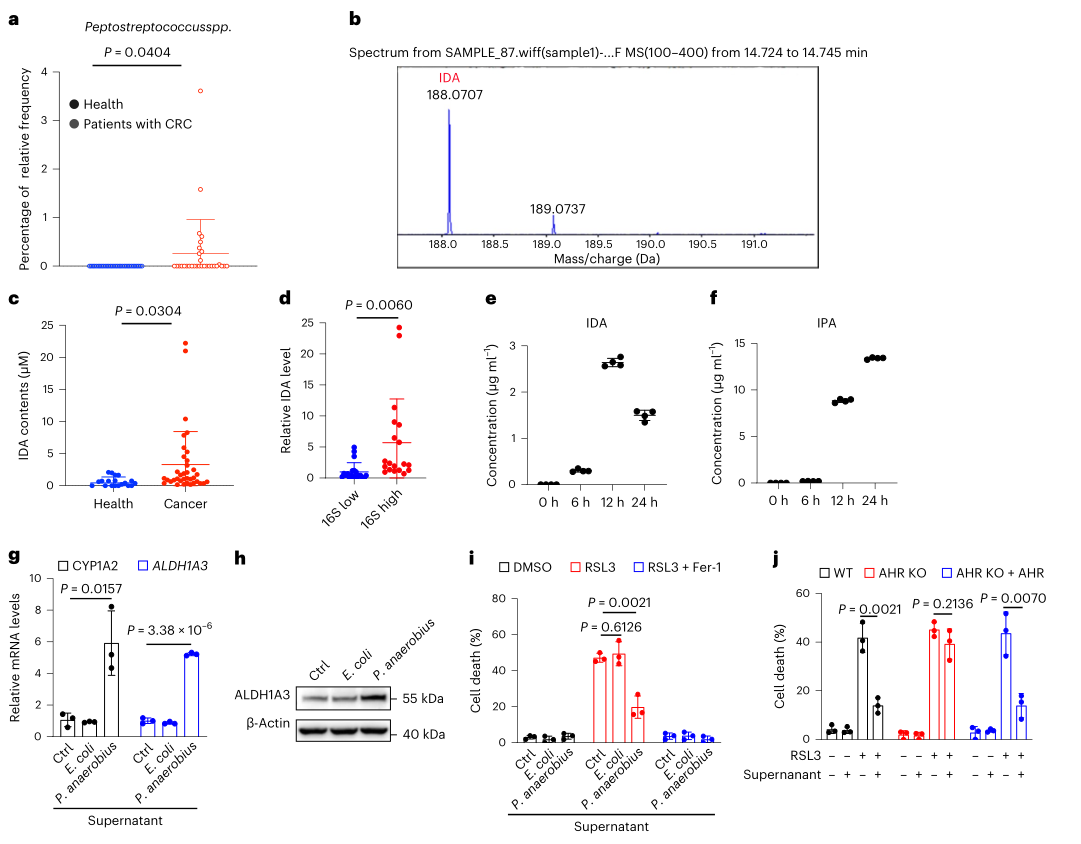
图4. P. anaerobius是IDA生物合成的主要因子
P. anaerobius或IDA促进原位结直肠癌进展
为了探讨P. anaerobius介导的CRC发展是否依赖于IDA,对小鼠进行灌胃P. anaerobius 72h后检测血清色氨酸代谢物的丰度,发现IDA和IPA显著增加,表明P. anaerobius在体内负责IDA的生物合成。此外,经IDA处理的ApcMin/+小鼠显示出明显更高的肿瘤多样性。接下来,建立AOM/DSS结肠炎相关癌症模型,发现IDA和P. anaerobius显著促进结肠炎诱导的CRC进展。临床发现AHR的高表达与CRC患者临床预后差呈正相关。IHC和Western blotting分析一致显示,AHR和ALDH1A3在人类CRC样本中表达更高,结直肠癌中脂质过氧化水平较低。总之,研究表明IDA-AHR-ALDH1A3-FSP1通路通过抑制铁死亡促进结直肠癌的发展。
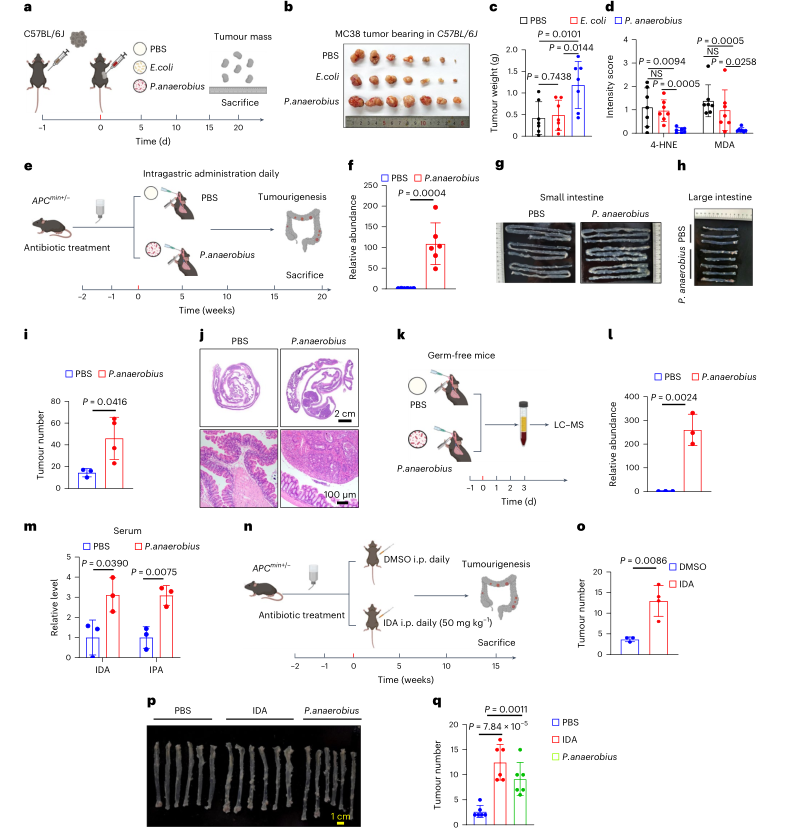
图5. P. anaerobius或IDA促进原位结直肠癌进展
参考文献
Cui W, Guo M, Liu D, et al. Gut microbial metabolite facilitates colorectal cancer development via ferroptosis inhibition. Nat Cell Biol. 2024.
请扫描二维码阅读原文

绘谱帮你测
麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。针对上文提到的吲哚-3-丙烯酸(IDA)和3-吲哚丙酸(IPA)等色氨酸代谢物,麦特绘谱拥有Q1000、Q500、Q300、Q200和胆汁酸、能量代谢、一碳代谢和还原糖等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章300+篇,累计影响因子3000+,平均IF> 10,包括Science, Nature, Cell Metabolism,Immunity, Gut, Hepatology, Microbiome等顶级期刊。


