文献解读
绘谱导读 | 2022年9月代谢组学文献精选
导读目录
1. Cell Metabolism | 膳食脂质抑制线粒体向巨噬细胞的转移导致脂肪细胞线粒体释放入血液
2. Cell Reports | 早期维生素B12通过SBP-1/SREBP1协调脂质过氧化以确保秀丽隐杆线虫生殖成功
3. Cell Metabolism | Warburg样代谢转化引起散发性AD神经变性
4. Gastroenterology | 炎症性肠病与代谢途径的诊断前紊乱相关
5. Cell | 大规模家庭健康对照配对研究揭示肠道菌群与多发性硬化疾病风险和病程的关联
6. Science Immunology | 菌群衍生物TMAO驱动胰腺癌免疫激活并增强其对免疫检查点阻断的反应
7. Nature Communications | 乳酸增加CD8+T细胞的干性从而增强抗肿瘤免疫
8. Cell Stem Cell | 肝细胞色素P450 8B1和胆汁酸通过抑制肠干细胞更新增强结肠炎肠上皮损伤
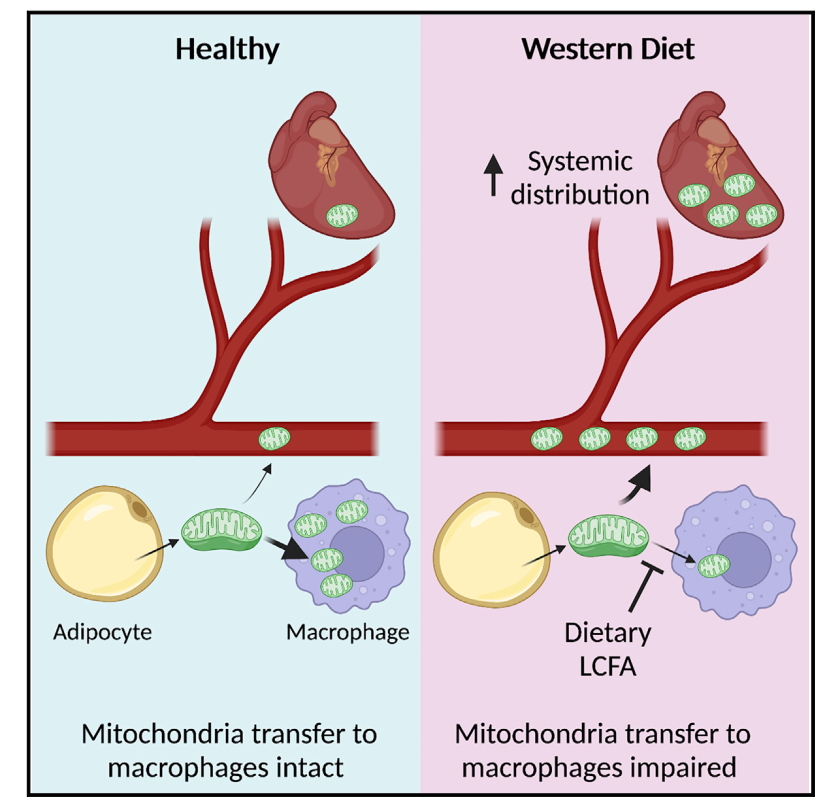
一、Cell Metabolism|膳食脂质抑制线粒体向巨噬细胞的转移导致脂肪细胞线粒体释放入血液

肥胖状态下,巨噬细胞被证实是调节脂肪细胞功能和全身代谢稳态的关键因子。已有研究发现线粒体胞间转移(IMT)有助于维持机体代谢稳态,但肥胖状态下IMT受损的分子机制仍不清楚。本研究发现长链脂肪酸可抑制脂肪细胞来源的线粒体向巨噬细胞传递,同时促使脂肪细胞释放的线粒体进入血液循环系统并转运至机体其它器官和组织。
1. 作者利用之前构建(mitoFat,mtD2F/+AdipoqCre+/-)小鼠建立年龄诱导和高脂饮食诱导的肥胖两种小鼠模型,发现IMT表现出一定的组织特异性,但三种脂肪组织中均存在脂肪细胞向多种免疫或非免疫细胞的线粒体转移且以脂肪细胞-巨噬细胞为主。
2. 比较后发现,不同于饮食诱导的肥胖小鼠,老年肥胖小鼠脂肪组织内的IMT并无异常。两种高脂饮食(Lard-HFD和hydrogenated coconut oil (HCO)-HFD)诱导的肥胖小鼠中,仅Lard-HFD小鼠的eWAT中脂肪细胞与其它细胞间的IMT显著降低。
3. 接着构建了巨噬细胞摄取线粒体的体外模型,结合不同的脂肪酸处理,发现仅长链脂肪酸(如棕榈酸、硬脂酸等)对巨噬细胞摄取线粒体具有显著抑制作用,且该作用依赖于硫酸乙酰肝素但不依赖于脂肪酸转运蛋白CD36。
4. 接着发现血液中脂肪细胞来源的线粒体以完整的裸露的线粒体为主,同时存在小部分胞外囊泡包裹的线粒体,相比正常饮食小鼠,Lard-HFD小鼠血液中脂肪细胞来源线粒体显著增多,且在心脏中可发现线粒体荧光信号。但HCO-HFD小鼠与正常饮食小鼠并无显著差异。最后通过药物干预实验进一步证实巨噬细胞是调控脂肪细胞来源的线粒体释放进入血液的关键调控因子。
参考文献
Dietary lipids inhibit mitochondria transfer to macrophages to divert adipocyte-derived mitochondria into the blood. Cell Metabolism. 2022.
请扫描二维码阅读原文

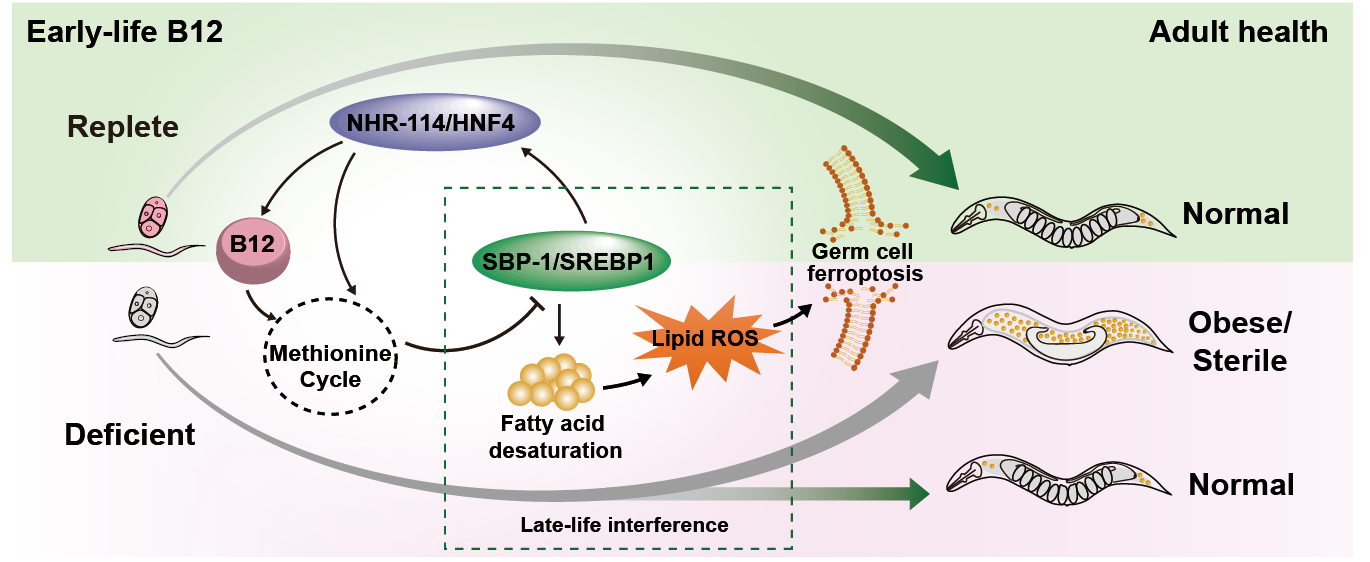
二、Cell Reports | 早期维生素B12通过SBP-1/SREBP1协调脂质过氧化以确保秀丽隐杆线虫生殖成功

维生素B12 (B12)是生物体必需的一种微量营养素,须通过一些外源性的食物获取。近期临床研究发现,母亲在妊娠期缺少B12会诱发婴儿后续产生胰岛素抵抗、脂质代谢异常等代谢紊乱,说明生命早期B12的缺乏会导致成年后代谢性疾病的发生。本研究在秀丽隐杆线虫中发现生命早期B12的缺乏会引起成年期肥胖或生殖缺陷。
1. 首先他们在线虫中观察到生命早期B12的缺乏会导致成年线虫脂质水平升高和生殖能力显著下降。在母亲线虫摄入充足的B12之后,即使子代线虫不做干预,其成年后的脂质含量和生殖能力也能恢复至正常水平。同时发现只有在生命早期发育阶段补充B12,线虫的脂肪水平和生殖能力才能恢复正常。
2. B12是甲硫氨酸循环代谢途径中的关键辅因子。本研究证实甲硫氨酸循环-SBP-1/SREBP1信号通路参与了B12跨时空调控生命体代谢与生殖的过程,阻断甲硫氨酸循环会激活固醇调节元件结合蛋白SBP-1/SREBP1,引起线虫的脂质水平显著升高。生命早期B12缺乏使内源性长链多不饱和脂肪酸水平升高,造成机体毒性脂质过氧化物的累积,进而诱发了生殖细胞的铁死亡,导致了线虫的生殖缺陷。
3. 在发育后期利用RNA干扰技术阻断SBP-1/SREBP1和脂质合成通路,或者向线虫补充铁死亡抑制剂,都可以部分挽救B12缺乏线虫的生殖缺陷,因此有望成为相关成年期代谢疾病的治疗靶标。
参考文献
Early-life vitamin B12 orchestrates lipid peroxidation to ensure reproductive success via SBP-1/SREBP1 in Caenorhabditis elegans. Cell Reports. 2022.
请扫描二维码阅读原文

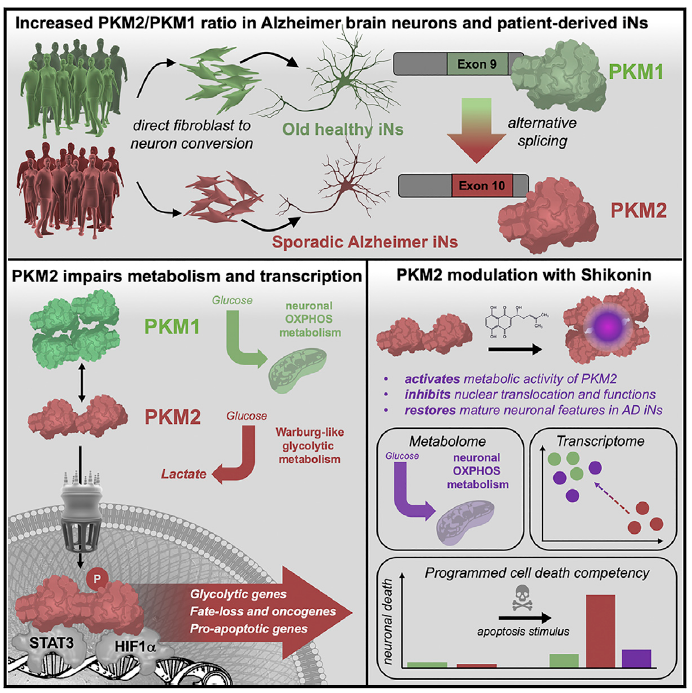
三、Cell Metabolism | Warburg样代谢转化引起散发性AD神经变性

阿尔茨海默病(AD)是最常见的痴呆症,对于散发性阿尔茨海默病(AD)的驱动因素仍未知,本研究利用AD患者源性成纤维细胞的直接转化诱导神经元(iNs),发现糖酵解酶丙酮酸激酶M (PKM)向癌症相关PKM2亚型的病理转换,使AD iNs发生代谢和转录变化,这有助于理解AD的年龄依赖性进展,并为AD治疗策略提供新方向。
1. 从11名AD和11名非AD对照中获得punch活检和真皮成纤维细胞培养,使用基于转录因子的直接神经元转换策略过表达转录因子Ascl1和Ngn2并从供体成纤维细胞中生成皮质iNs;
2. 对纯化iNs进行全转录组RNA-seq通过加权基因相关网络分析(WGCNA)和基因集富集分析(GSEA),GSEA表明iNs和脑AD模块存在大量功能重叠,PKM的异常代谢和表观遗传调节可能驱动AD神经元的致病改变;
3. 通过LC-MS检测PKM诱导的AD iNs代谢重编程,使用整合分子途径水平分析(IMPaLA)对转录组和代谢组数据进行整合,代谢组数据提示AD iNs中Warburg样代谢转向糖酵解,PKM2亚型降低代谢活性,PKM2失衡导致糖酵解代谢物积累和乳酸产量增加;
4. Warburg样代谢转变是通过PKM2缺乏代谢活性、核易位及与STAT3和HIF1a的结合来促进神经元命运损失,PKM2调节剂紫草素可阻止核易位,恢复成熟神经元代谢,逆转AD特异性基因表达变化,并重新激活神经元对细胞死亡的恢复能力。
参考文献
Warburg-like metabolic transformation underlies neuronal degeneration in sporadic Alzheimer’s disease. Cell Metabolism. 2022.
请扫描二维码阅读原文

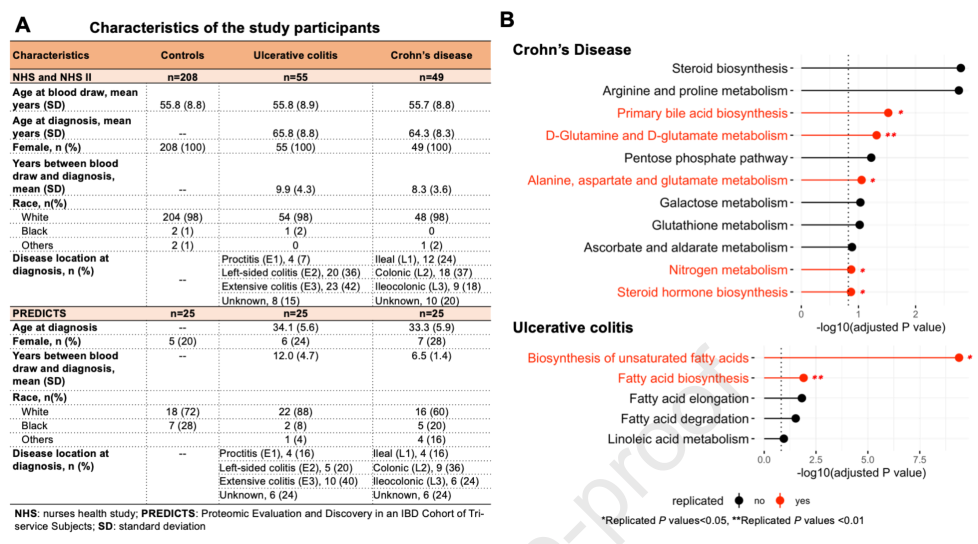
四、Gastroenterology | 炎症性肠病与代谢途径的诊断前紊乱相关

代谢组学分析已然成为连接不同生物途径与疾病表型的机制桥梁的新方法,循环代谢物整合了环境、遗传和微生物组数据,可作为复杂疾病的潜在标志物,炎症性肠病(IBD)中过去报道多见于诊断后研究,但对于诊断前代谢物和代谢途径与IBD风险之间的关系未见报道。本研究纳入IBD诊断前的血清和血浆样本进行代谢组学分析,将为IBD的发病机制提供深入见解,并为IBD的预防提出可行性策略。
1. 研究纳入前瞻性队列NHS和NHSII的104例IBD (49例克罗恩病(CD)和55溃疡性结肠炎(UC))与208巢式病例对照作为发现集,25 CD,25 UC和25例对照作为验证集进行代谢组学检测,使用logistic回归评估了462个注释代谢物的特异性关联,并使用Mummichog对未注释代谢物(n= 5623)进行功能分析,较高的诊断前可的松水平与较低的乳糜泻发生率相关([OR]=0.42 / SD);
2. 发现和验证队列中,初级胆油酸生物合成、氨基酸和氮代谢及类固醇激素生物合成等代谢途径的改变与乳糜泻相关,大多数胆汁酸和类固醇激素生物合成代谢产物与较低的乳糜泻发生率显著相关,而大多数D-谷氨酰胺和D-谷氨酸、丙氨酸、天冬氨酸和谷氨酸及氮代谢产物与较高的乳糜泻发生几率相关;
3. 与对照组相比,UC患者诊断前血浆样本的不饱和脂肪酸生物合成和脂肪酸生物合成通路均发生了显著改变,并在predicts中得到了验证,膳食脂肪酸摄入量高与UC风险呈负相关。
参考文献
Inflammatory Bowel Disease is Associated with Prediagnostic Perturbances in Metabolic Pathways. Gastroenterology. 2022.
请扫描二维码阅读原文

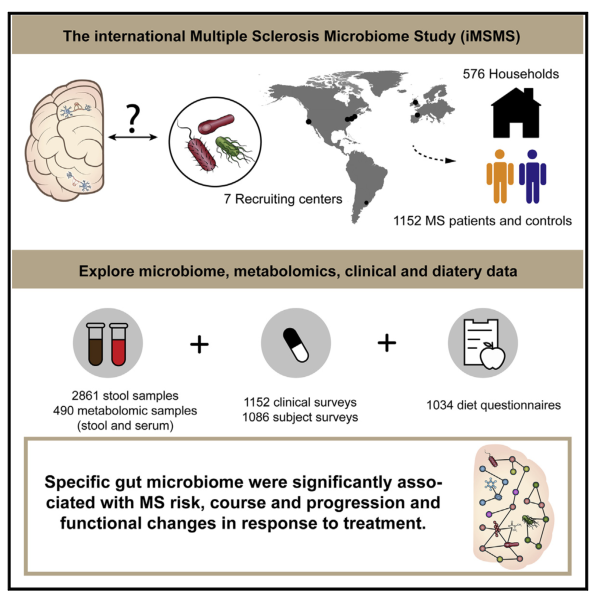
五、Cell | 大规模家庭健康对照配对研究揭示肠道菌群与多发性硬化疾病风险和病程的关联

近年研究显示多发性硬化(MS)与肠道菌群相关。然而这些研究样本量相对较小,且对混杂因素的评估不够充分。国际多发性硬化症微生物组研究 (iMSMS)团队开展一项大型多中心研究,揭示多发性硬化症患者的肠道菌群组成与MS风险、病程和治疗及饮食的联系。
1. 纳入576对(1152人)MS患者及其无遗传关联的家庭健康对照的配对进行肠道菌群分析,结果显示,MS患者的肠道菌群发生改变,其中Akkermansia muciniphila等16个菌种显著增加,Faecalibacterium prausnitzii等7个菌种显著降低;
2. 将MS严重程度评分(MSSS)和肠道菌群进行相关性分析,结果表明多个菌种与MSSS显著相关;功能分析显示,与健康对照相比,未治疗的MS患者植酸盐降解途径富集,而产丙酮酸的碳水化合物代谢途径则在健康对照组中富集;
3. 进行微生物网络分析发现在未治疗的MS患者和健康对照中微生物网络不同;不同治疗方法,患者菌群的组成和功能及代谢物各不相同。代谢组学结果表明,有31个代谢物在未接受疾病修饰治疗(DMT)和接受DMT治疗的患者之间存在显著差异;
4. 干扰素-β组患者的血液中的丙酸显著上升,乙酸和丁酸也有类似的趋势。干扰素-β的疗效可能部分与SCFA转运体上调有关;特定细菌与饮食成分的摄入存在显著关联。
参考文献
Gut microbiome of multiple sclerosis patients and paired household healthy controls reveal associations with disease risk and course. Cell. 2022.
请扫描二维码阅读原文

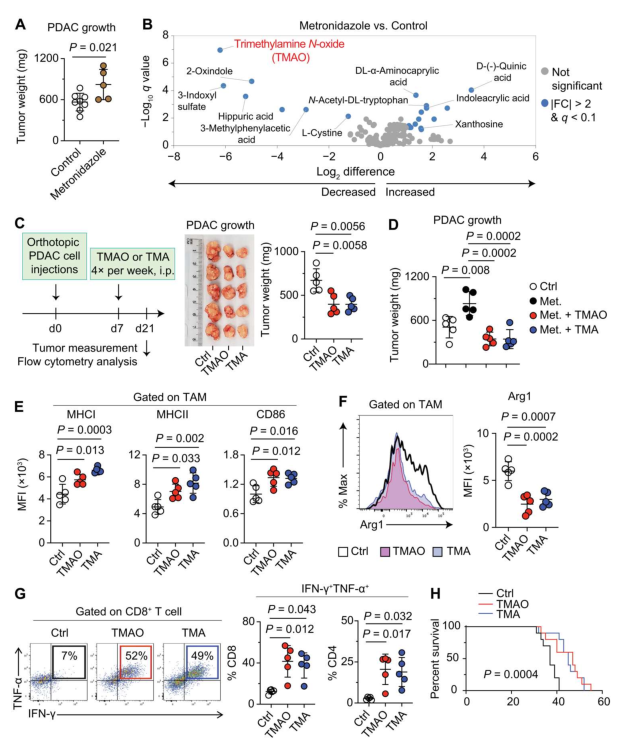
六、Science Immunology | 菌群衍生物TMAO驱动胰腺癌免疫激活并增强其对免疫检查点阻断的反应

尽管胰腺肿瘤表现出显著的免疫细胞浸润,但免疫治疗至今未能改善胰腺导管腺癌(PDAC)患者的临床预后。本研究揭示菌群代谢物氧化三甲胺(TMAO)可以驱动PDAC的免疫激活,增强PDAC对免疫检查点阻断治疗的响应。
1. 首先发现抗生素甲硝唑处理会增加PDAC小鼠肿瘤负荷;血清代谢组学显示,甲硝唑处理后,TMAO降低最显著;腹腔注射TMAO或TMA (TMAO前体)可显著降低PDAC小鼠肿瘤大小,甲硝唑引起的肿瘤负荷增加可通过给予TMAO或TMA逆转;
2. 给PDAC小鼠补充膳食胆碱,血清代谢组学显示,TMAO和TMA水平增加,肿瘤负荷降低;补充胆碱后再甲硝唑处理则降低血清中胆碱依赖性TMAO和TMA的水平,并降低补充胆碱的抗肿瘤作用;
3. 采用将胆碱降解为TMA的酶CutC/D的抑制剂处理后,增加PDAC小鼠肿瘤负荷,免疫细胞的免疫刺激表型降低,提示TAMO诱导的免疫激活表型与CutC/D活性相关;RNA-seq和单细胞转录组结果表明,TMAO驱动浸润免疫细胞向抗肿瘤转录谱变化,调节性T细胞反应受到限制,抗肿瘤的效应T细胞得到促进。
4. 机制上,TMAO增强I型干扰素(IFN)途径,诱导免疫刺激性肿瘤相关巨噬细胞表型、激活肿瘤微环境的效应T细胞;TMAO联合免疫检查点阻断疗法能显著降低PDAC小鼠的肿瘤负荷,改善生存率;含CutC(产生TMAO前体的酶)的细菌水平与PDAC患者的长期生存和黑色素瘤患者对anti-PD1反应改善相关。
参考文献
The microbiome-derived metabolite TMAO drives immune activation and boosts responses to immune checkpoint blockade in pancreatic cancer. Sci Immunol. 2022.
请扫描二维码阅读原文

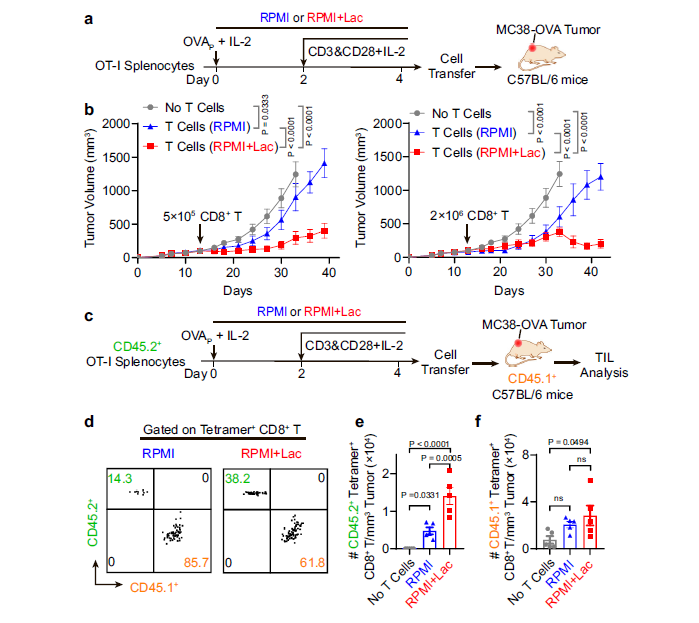
七、Nature Communications | 乳酸增加CD8+T细胞的干性从而增强抗肿瘤免疫

乳酸(Lactate)是葡萄糖糖酵解代谢途径的关键代谢产物,曾经一直被认为是骨骼肌在运动过程中碳水化合物发酵或厌氧糖酵解产生的代谢废物,但后来被证明其也是许多细胞的能源物质。已有研究发现乳酸在糖酵解性肿瘤中具有免疫抑制功能,但其对CD8+T细胞免疫功能的影响尚不清楚,本研究发现乳酸盐可以促进CD8+T细胞的干细胞样特性,从而在癌症治疗中发挥抗肿瘤免疫作用。
1. 首先用皮下注射乳酸钠溶液治疗荷瘤小鼠,并使用葡萄糖溶液作为对照。结果显示,相比葡萄糖,乳酸盐治疗显着抑制了肿瘤生长。继续在肿瘤微环境中的三个主要免疫细胞群(CD8+T细胞,CD4+T细胞和巨噬细胞)上测试免疫细胞依赖性。发现只有CD8+T细胞的阻断消除了乳酸盐的抗肿瘤作用。这些结果表明,乳酸盐的抗肿瘤效应可能是 CD8+T细胞介导的。
2. 研究者结合了两种免疫治疗方案,其中包括抗 PD-1 作为检查点阻断治疗,或 PC7A 纳米疫苗用于 T 细胞治疗的 3种小鼠肿瘤模型。结果表明乳酸盐通过体内的 CD8+ T 细胞增强免疫疗法的疗效。
3. 接着使用单细胞RNA测序的方法分析了多个肿瘤模型,对肿瘤浸润 CD8+T细胞的基因集富集分析显示,乳酸处理诱导了T细胞功能和信号相关基因以及相关信号通路的显著上调。此外,11个 CD8+T细胞亚群在抗肿瘤免疫应答过程中遵循从 naïve 到耗竭状态的典型分化过程。统计分析表明,乳酸盐处理后肿瘤内部的干细胞样T细胞亚群的细胞数量一致增加,而各耗竭细胞群的反应则各不相同。
参考文献
Lactate increases stemness of CD8 + T cells to augment anti-tumor immunity. Nat Commun. 2022.
请扫描二维码阅读原文

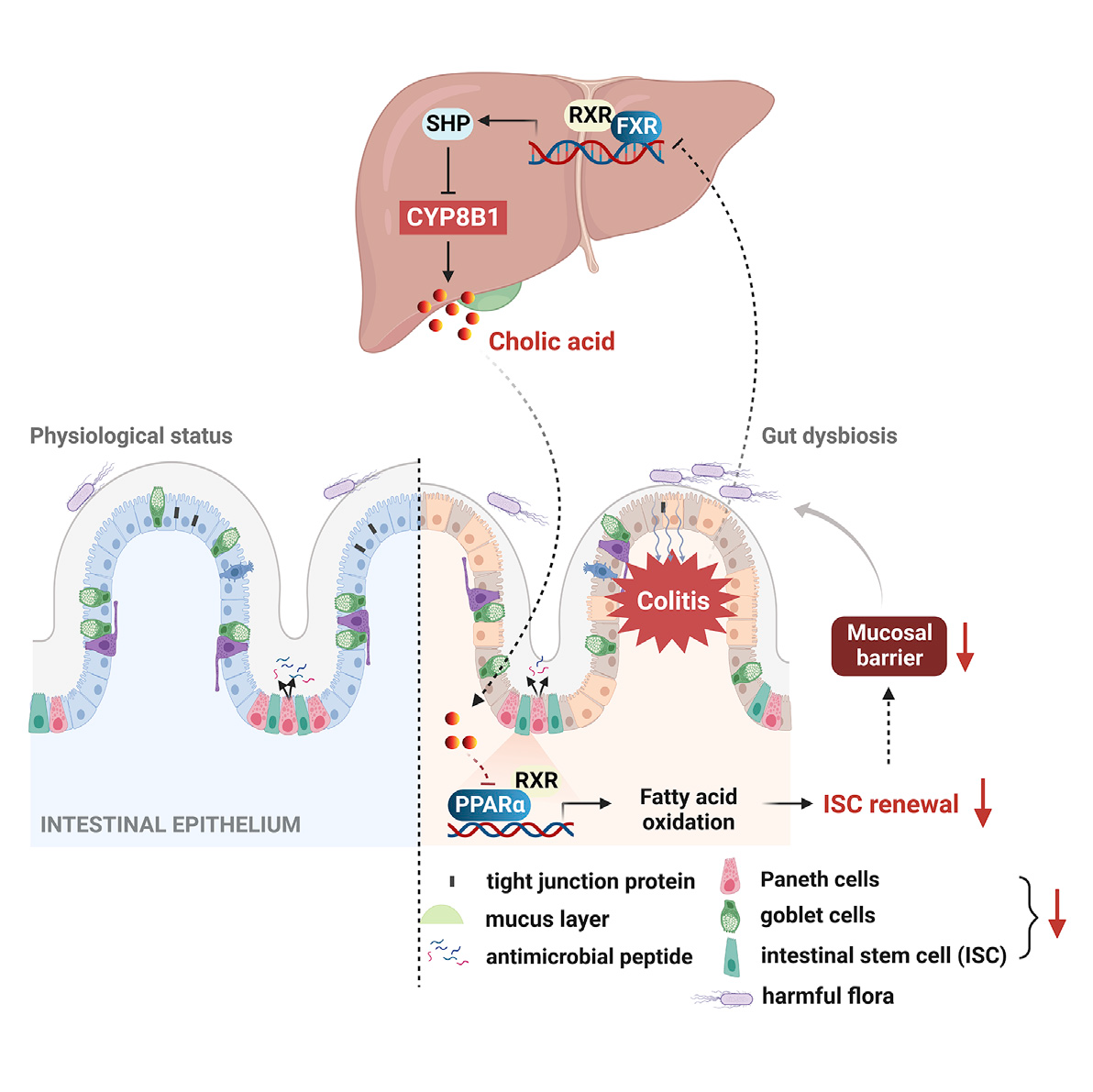
八、Cell Stem Cell | 肝细胞色素P450 8B1和胆汁酸通过抑制肠干细胞更新增强结肠炎肠上皮损伤
.png)
肠上皮屏障损伤在炎症性肠病(IBD)细胞和分子发病机制研究中备受关注。肠上皮屏障结构和功能的完整性依赖稳定更新的上皮细胞和具有正常功能的细胞旁通路。胆汁酸主要通过法尼醇X受体(FXR)和G蛋白偶联胆汁酸受体1(TGR5)调节机体能量代谢和免疫功能等。已有研究认为胆汁酸也是肠上皮屏障功能的重要调控物质,但机制尚不清晰。本研究揭示了肝脏CYP8B1-CA轴通过调节肠上皮再生与结肠炎之间的联系,表明基于BA的策略可能有利于IBD的治疗。
1. 代谢组学分析发现活动期IBD患者和结肠炎小鼠体内胆汁酸代谢紊乱,胆酸(CA)水平显著上调,且肝脏胆汁酸经典合成途径代谢酶CYP8B1出现过度活化。外源补充CA或过表达CYP8B1均能够加重小鼠IBD表型、损伤肠道屏障及其修复功能,而干扰CYP8B1的表达则可促进肠道炎症缓解,恢复肠上皮再生能力。
2. 隐窝肠道干细胞(Lgr5+ISC)的自我更新在维持肠稳态、抵御微生物入侵中发挥重要作用。研究者分离结肠炎小鼠的肠道隐窝干细胞进行体外培养,发现病理浓度的CA显著减弱结肠炎小鼠隐窝中类器官的出芽和传代能力,并直接抑制Lgr5+ISC的增殖。
3. 进一步的RNA-Seq和代谢组学分析发现,CA可抑制结肠炎小鼠隐窝的脂肪酸氧化(FAO)过程及PPARα信号通路。研究通过肠特异性敲除Pparα的结肠炎小鼠证实了CYP8B1-CA代谢轴通过抑制PPARα介导的FAO,削弱 Lgr5+ISC的更新能力,加重肠道屏障损伤。
4. 最后应用FXR激动剂奥贝胆酸(OCA)间接抑制结肠炎小鼠体内CYP8B1的活性,可促进其 Lgr5+ISC的增殖和传代能力,验证了肝脏FXR-CYP8B1-CA代谢轴在IBD中的重要作用。
参考文献
Hepatic cytochrome P450 8B1 and cholic acid potentiate intestinal epithelial injury in colitis by suppressing intestinal stem cell renewal. Cell Stem Cell. 2022.
请扫描二维码阅读原文

往期推荐



