文献解读
Cell | 代谢分析加速疾病的发现、诊断和治疗
代谢异常会导致组织功能障碍,代谢已成为疾病研究的桥梁,从细胞器到人群的代谢研究新技术层出不穷。美国德克萨斯大学西南医学中心HHMI研究员Ralph J. DeBerardinis和纪念斯隆-凯特琳癌症中心Kayvan R. Keshari在《Cell》发表前瞻性综述回顾用于细胞器和少量细胞类型的小规模代谢组学技术,探索细胞如何应对代谢压力的功能筛选及非侵入性评估疾病代谢扰动的成像方法等代谢分析最新进展,并讨论了代谢组学如何提供信息丰富的表型信息,以补充遗传和非遗传疾病的基因组分析,概述了阐明人类疾病的生化认知所面临的挑战。
一. 小规模代谢组学–评估细胞亚群中的代谢物水平
大体积组织的代谢组学为疾病的代谢紊乱提供了丰富的认知,但了解复杂微环境中单个细胞的代谢对理解发病机制仍至关重要。首先,同一组织内的不同细胞类型具有特殊的代谢特性;其次,细胞在微环境中的位置会影响它们的代谢如近血供丰富对肿瘤内癌细胞代谢的影响;第三,干细胞和祖细胞等稀有细胞在代谢上与组织的其余部分不同,批量分析很难推断出它们的代谢活动;第四,在单个细胞内,代谢也被细胞器和其他结构划分以实现精确调节。
单细胞和稀有细胞群代谢
传统的代谢组学方法往往需要105~106个细胞,小规模代谢组学主要用于表征稀有细胞群,稀有细胞可以在低温下通过流式细胞仪快速富集后进行质谱分析,在造血干细胞和循环肿瘤细胞中产生多达 160 种代谢物。代谢组学技术可以与超灵敏代谢通量测量如用超极化核磁共振 (NMR)进行同位素示踪相结合,在少至 9000 个细胞中进行通量测量,并可应用到流式分选癌症干细胞的研究中,加深了对代谢物周转定量速率的理解。单细胞RNA 测序可以确定复杂组织内代谢相关基因的水平,细胞计数/飞行时间 (TOF) 质谱 (CyTOF) 等蛋白质组学方法为免疫细胞群内的代谢异质性提供了更丰富的认识,利用光学方法使用FRET传感器来量化如氨基酸和氧化还原辅因子等代谢物。内源性代谢物的传统光学成像(如双光子显微镜)提供了一种无探针策略,可用于氧化还原辅因子如烟酰胺腺嘌呤二核苷酸 NAD(H) 和黄素腺嘌呤二核苷酸 (FADH),若将其与空间质谱成像(MSI)相结合可能有助于评估小规模应用中的实时通量。
空间分辨代谢组
利用现代质谱的高灵敏度与光栅扫描串联生成空间代谢组学数据,基质辅助激光解吸电离(MALDI)已成为最广泛使用的空间质谱方法,空间分辨率 (50-100 μm)限制了真正的单细胞分析,将其应用于推断单细胞测量的组织切片,将是进一步发展的关键领域。使用MALDI进行空间分辨MSI有助于在正常脑功能和疾病状态下评估新的代谢。在鳞状细胞癌的遗传小鼠模型中,MALDI MSI为CD34+细胞亚群中谷胱甘肽丰度的增加提供了证据,从而赋予体内氧化应激抗性和致瘤潜力。代谢通量是由底物和辅因子浓度驱动的,在细胞的隔间内可能存在很大的浓度差异。利用免疫纯化来丰富细胞器的代谢分析是可行的,如线粒体免疫纯化(MITOIP)量化线粒体内代谢物的丰度,线粒体代谢组学有助于发现谷胱甘肽和NAD的线粒体转运蛋白,该技术也已扩展到溶酶体和过氧化物酶体。综上,专注于复杂环境中代谢不同区域的先进新技术使探索细胞群和亚细胞区室的代谢特征成为可能。
二. 识别代谢调节新机制的开放式技术
功能基因组学
人类拥有超过2000个的“代谢”基因,这意味着彻底的分析需要高通量的方法。哺乳动物细胞功能基因组学技术使研究人员能够客观识别代谢脆弱性,如针对代谢酶和转运蛋白定制的慢病毒短发夹RNA文库在乳腺癌细胞中表达,后将细胞原位植入小鼠体内,肿瘤形成后测序显示编码磷酸甘油酸脱氢酶 (PHGDH) 的基因是该模型中肿瘤生长所必需的。基于CRISPR的筛选(图1)已被用于识别许多代谢问题,有助于解决细胞生物学中长期存在的难题。尽管电子传递链(ETC)的氧化磷酸化(OXPHOS)支持许多代谢功能,但如果提供外源性丙酮酸,具有OXPHOS缺陷的细胞可以增殖。即ETC在增殖细胞中的主要功能是产生天冬氨酸而非能量,丙酮酸作为电子受体,最终能够生成草酰乙酸用于氨基转移。肿瘤的缺氧区域所含天冬氨酸水平不足以维持细胞生长,这些发现依赖于功能基因组学提供的对代谢依赖性全局评估。
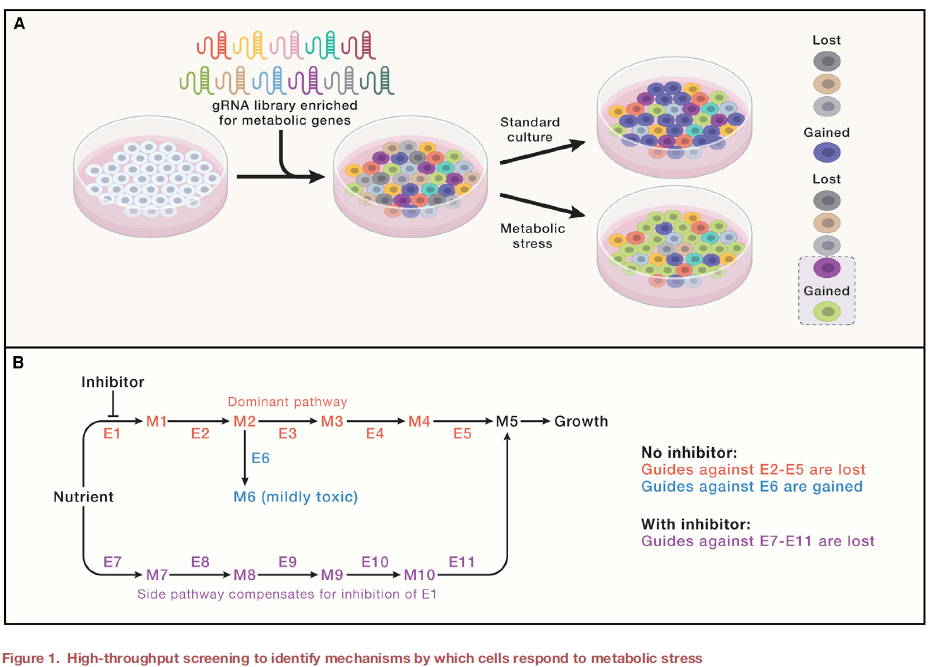
图1. 高通量筛选明确细胞应对代谢压力的机制
小分子调节代谢
数百种针对代谢酶和营养转运蛋白的抑制剂作为工具化合物或临床领域药物存在,富含这些抑制剂的化学文库已被用于识别相互作用,揭示了代谢在细胞对其他阻断反应的意外作用。如谷胱甘肽消耗与去泛素酶抑制在乳腺癌中具有协同作用,反映了去泛素化在减轻氧化应激过程中错误折叠蛋白质积累。代谢物结合酶上的变构位点是调节通路活性的常见机制,寻找代谢物-蛋白质相互作用可以揭示新的调节模式。使用平衡透析和质谱法来检测文库中与纯化蛋白质结合的代谢物,筛选33种蛋白质发现了数百种相互作用和几个新的调控位点,如发现长链酰基辅酶A与乳酸脱氢酶A (LDHA) 结合并在低微摩尔浓度下抑制其活性,暗示了乳酸和脂肪酸代谢间的新调节模式,在LDHA水平上发挥作用,该筛选试验发现的许多其他蛋白质-代谢物相互作用仍有待探索。
三. 结合基因组学和代谢组学,解析代谢变异和疾病的遗传基础
小鼠和人类代谢的遗传修饰
近交小鼠有助于确定代谢表型,为了利用小鼠作为模型来了解代谢的遗传决定因素,将实验室常用小鼠的八种近交系进行杂交,以创建多样性远交(DO)种群,DO小鼠因数百万个单核苷酸多态性而彼此不同,使得用遗传学来识别与代谢特征相关的变异成为可能。对300多只DO小鼠进行了3000多种血浆脂质组学分析,后将脂质丰度映射到基因组中的数量性状基因座,使许多脂质脱孤(de-orphaning)并确定调控的新方向;另一项研究离体分析了来自 DO小鼠的胰岛响应促分泌素释放胰岛素的能力,揭示了导致胰岛素分泌变异性的几个基因座。达拉斯心脏研究 (DHS) 是一个基于多种族人群的大型样本,20年来一直用深度代谢表型和全基因组关联研究来检测导致疾病相关代谢扰动的变异,发现编码前蛋白转化酶枯草杆菌蛋白酶/kexin9型(PCSK9)的基因中的功能丧失变异体与降低的血浆低密度脂蛋白水平和预防冠心病有关,促进了用于治疗难治性高胆固醇血症的PCSK9抑制剂的开发;DHS的另一个进展是编码含有patatin样磷脂酶结构域的蛋白3 (PNPLA3) 基因中变体的关联,它编码一种三酰基甘油脂肪酶是非酒精性脂肪性肝病(NAFLD)的标志,这一发现启动了数百项研究探索PNPLA3与肝脂肪的联系及如何通过靶向PNPLA3来开发NAFLD疗法。
人类罕见病的代谢组学
代谢组学越来越多地用于表征罕见的人类表型,特别是随着全外显子组测序和全基因组测序(WES, WGS)在临床上可用于诊断遗传性疾病。WES和WGS在检测潜在致病基因组变异方面优势显著,但对解释意义不确定的变体却颇有挑战,而代谢组学提供了深度表型分析。临床生化实验室对先天性遗传缺陷的常规检查集中在几十种代谢物上,但现代代谢组学可以同时报告数百种代谢物,使得观察具有非特异性表型的罕见代谢异常模式成为可能,将这些模式与WES/WGS发现的罕见基因组变异相关联(图2)。作为WES/WGS的补充,代谢组学辅助通路筛查(MAPS) 已成为一种基于血浆代谢组学分析的临床诊断测试。在WES和MAPS评估的170名患者中,代谢组学数据有助于解释超过40%病例的基因组变异。新生儿筛查通过检测所有婴儿的诊断性生物标志物(通常是代谢物)来识别具有可治疗先天性遗传缺陷和其他疾病的症状前患者。已知先天性遗传缺陷患者的代谢组学有助于发现适合新生儿筛查的新生物标志物,这对未来成为可治疗的疾病非常关键。因此,将基因组学与代谢分析相结合加强了对遗传代谢异质性的理解,也为常见代谢疾病提供了新疗法。在罕见的单基因疾病中,广谱代谢组学分析提高了临床基因组学的效用,提供了一个深入表型维度,并阐明了基因组变异的重要性。
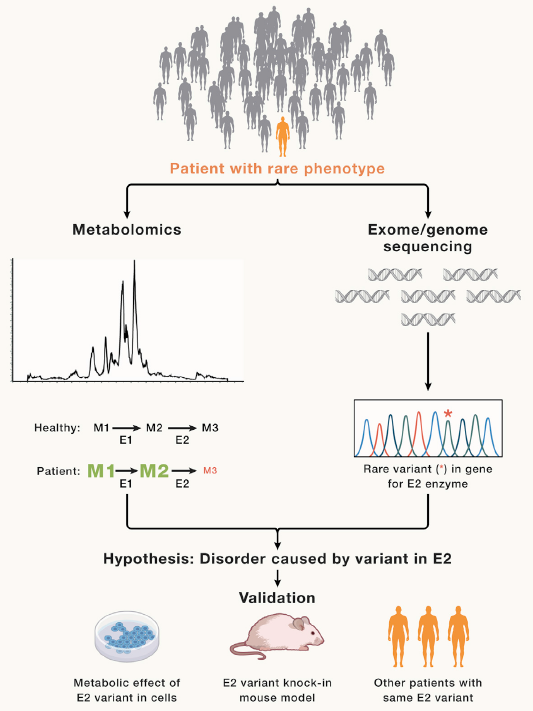
图2. 整合代谢组学和基因组学来识别代谢异常的分子基础
四. 代谢成像
代谢成像的放射性方法
PET一直是探测人体代谢的标准,从最广泛使用的示踪剂18F-氟脱氧葡萄糖 (FDG)开始,最近全身PET扫描仪(EXPLORER)灵敏度的增强和放射性剂量减少10倍。TOF PET 成像利用对光子检测时间(皮秒数量级)的高精度测量来改善定位,有可能在系统级别上拟合各种组织的动力学速率模型,从而实现全身测量。最近研究集中在开发能够探测代谢反应的新示踪剂(如18F-谷氨酰胺、18F-FACBC和 18F-乙酸盐),18F类似物虽具有相当长的寿命,但其并未表现出与代谢反应天然底物相同的代谢,使得13N和11C类似物被重新探索用于代谢成像研究。如11C醋酸盐不仅有可能提示脂肪酸代谢,还具有不同程度的乙酰化,考虑到表观遗传学与代谢的联系,特定位置的放射性同位素标记可以进一步提示通量选择,以更好地解释代谢图像。如在乳酸的C1位置掺入11C会保留在含大量乳酸库的组织中,但在生成丙酮酸并随后通过丙酮酸脱氢酶(PDH)代谢时,它会以11CO2的形式丢失,从而严重影响到乳酸库的信号大小。相反,在乳酸的C3位置掺入11C 提供了一种将乳酸代谢纳入三羧酸循环的方法,标记保留在PDH之外(图3)。
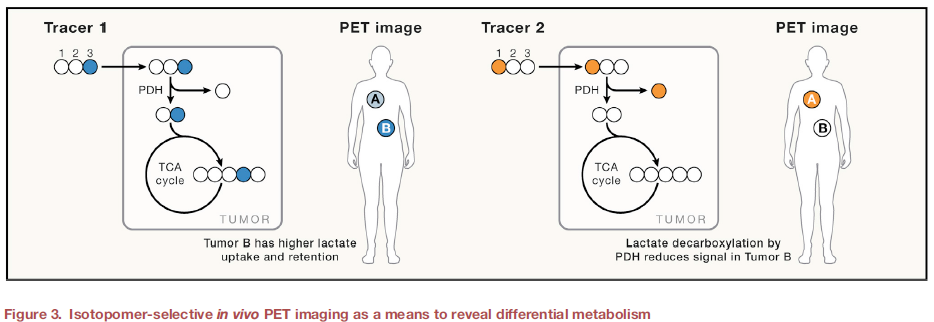
图3. 同位素选择性体内PET成像揭示代谢差异
代谢成像的稳定同位素方法
稳定同位素示踪是一种通用方法,使用稳定同位素标记的营养素可揭示与疾病相关代谢活动的新方面,用于示踪的同位素(2H、13C 和 15N)可使用MRI和磁共振波谱(MRS)检测,在癌症等疾病研究中已经证明注入同位素标记的营养物质能够无创跟踪它们的代谢转化。如在大脑中,来自底物的通量因13C-乙酸盐和13C-葡萄糖可用于测量谷氨酰胺和谷氨酸盐的回收率,这可扩展到测量人肝脏中的TCA循环通量和回补。在使用同位素示踪剂对代谢活动进行原位成像领域,进展最快的是超极化磁共振成像技术。通过产生一种超极化营养物质,将该营养物质注入生命系统以测量酶转化,这类方法可在肿瘤中用于跟踪许多底物的代谢转化如葡萄糖、果糖、谷氨酰胺和丙酮酸。最值得注意的是,13C丙酮酸还原为乳酸已被证明与癌症等级相关,氧化为碳酸氢盐提供了精美的心脏功能图谱,并在心脏病中具有潜在应用。在大脑中使用氘MRI进行稳定同位素追踪是一种无需放射性来注释糖酵解利用的方法。
展望
在人类代谢网络发现的基础上,新技术和概念的进步使人们对代谢和疾病有了新的认识,利用工具研究从亚细胞水平到人群的代谢。将代谢途径定位到膜封闭的细胞器(如线粒体)是代谢调节的重要组成部分,先进的细胞成像方法可以帮助研究生物分子凝聚物和其他有助于代谢的亚细胞定位机制,以评估活组织中的蛋白质定位和大分子结构,可视化代谢物分布的新细胞内传感器。MALDI和MSI 技术已经可以在组织切片中定位一些代谢特征,但仍难以将特征分配给复杂组织内的特定细胞类型。代谢MSI未来将以在同一样品中叠加几个空间分辨特征,将转录组学、蛋白质组学、代谢组学,甚至同位素富集特征与高分辨率组织学数据进行复用。识别和量化代谢机制推动了对疾病的理解,因此定位患者的代谢扰动是利用这些发现来解决疾病问题的关键。临床代谢成像快速发展,将使研究者能够开拓性地阐明通路。鉴于临床成像工具如代谢MRI和PET的互补性,将这些方式相互融合并使用广泛的代谢探针可以提供系统代谢的整体谱图,促进从细胞器到患者的跨尺度代谢探索,将有可能改变代谢疾病的研究、诊断和治疗方式。
参考文献
DeBerardinis and Keshari, Metabolic analysis as a driver for discovery, diagnosis, and therapy. Cell. 2022.
请扫描二维码阅读原文

往期推荐
1. Microbiome | 一文读懂 · 人体内胆汁酸的微生物转化途径
2. Microbiome | 多组学分析揭示减重手术中肠道微生物如何调节机体代谢
3. Nature全新方法绘制肠道微生物代谢谱,再加速菌群-宿主共代谢研究进程
4. Cell | 废料中的宝藏!肠道菌群将橙皮纤维转化为活性代谢物N-甲基-5-羟色胺!
5. Gastroenterology | 饮食干预下的儿童克罗恩病的粪便代谢组改变



