文献解读
Nature Reviews Microbiology︱全面解析肠道菌群代谢物重要作用

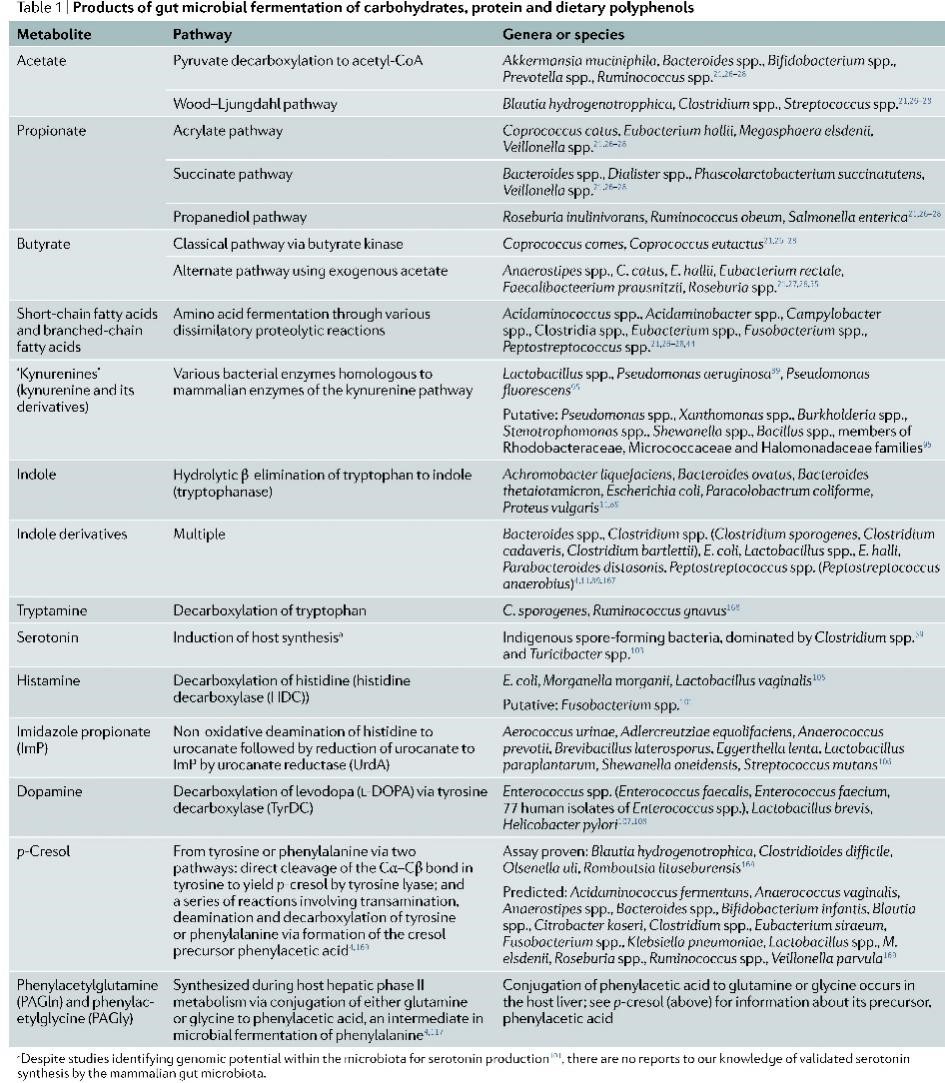
肠道菌群代谢物作为宿主代谢反应的信号分子和底物,影响着宿主生理、病理等过程。虽然宿主-菌群互作研究仍然具有各种挑战,但基于代谢物研究已经确定了多个与宿主健康相关的可行的微生物靶点。本综述总结了短链脂肪酸、氨基酸及其衍生物、胆汁酸等几大类肠道菌群代谢物在临床与转化研究中的意义。相关研究发表在《Nature Reviews Microbiology》。
哺乳动物具有以万亿计的肠道微生物,遍布各个部位,包括皮肤、唾液、口腔粘膜等部位,其中大多数存在于胃肠道。在啮齿动物和人类中,盲肠和近端结肠是微生物生物量最高的区域。肠道菌群可产生一些代谢物或小分子,随后被宿主肠道吸收从而影响宿主生理,这些代谢产物既能促进健康,也可能损害健康,而单一代谢物对宿主的作用是好是坏,要取决于受影响的组织类型和代谢状况、饮食情况以及代谢物循环水平。而菌群相关代谢物绝对定量检测的迅速发展大大提高了我们对菌群代谢物功能和宿主微生物组相互作用的理解。
可发酵底物
膳食营养分子被远端肠道细菌代谢产生多种代谢物。短链脂肪酸(SCFAs)是最常被研究的一类小分子代谢物,它们由肠道微生物发酵膳食纤维产生。膳食纤维,包括多糖、低聚糖和抗性淀粉,通过影响肠道菌群在宿主健康和疾病发挥调节作用。这些膳食碳水化合物逃避宿主小肠中有限的代谢酶分解进入到远端肠道,在那里作为多种微生物碳水化合物活性酶(CAZymes)的底物从而提高了宿主的代谢能力。乙酸、丙酸和丁酸占总SCFA池95%以上,在小鼠和人类肠道中摩尔比约为60:20:20。此外,支链脂肪酸(BCFAs)异丁酸、2-甲基丁酸、异戊酸以及丙酸中间体乳酸和琥珀酸也会产生,虽然丰度很低,也能发挥生物学效应。
尽管SCFAs主要来自膳食纤维,但微生物的可用碳水化合物(MACs)另一来源是结肠黏液层。正常生理条件下,内层粘液是不可渗透的,但外层粘液是微生物的栖息地,可作为细菌能量来源进行利用。粘液由小肠和大肠中的杯状细胞分泌,包含严重O-糖基化的粘蛋白(一类大蛋白,>5000个氨基酸长)。因此,当饮食MACs受限时,宿主粘蛋白可以作为碳水化合物和蛋白质的主要来源。
结肠微生物也能发酵膳食、宿主和微生物来源的蛋白质,这对总SCFA、BCFAs池有少量的贡献,一项人体肠道内容物体外分批培养研究发现,蛋白质发酵的SCFAs在盲肠部位占17%,在远端肠占(乙状结肠和直肠)38%。可以说蛋白质发酵是微生物有机酸生产的一个小但重要的贡献者。
膳食底物的发酵也会释放和/或修饰生物活性多酚,膳食多酚是一种含量丰富的植物源化合物,由于其结构复杂性高,只有~10%的膳食多酚在小肠中被代谢和吸收,其余~90%通过远端肠道,受到微生物的广泛修饰和降解,这增加了它们的吸收和生物利用率。膳食多酚具有抗炎、抗氧化和抗菌作用,对心血管疾病(CVD)、癌症、代谢性疾病、阿尔茨海默病和炎症性肠病具有有益作用。最近从柑橘类水果中纯化的富含黄酮的物质被证明是以微生物依赖的方式调节高脂饮食引起的损害,表明这种提取物可能是治疗代谢性疾病的一种益生菌剂。
碳水化合物和蛋白质的微生物发酵途径
结肠微生物对饮食中碳水化合物和蛋白质的发酵途径如图1所示。一般来说,饮食或粘蛋白的复杂碳水化合物被微生物多糖酶和糖苷酶水解为五碳或六碳单糖,然后通过经典的磷酸戊糖(五碳)途径或Embden-Meyerhof -Parnas(六碳)途径进一步分解代谢为丙酮酸。丙酮酸(或其前体磷酸丙酮酸)通过多种代谢途径,最终产生SCFAs。在蛋白质发酵的情况下,首先通过宿主内肽酶和微生物蛋白酶将近端结肠中逃避宿主消化的饮食和宿主蛋白部分水解为氨基酸。然后,根据底物不同,产生的氨基酸会经历各种微生物发酵反应,不仅生成SCFA和BCFA,还会产生氨、苯酚和吲哚等许多其他化合物。
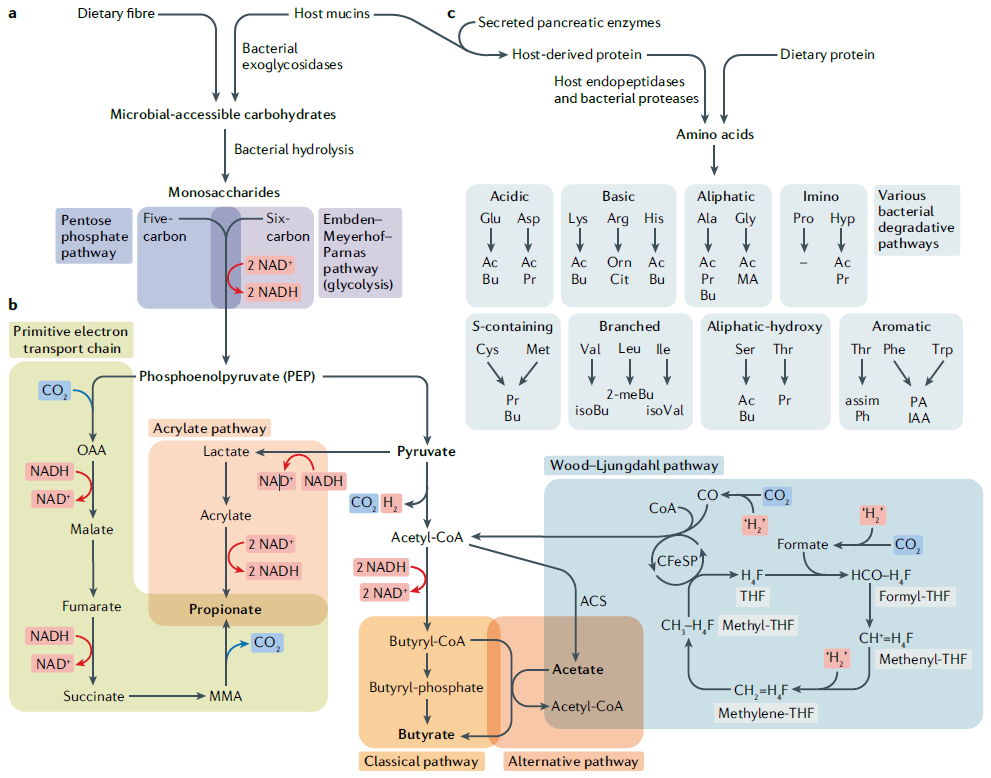
Fig.1 Fermentation of microbial-accessible carbohydrates and proteins by the colonic gut microbiota
环境、宿主和生化因子的调控
SCFAs的产生与饮食、菌群组成和宿主有关,膳食大量营养素组成(碳水化合物与蛋白质与脂肪的比例)决定了微生物可发酵底物的数量和来源,是微生物结构和功能的主要驱动因素。微生物对膳食纤维的反应是高度个性化的,可能取决于某些“keystone”物种的存在,大量的数据表明SCFA的产量与膳食纤维类型有关。Firmicutes和Actinobacteria门的成员是对MACs变化的主要响应者,通常在纤维降解中起着更特殊的作用。相反,细菌,如Bacteroides thetaiotaomicron可以改变其转录体来消化粘液,而非膳食MACs,此外,B. thetaiotaomicron也会诱导宿主产生含有岩藻糖的聚糖,从而用作发酵底物。
高MAC饮食通常与肠道菌群多样性和SCFA产生的增加有关。当膳食纤维受限时,菌群转向对发酵不太有利的底物,从而导致SCFA含量降低和不良健康结果。小鼠喂养低MACs的西式饮食可诱导菌群结构发生变化,在这一代中是可逆的,但若几代中持续采用这种饮食方式,就会导致一些菌种消失,并且是不可恢复的。人类也有类似的饮食反应,特别是对工业化和/或迁移的反应。
微生物发酵驱动因子也会发挥调控作用。每次单糖分解为丙酮酸都会产生两个NADH分子,这些过量的等价物会驱动额外的生化途径(图1)或通过铁氧还蛋白依赖的反应生成H2。铁氧还蛋白的还原是微生物产生SCFA所必需的驱动力,包括乙酰辅酶A羧化生成丙酮酸和通过Wood-Ljungdahl途径产生乙酸。发酵还会产生CO2和H2,对SCFA生成具有调控作用,产乙酸菌和产甲烷菌清除这些产物可能进一步提高微生物的发酵能力。
哺乳动物宿主生理的SCFAs
SCFAs可调节宿主生理生化功能,包括在结肠上皮和粘液水平上维持天然肠屏障功能、肠道运动、肠道激素分泌、染色质调节、肠脑轴、免疫功能等等。这些有机酸与宿主健康和疾病状态息息相关,包括心脏代谢疾病和非酒精性脂肪肝、神经和精神障碍以及肿瘤发生的混合效应。SCFAs的特异性作用主要通过G蛋白偶联受体(GPCRs)或游离脂肪酸受体(FFARs)选择性激活所介导,也可直接作为其他分解代谢和合成途径的底物。
目前对BCFAs如何影响宿主生理还知之甚少,但其来源BCAAs在肥胖、胰岛素抵抗和T2DM中具有一定调控作用。血浆中BCAAs升高与多民族和多地域胰岛素抵抗有关,通常作为BCAA相关代谢物簇的一部分,如芳香族氨基酸和酰基肉碱,两者都通过不同的机制反映BCAA过载。BCAA还可以预测减肥手术和噻唑烷二醇在改善葡萄糖稳态中的功效。在一项单独的研究中,空腹血清BCAAs升高与胰岛素抵抗和肠道微生物组有关,肠道菌群为合成BCAA而被富集,但由于这些化合物被摄取而耗尽。BCAA分解代谢在多种癌症中也会消失,而饮食摄入BCAA与小鼠和人类的癌症风险相关。虽然BCAA的微生物发酵对代谢性疾病的影响程度尚待确定,但BCAA池的菌群组成和功能改变可能是重要的病因。
氨基酸及其衍生物
尽管宿主在小肠中有效同化了蛋白质,但有研究表明,在通过回肠的末端时,5%到10%的膳食蛋白没有被吸收,而是以蛋白质和肽的形式进入结肠。一旦进入远端肠道,蛋白质和肽就有三种可能的结果:被微生物的同化;作为微生物异化代谢的底物,其产物进入宿主门脉循环或作为广泛微生物串扰的中间体;以及通过粪便排泄。肠道微生物代谢氨基酸的程度主要取决于底物的利用率和腔内环境。结肠pH较高和碳水化合物利用率较低的情况下,蛋白质细菌发酵率更高,微生物降解蛋白质产生的SCFA比碳水化合物产生的少得多。此外,有机酸产量的降低导致腔内pH升高,进而改变菌群结构和功能。相反,产生SCFA导致的低腔pH会抑制细菌蛋白酶活性,并且可发酵的碳水化合物驱动细菌生长,随之牺牲发酵来增加细菌蛋白质的同化。
目前由于腔内容物的复杂性、这些底物代谢的多种宿主和微生物途径之间复杂的相互依赖关系以及代谢物来源分类(宿主与微生物)技术的局限性,肠道微生物对蛋白质降解的研究受到了限制。不过,也明确了肠道菌群从逃避宿主消化的蛋白质和肽中回收了大量能量,以产生各种生物活性化合物,包括SCFAs、BCFAs、氨、酚类、吲哚、胺、硫化物和N-亚硝基化合物,其中一些具有潜在的毒性。
宿主-菌群互作中色氨酸代谢
色氨酸是化学上最为复杂的氨基酸,使其成为广泛转化的最佳底物,人体中几个重要的信号分子如5-羟色胺和色胺就是来源于色氨酸。图2展示了哺乳动物中色氨酸的几种可能结果。色氨酸转化为犬尿氨酸的限速步骤是吲哚胺2,3-双加氧酶1(IDO1;免疫和肠道上皮细胞)或色氨酸2,3-双加氧酶(TDO;肝细胞);肠道菌群可促进IDO1的表达,IDO1的活性也能调节微生物群落的组成。已知这些酶在多种癌症中高度上调,并且由于这种上调而合成的一些犬尿氨酸衍生物作为芳烃受体(AhR)配体促进细胞迁移和免疫耐受,从而推动癌症的进展。除了宿主,有些肠道菌群也具有产生该途径各种中间体的基因组能力。
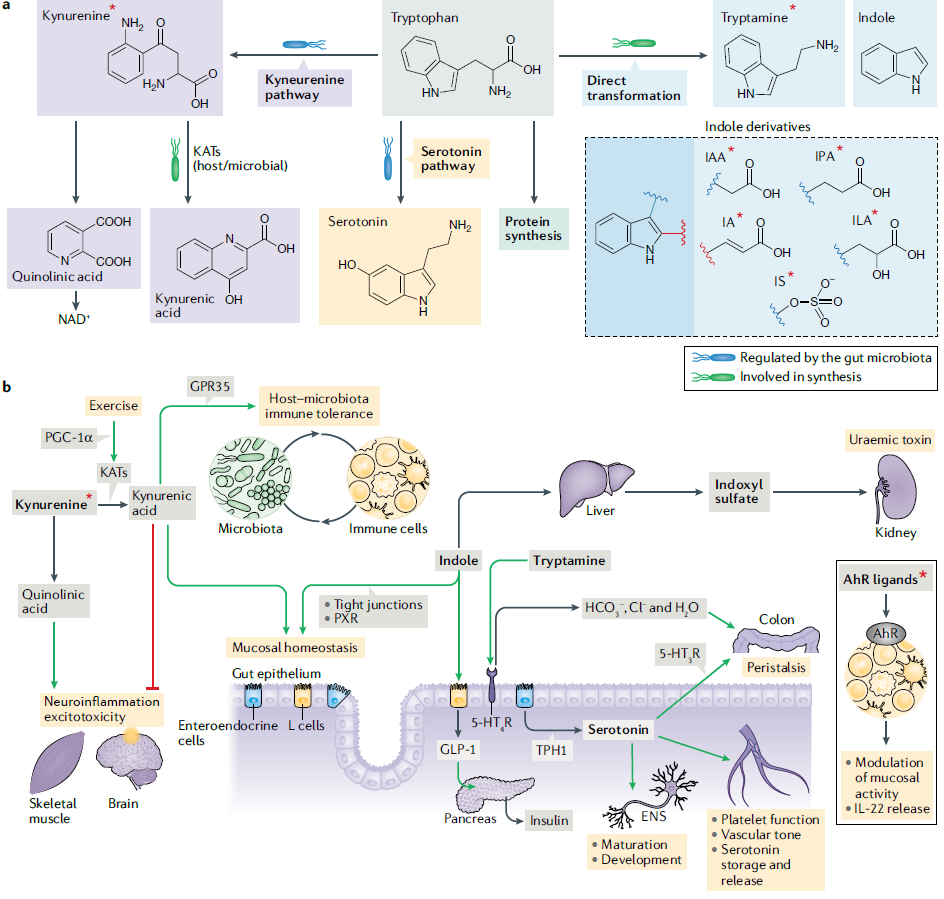
Fig. 2 Host–microbiota interactions during tryptophan metabolism
犬尿氨酸的生理作用对宿主健康有利也有害,这取决于所涉及的特定化合物、靶组织和信号通路(图2)。在中枢神经系统(CNS)中,分别发挥兴奋性毒性和神经保护作用的喹啉酸和犬尿喹啉酸水平在抑郁症和精神分裂症中出现失调,阿尔茨海默病和亨廷顿病的小鼠模型也与犬尿氨酸途径失调有关。运动训练会引起PGC-1α介导的几种犬尿氨酸氨基转移酶(KAT)亚型骨骼肌表达的增加,将犬尿氨酸转化为犬尿喹啉酸,导致循环中犬尿氨酸水平降低,保护免受应激引起的抑郁。肠内犬尿氨酸途径代谢物可作为GPR35(犬尿喹啉酸受体)激动剂,介导粘膜稳态和宿主-微生物免疫耐受。此外,犬尿氨酸也是AhR配体,研究证明多种犬尿氨酸途径中间体能抑制大鼠胰岛素合成、分泌和信号传导,并发现在T2DM患者尿液中犬尿喹啉酸和黄嘌呤酸含量升高。
5-HT是由色氨酸通过两步途径合成,限速酶为色氨酸羟化酶(TPH),该酶有两种亚型:TPH1在肠黏膜内肠嗜铬细胞中表达,TPH2在CNS和肠神经系统神经元中表达。全身大约90%的5-HT是由肠嗜铬细胞合成的,在生理条件下不能穿过血脑屏障。在CNS中,5-HT在调节情绪、睡眠、食欲和行为方面起着重要作用,而在外周组织中,5-HT可调节肠道蠕动和分泌、炎症、血小板功能、血管张力、骨发育以及肠肌层神经丛内Cajal神经元和间质细胞的发育和维持。
吲哚及其衍生物通过调控菌群和宿主生理来调节宿主-菌群稳态的多个过程(图2),其中许多化合物是AhR配体。肠道微生物色氨酸酶将色氨酸代谢为吲哚,进入宿主门循环,在肝脏中转化为硫酸吲哚酚,再由肾脏排出,高水平硫酸吲哚酚具有肾毒性。肠道菌群对色氨酸进行多种转化,包括产生多种吲哚衍生物和色胺,通过激活5-HT 4型受体(5-HT4R)激活结肠运动,并分泌结肠粘膜中阴离子和液体。
除了色氨酸,肠道菌群还可代谢组氨酸、苯丙氨酸和酪氨酸产生多种代谢物,从而影响疾病的发生。组氨酸在哺乳动物和肠道细菌细胞中脱羧形成组胺,组胺在免疫系统中具有重要的调节作用;组氨酸还可代谢为咪唑丙酸(ImP),ImP 在T2MD中升高,并通过激活p38γ-p62-mTORC1通路损害胰岛素信号传导。肠球菌和短乳杆菌的多种菌株可通过保守的酪氨酸脱羧酶(TyrDC)对左旋多巴(L-DOPA)进行脱羧,在肠道中产生苯丙氨酸或酪氨酸衍生多巴胺,在控制运动和情绪种具有重要作用,而外周多巴胺不能穿过血脑屏障,对行动具有负面作用。
慢性肾病(CKD)可发展为终末期肾病(肾功能衰竭),与微生物功能的变化和微生物源肾毒素的积累有关。疾病状态下肾功能下降,尿素和其他废物在血液中累积,从而促进这些物质从血液中转移到肠道,因此,随着CKD的进展,远端肠道成为尿素排泄的主要部位,从而改变腔内环境和微生态。菌群代谢物会影响CKD的进展,早期研究发现小鼠血浆中几种菌群依赖的尿毒素,包括色氨酸衍生物硫酸吲哚、酪氨酸或苯丙氨酸衍生物p-硫酸甲酚(pCS)和苯乙酰谷氨酰胺(PAGln),这三种物质在CKD患者中出现累积并通过诱导肾损害、炎症和纤维化促进发病和疾病进程。而血液透析并不能有效清除尿毒素,因此,基于微生物的治疗对CKD和终末期肾病具有潜在的治疗价值。
胆汁酸作为肠道菌群的信使
肝脏中胆汁酸(BA)的合成有两条途径,需要至少17种不同的酶,其中经典途径的限速酶是CYP7A1,而替代途径则受CYP27A1调节。经典途径产生CDCA或CA,依赖于CYP8B1的活性,而替代途径主要产生CDCA。CYP7A1和CYP27A1的表达受肠道菌群调控,而CYP8B1则不受到调控,并且牛磺酸的合成也受肠道菌群调控。据报道,CA可与苯丙氨酸、酪氨酸和亮氨酸结合,但功能尚不清楚。在远端小肠和结肠中,BAs受到肠道菌群胆盐水解酶(BSH)的解偶联,从而阻止它们在肠肝循环中的主动摄取。解偶联BAs经过微生物转化,通过羟基的脱羟基化、差向异构和氧化产生一系列次级BAs。研究这些微生物的生物转化机制仍是热点,最近才阐明合成两种非常丰富的次生胆汁酸DCA和LCA的完整酶途径。
FXR和TGR5介导的胆汁酸信号传导
BAs在宿主体内发挥功能主要通过两种受体:法尼醇受体FXR和G蛋白偶联胆汁酸受体TGR5,而非结合型BAs也可通过PXR、CAR、VDR受体传递信号。TGR5是一种广泛表达的跨膜受体,通过促进棕色脂肪组织中的细胞内甲状腺激素活性,增加棕色脂肪组织和肌肉的能量消耗,并诱导肠L细胞释放胰岛素分泌GLP-1来调节能量平衡。FXR是一种胞浆配体激活的转录因子,可转运到细胞核以诱导靶基因转录。除了作为BAs合成和转运的调节因子外,FXR还在调节炎症和免疫以及肝再生中起着重要作用,并在肝细胞和胃肠道中诱导保护性细胞反应。FXR的作用非常复杂,取决于组织类型和环境因素。据报道,FXR激动剂和拮抗作用在不同的情况下都具有健康益处,尽管肝脏中的FXR激活对脂肪变性有保护作用,但肠道FXR也可促进饮食诱导的肥胖和脂肪变性,因此需要进一步研究FXR及其在宿主健康中肠道微生物的调节作用。
疾病中胆汁酸的微生物调节
BAs与代谢性疾病和恶性肿瘤等疾病有关。特别是,BAs在减肥手术中表现突出,降低了女性癌症发病率。胃分流术将双胰脏汁重新引导到肠道的远端,改变肠道菌群与营养物质的吸收和相互作用,表明BAs及其与肠道菌群的相互作用可以介导减肥手术的积极代谢效应。
胆汁酸-肠道菌群互作在肝癌(HCC)和结直肠癌(CRC)中也具有重要作用。在肥胖诱导的HCC中,微生物源DCA增加会诱导肝星状细胞分泌炎症和肿瘤促进因子,从而促进HCC的发展,而抑制DCA或使用抗生素具有保护作用。肠道中次级BAs激活FXR也可能是CRC和HCC发病的一个关键机制,这种核受体的激活导致宿主-菌群稳态、肠道屏障维持以及免疫和炎症的控制,在肿瘤发生中很重要。在人结肠息肉和结肠腺癌中,FXR表达下降,甚至在许多人结肠瘤的研究中发现FXR表达丢失,进一步强调FXR信号在胃肠道癌发展中的重要性。还有研究表明,梭菌产生次级BA引起的自然杀伤T细胞积累可保护宿主免受肝癌和肝转移瘤。因此,利用胆汁酸信号在治疗胃肠病和癌症方面表现出很大优势。
维生素和一碳代谢产物
肠道微生物对一碳代谢和维生素特别是B族维生素也有一定作用(图3)。一碳代谢中间体促进许多生物合成过程,包括嘌呤合成、甲基供体的可用性和通过转硫途径实现的氧化还原平衡,并在胚胎发生、干细胞维持和造血、DNA和组蛋白甲基化以及免疫细胞功能中起着重要作用,一碳代谢失调与多种癌症、肝病和CVD有关。
胆碱是人类必需的营养物质,既来源于饮食,也可内源合成,厌氧微生物通过代谢它产生三甲胺(TMA)和乙醛,TMA被宿主肠道吸收后在肝脏中代谢成TMAO,该菌群-宿主共代谢物可预测重大心血管事件风险。机制上,TMAO可通过诱导多个巨噬细胞受体和血栓形成的特征促进动脉粥样硬化。最近,TMAO的前体三甲基赖氨酸(TML)也被确定为主要不良心脏事件的预测因子。结合TMAO水平,TML改善了急性冠状动脉综合征患者的风险分层,并能够预测未来主要不良心脏事件的风险。
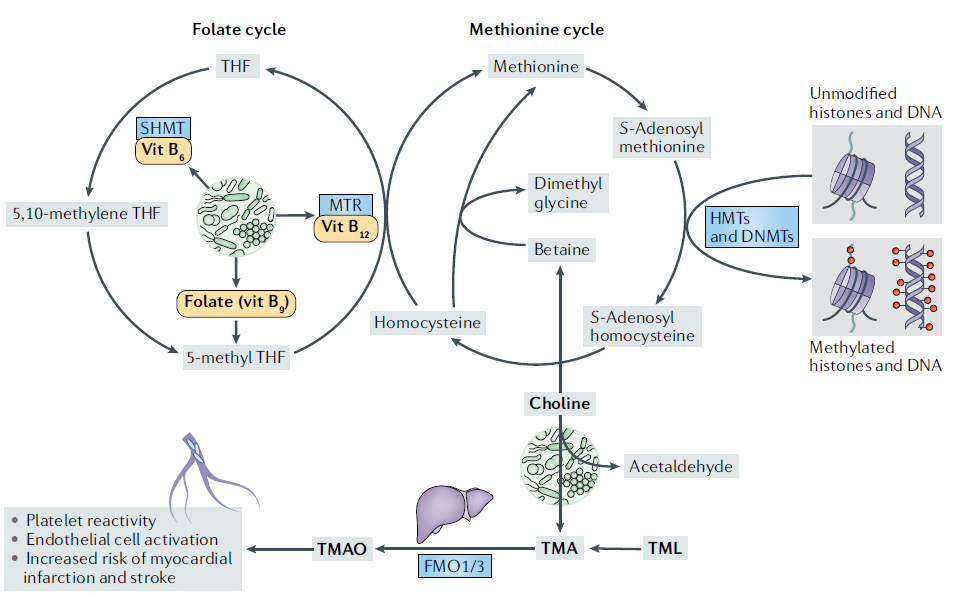
Fig. 3 gut microbiota–host interactions in one-carbon metabolism
吡哆醇(维生素B6)、叶酸(维生素B9)和钴胺(维生素B12)的供应对一碳代谢功能的发挥至关重要,这些维生素是叶酸和一碳循环中必需的底物或辅助因子。B族维生素需从饮食和肠道微生物合成获得,对于叶酸,结肠微生物所产生的实际超过了饮食摄入。研究报道许多人类常见的肠道细菌具有合成B族维生素能力,肠道菌群代谢B族维生素也具有年龄依赖的差异。婴儿肠道菌群具有丰富的叶酸从头合成基因,而成人的菌群含有丰富的叶酸及其还原形式四氢叶酸代谢相关的基因。尽管如此,B族维生素的缺乏仍然很普遍,可能是由于摄入不足、吸收不良、某些干扰叶酸代谢的药物和遗传疾病造成的。因此,肠道菌群是必需维生素的重要来源,并可能为治疗维生素缺乏症提供新的策略,特别是与饮食无关的缺乏症。
小结
由于宿主和菌群间的复杂性和共代谢,目前的技术方法还难以追溯宿主与菌群的代谢物来源,这是挑战也是机遇。另一个挑战是将这些发现应用于临床实践,特别是可能许多发现仅适用于个体的一部分。目前基于菌群的治疗在医学上的应用还处于起步阶段,但其改变医学实践的潜力还是相当大的,包括控制抗生素使用的可能性,并且也可增加或取代心血管医学、神经学和精神病学等领域的现有疗法。
参考文献
Kimberly A. Krautkramer et al. Gut microbial metabolites as multi-kingdom intermediates. Nature Reviews Microbiology 2020. Doi: 10.1038/s41579-020-0438-4.
原文阅读,请长按识别下方二维码

精彩推荐
2. NATURE COMMUNICATIONS | 肠道菌群相关代谢物生物学功能解读—色氨酸代谢
4. Cell Metabolism | 肠道菌群相关代谢物–胆汁酸生物学功能
5. Nature Reviews重磅︱一文读懂肠道菌群代谢物在IBD中的作用
6. TEM | 宿主与菌群互作的信号分子–AAA相关菌群代谢物
7. Protein & Cell︱结直肠癌(CRC)和肝细胞癌(HCC)的肠道菌群差异
8. Nature Reviews 重磅 | 菌群及代谢物与疾病最全解读



