文献解读
客户成果 | 蔡国响团队发表多项结直肠癌侵袭转移相关研究成果
能量代谢重编程是肠癌细胞的重要特征,有望成为干预肿瘤的关键靶点之一。在肿瘤细胞快速增殖和恶性进展的过程中,由于葡萄糖供应不足而造成的代谢应激十分常见。因此,不断探索肿瘤细胞重塑能量代谢模式对抗代谢应激的分子机制,有助于找到更多有效的干预靶点。

2020年9月2日,复旦大学附属肿瘤医院大肠外科蔡国响主任医师团队在Signal Transduction and Targeted Therapy杂志上发表文章GLUT3 induced by AMPK/CREB1 axis is key for withstanding energy stress and augments the efficacy of current colorectal cancer therapies。研究团队综合应用临床样本、以及多重体内外实验深入研究发现,结直肠癌组织中的低糖环境可以活化AMPK/CREB1信号通路,继而转录激活高葡萄糖亲和力转运子GLUT3的表达,增强葡萄糖的利用能力对抗低糖应激,从而促进肠癌细胞的恶性生长。
研究团队首先利用TCGA RNA-seq数据库和GEO芯片数据集发现,GLUT3在肠癌组织中显著上调并且GLUT3的高表达和患者的不良预后显著相关(图1)。
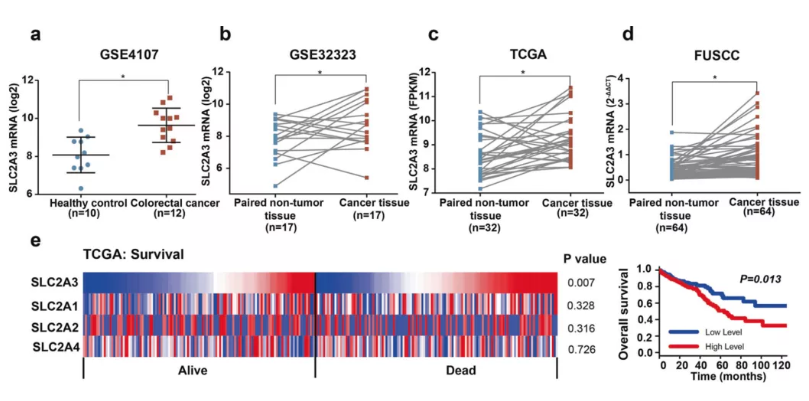
图1 GLUT3在肠癌组织中显著上调及与预后的关系
研究者通过多种实验手段证实,GLUT3介导的葡萄糖利用可以在低糖环境中促进肠癌细胞生长(图2)。
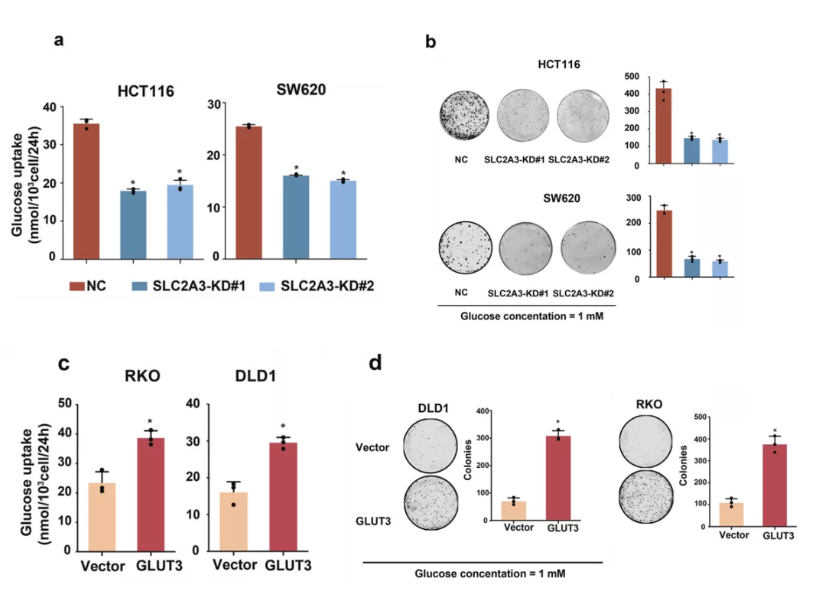
图2 GLUT3促进低糖环境癌细胞生长
接着,该团队利用同位素标记的代谢物示踪技术,发现葡萄糖经GLUT3介导进入肠癌细胞后,被优先用于核苷酸类的合成,以促进肠癌细胞的快速生长。
此外,该团队发现低糖环境下AMPK激酶活性被显著激活,进而活化下游的CREB1转录因子。活化的CREB1可以进一步转录上调GLUT3的表达水平,增强肠癌细胞在低糖环境下的利用能力。
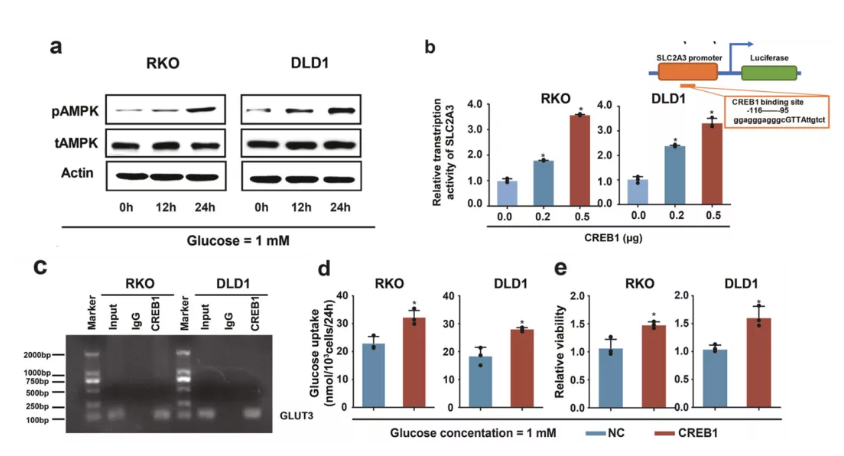
图3 低糖环境下AMPK激酶活性激活,并激活下游CREB1促进GLUT3转录上调
最后,该团队还证实了GLUT3的高表达可以明显增强细胞对维生素C杀伤作用的敏感性,为临床指导维生素C的转化应用提供了重要的参考依据。
上述研究成果证实,葡萄糖转运子GLUT3是增强肠癌细胞对抗代谢应激能力,促进肠癌细胞恶性增殖的关键分子(图4)。GLUT3增强维生素C杀伤作用的重要特点为指导维生素C在临床上的精准应用指引了方向。

图4 工作模型
复旦大学附属肿瘤医院大肠外科戴卫星博士为该论文的第一作者,徐烨主任、莫少波博士、李清国副主任医师以及美国约翰霍普金斯大学医学院余俊教授为共同第一作者,复旦大学附属肿瘤医院蔡国响主任医师为通讯作者、美国夏威夷大学癌症研究中心的贾伟教授、上海中医药大学附属龙华医院肿瘤研究所陈文连研究员和中国科学院上海营养与健康所秦骏研究员为共同通讯作者。
本研究中非靶向代谢组学、葡萄糖的同位素示踪及代谢流分析均由麦特绘谱完成。针对糖代谢通路,麦特绘谱开发了不同靶向绝对定量方法,其中包含糖酵解、TCA循环、辅酶A、核酸类。此外,麦特绘谱可开展葡萄糖代谢流、谷氨酰胺代谢流等相关检测分析。
参考文献
Weixing Dai, Ye Xu, et al. GLUT3 induced by AMPK/CREB1 axis is key for withstanding energy stress and augments the efficacy of current colorectal cancer therapies. Signal Transduction and Targeted Therapy(2020) 5:177,https://doi.org/10.1038/s41392-020-00220-9.
原文阅读,请长按识别下方二维码



