文献解读
Science Translational Medicine | 巨噬细胞让肿瘤不再饥饿
巨噬细胞和肿瘤细胞之间的代谢互作导致癌症进展和治疗耐药性。
最近,Science Translational Medicine杂志在线发表了一项评论1,评价了Cell Metabolism同期发表的两篇关于巨噬细胞影响癌症进展或治疗的研究工作。在这两项研究中,科学家们发现肿瘤细胞通过代谢重组在巨噬细胞中诱导一种不良表型,即肿瘤相关巨噬细胞(Tumor-associated macrophages,TAMs),而这种表型可能导致癌症进展和治疗耐药性。
巨噬细胞是一种免疫细胞,它能检测、吞噬并摧毁入侵机体的微生物。巨噬细胞存在于哺乳动物的所有组织中。至少在稳态下,大多数组织驻留巨噬细胞来源于胚胎祖细胞,并通过自我增殖以维持细胞数量,骨髓中造血干细胞(HSCs)的输入很少。后来的研究表明胚胎来源的巨噬细胞可被造血干细胞来源的单核细胞(MNs)逐渐替代,其程度依赖于特定的生理环境。在癌症发展过程中,巨噬细胞会被肿瘤细胞劫持并被重编程成支持肿瘤生长和免疫抑制的功能状态(TAMs)。然而,驱动TAM在不同肿瘤中积累和极化的具体机制尚不清楚。
在第一项研究中2,法国马赛吕米尼免疫中心(CIML)的Toby Lawrence研究团队探究了肿瘤细胞如何将巨噬细胞转化为TAMs。研究者通过腹腔注射ID8细胞构建了高浆液性卵巢癌(HGSC)小鼠模型,该模型表现为恶性腹水和肿瘤结节遍布整个腹膜腔。在肿瘤发展期间,MN来源的巨噬细胞在腹膜腔积聚,并逐渐替代驻留巨噬细胞。随后研究者采用微阵列技术对naïve小鼠的腹腔巨噬细胞(Peritoneal macrophages, PMs)和肿瘤进展不同时间点的PMs进行了全谱基因表达分析以评估肿瘤微环境对PM表型的影响。在早期(接种5天),TAMs表现出更强的促炎基因特征,可能反映了PMs针对ID8细胞所引发的杀瘤反应。但在成形的肿瘤中(接种21天),TAMs的基因表达谱更接近于naïve PMs,提示TAM表型在肿瘤进展过程中发生了动态重编程。
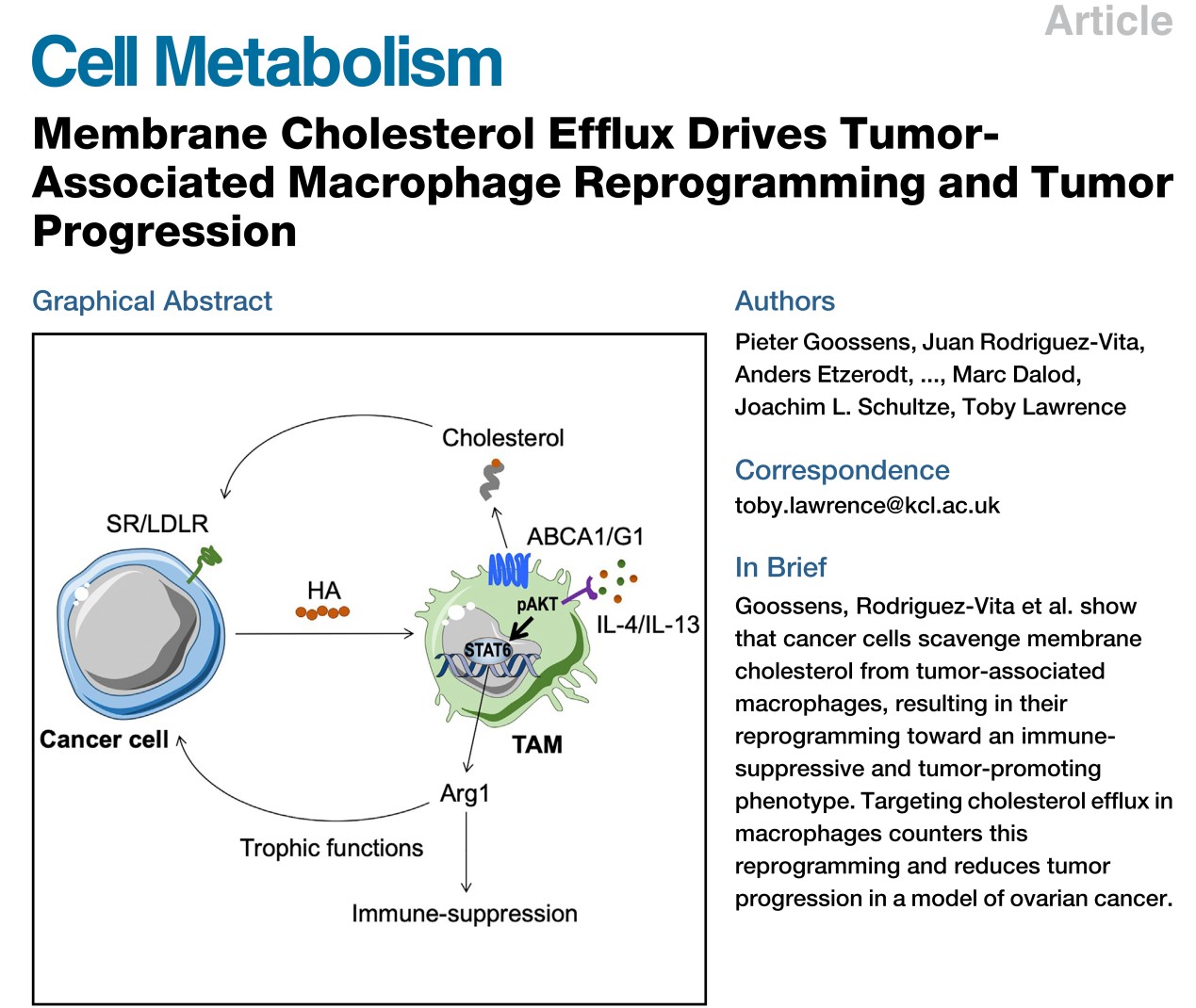
与naïve PM相比,肿瘤形成后的TAMs中表达上调的通路中有一组与胆固醇代谢和反向胆固醇流出相关的基因。作者随后采用霍乱毒素B(cholera toxin B, CTB)染色和Di-4-ANEPPDHQ 染色证实了TAMs细胞膜胆固醇流出显著增加。骨髓来源巨噬细胞(BMDMs)在用ID8肿瘤细胞条件培养基培养(Conditioned media, CM)后细胞总胆固醇含量显著降低。为了直接测量胆固醇流出,研究者给BMDMs装载胸苷(3H)-标记的胆固醇,并在培养基中添加载脂蛋白A1(ApoA1),结果证实ID8肿瘤细胞条件培养基下BMDMs的胆固醇流出显著增加。ApoA1是通过ABCA1转运子接受胆固醇。ABCA1敲除小鼠(Abca1-/-)分离的BMDMs在同样条件下培养,胆固醇流出现象出现逆转。作者进一步证明了卵巢癌细胞释放的透明质酸通过增加细胞膜胆固醇外排诱导了TAM表型。接下来,作者发现胆固醇外排促进了IL-4介导的巨噬细胞重编程。TAM中IL-4诱导SATA6和PI3K信号通路驱动了卵巢癌的进程。最后,作者在骨髓特异性缺失ABCA1和ABCG1转运子的小鼠中构建了ID8肿瘤,发现肿瘤的进展显著受损。此外,对这些小鼠的TAMs进行微阵列分析显示,IL-4依赖的TAM表型相关的基因显著下调,并且杀瘤基因呈阳性富集,反映了PI3k缺陷的TAMs表型。
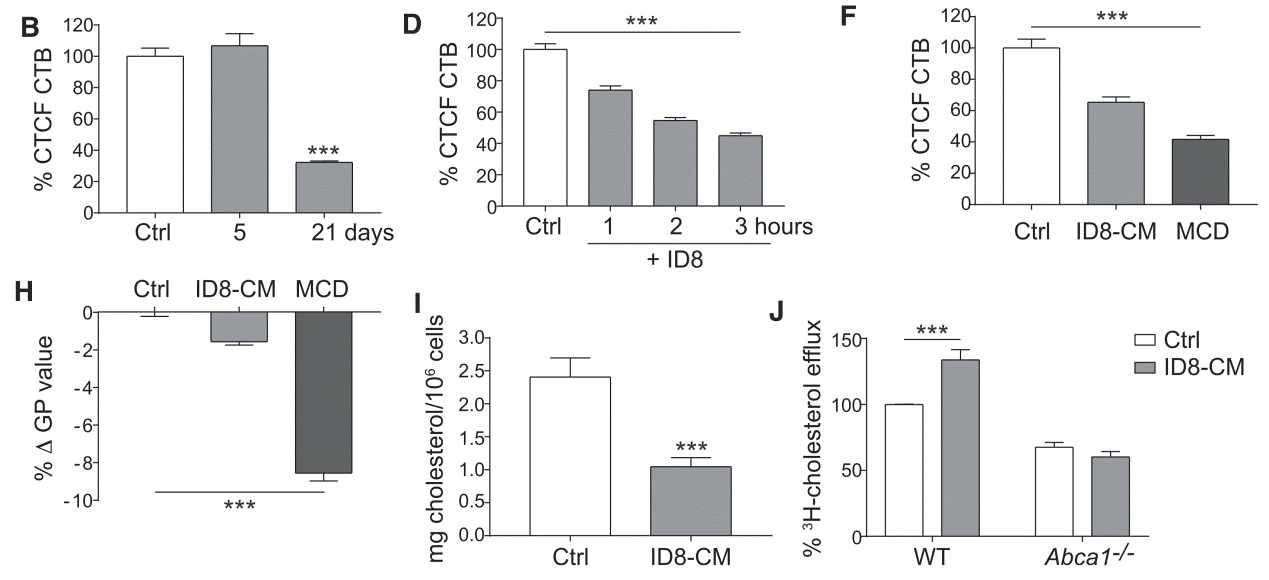
B:naïve PMs和TAMs;D:BMDMs和ID8细胞共培养;F:ID8条件培养基,CTB染色;H:ID8条件培养基,Di-4-ANEPPDHQ染色;I:总胆固醇;J:3H-胆固醇标记
肿瘤细胞为何需要更多的TAMs?一些研究表明,巨噬细胞的高度浸润诱导免疫抑制微环境以保护癌细胞并加速其生长。密歇根大学Costas A. Lyssiotis研究团队3从代谢和治疗的角度阐述了这个问题。胰腺导管腺癌(PDA)富含活化的成纤维细胞和TAMs。TAM丰度与PDA治疗效果较差相关,系统性TAM消耗可阻断胰腺肿瘤的发生并使已形成的PDA肿瘤消退。在生理环境中,巨噬细胞的炎症和抗炎特性可以被细胞代谢程序直接调控。那么TAMs是否能通过与肿瘤细胞的代谢互作影响PDA的治疗效果?
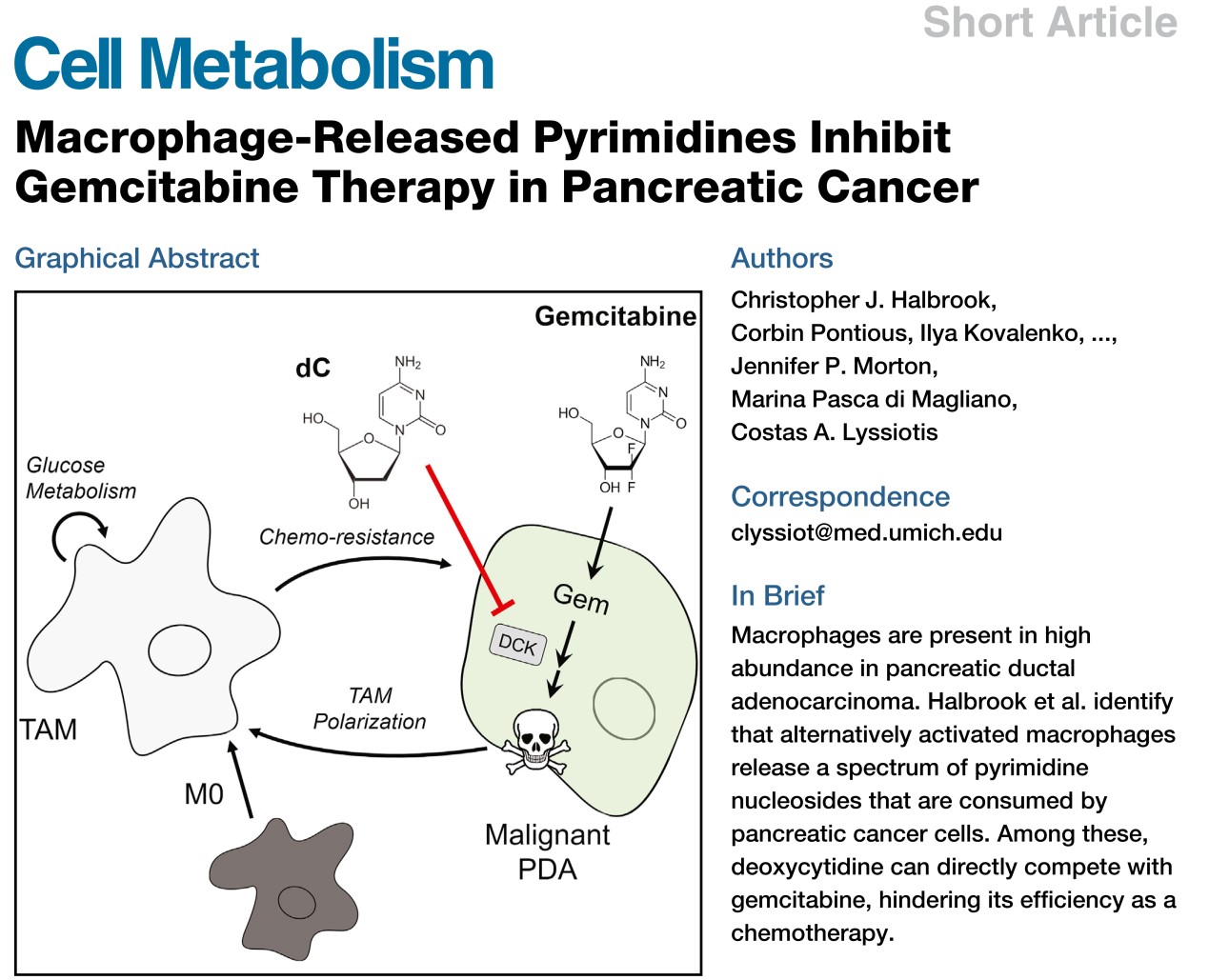
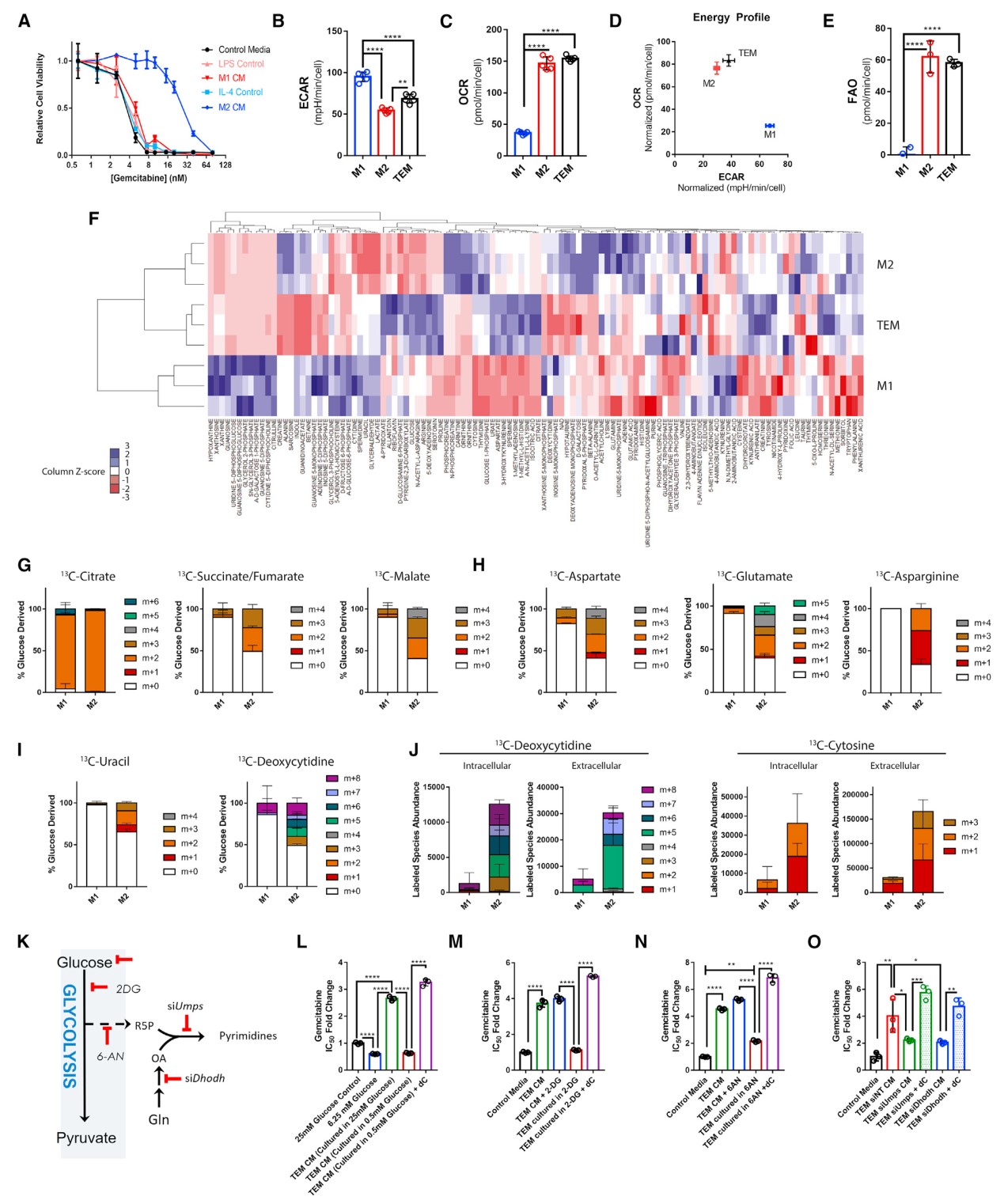
利用代谢组学的方法,作者发现TAMs释放出一系列代谢物到培养基中,包括嘧啶核苷类。由于它们和一线PDA化疗药物吉西他滨(Gemcitabine)结构上的相似性,作者推测巨噬细胞释放的嘧啶类可能降低吉西他滨的疗效。确实,在肿瘤驯化巨噬细胞(Tumor-educated macrophages, TEMs)条件培养基下,杀死胰腺癌细胞需要更高剂量的吉西他滨。在发现的嘧啶类代谢物中,脱氧胞苷(Deoxycytidine)可独特地阻断吉西他滨对PDA细胞的毒性,且存在剂量依赖的响应。重要的是,通过简单地在正常培养基中添加3μM脱氧胞苷(TEM CM中的浓度)即可复制TEM CM的吉西他滨抵抗表型。
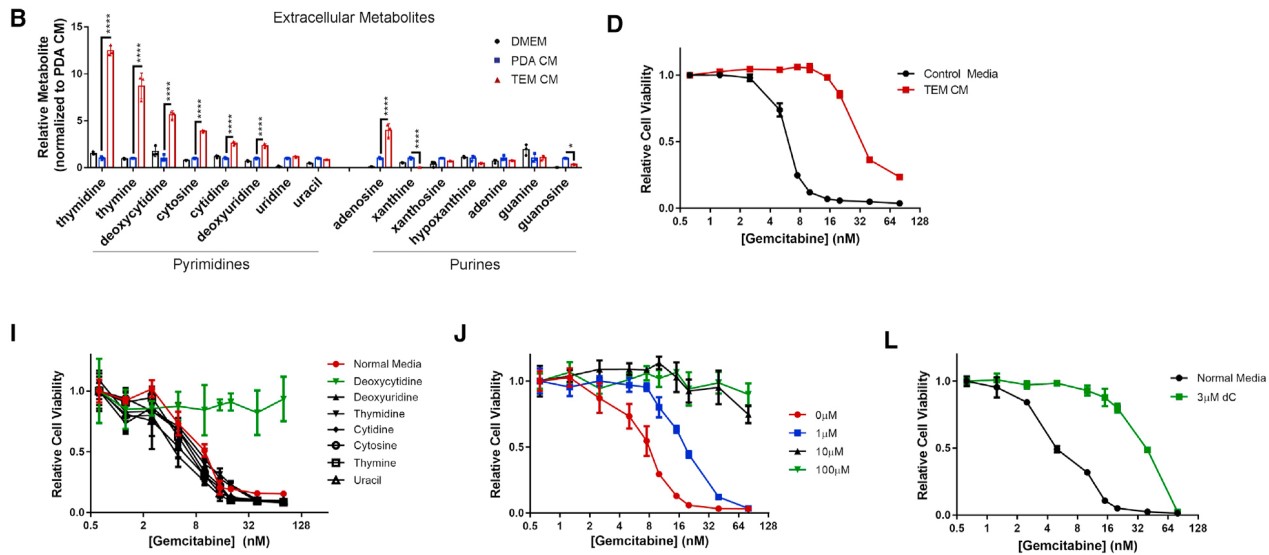
除了TEMs,IL-4诱导的M2型巨噬细胞也会释放脱氧胞苷,并诱导PDA细胞出现吉西他滨抵抗,而在LPS诱导的M1型巨噬细胞中没有观察到这种现象。和先前报道一致,M2型巨噬细胞优先利用线粒体呼吸和脂肪酸氧化,TEMs同样如此。细胞内的代谢轮廓显示M2型巨噬细胞和TEMs较为类似,且通路富集分析表明核苷代谢可将M2型和TEMs与M1型区分开。使用PDA CM极化TEMs的必要性阻止了同位素标记充分进入TEM生物合成途径。因此,作者使用M1和M2型巨噬细胞进行了13C-葡萄糖标记同位素示踪实验。结果显示M2型巨噬细胞中葡萄糖进入TCA循环增加,最终促进了嘧啶生物合成。另外,M2型胞内和胞外从头合成的嘧啶显著增加。总之,相比于M1型,M2型从葡萄糖进行生物合成的能力大大增强。作者进一步采取限制葡萄糖、使用小分子抑制剂抑制糖酵解或PPP途径的方式进行验证,发现这些处理抑制TEMs生成脱氧胞苷的能力,且调节PDA细胞对吉西他滨的敏感性。更重要的是这些处理对TEM增殖能力影响极小,而添加外源脱氧胞苷能够恢复PDA细胞的吉西他滨抵抗表型。因此,吉西他滨的耐药性依赖于巨噬细胞中嘧啶的从头合成途径。最后,作者在小鼠模型上证实了采用巨噬细胞耗竭的策略可以有效提高胰腺癌细胞对吉西他滨的敏感性。
小结
墨菲特癌症中心Asmaa El-Kenawi博士评论道:“胆固醇和嘧啶的生物合成在能量上是昂贵的。值得研究的是,增殖的肿瘤细胞是否从TAMs中获取胆固醇和嘧啶作为现成营养物质,而不是自身制造这些化合物。总之,两篇论文都证实了靶向巨噬细胞在卵巢癌和/或胰腺癌中的治疗潜力。未来的研究将验证类似的代谢依赖是否存在于其他癌症类型中。”
参考文献
1. Asmaa El-Kenawi. With macrophages, tumors won’t go hungry. Science Translational Medicine. 10 Apr 2019: Vol. 11, Issue 487, eaax1722. DOI: 10.1126/scitranslmed.aax1722.
2. P. Goossens et al., Membrane cholesterol efflux drives tumor-associated macrophage reprogramming and tumor progression. Cell Metab. 10.1016/j.cmet.2019.02.016 (2019).
3. C. J. Halbrook et al., Macrophage-released pyrimidines inhibit gemcitabine therapy in pancreatic cancer. Cell Metab. 10.1016/j.cmet.2019.02.001 (2019).



