文献解读
Nature Medicine | 维纳妥拉联用阿扎胞苷治疗老年白血病的代谢组学研究
急性髓系白血病(AML)是成人最常见的急性白血病。白血病干细胞(LSCs)驱动AML的发生和持续发展,可量化地与更差的临床结果相关联,并且经常在常规化疗后依然存在并导致复发。上海交大附属第六人民医院转化医学中心贾伟教授课题组与上海血液学研究所陈赛娟院士课题组合作研究曾发现:除了葡萄糖之外,果糖是AML细胞的另外一个重要能源物质,其中负责果糖转运和利用的转运子GLUT5,是治疗AML的一个新靶点。而科罗拉多大学医学院血液科的Craig T. Jordan课题组在本次研究中发现,B淋巴细胞瘤-2基因(BCL-2)抑制剂维纳妥拉(venetoclax)联合阿扎胞苷(azacitidine)治疗老年AML患者获得良好效果,且优于常规治疗方案。通过代谢组学研究发现,联合用药可以通过降低α酮戊二酸和增加琥珀酸含量以阻断三羧酸(TCA)循环,从而抑制电子传递链复合体Ⅱ,并通过体外模型进行了验证,该研究成果发表于《Nature Medicine》。
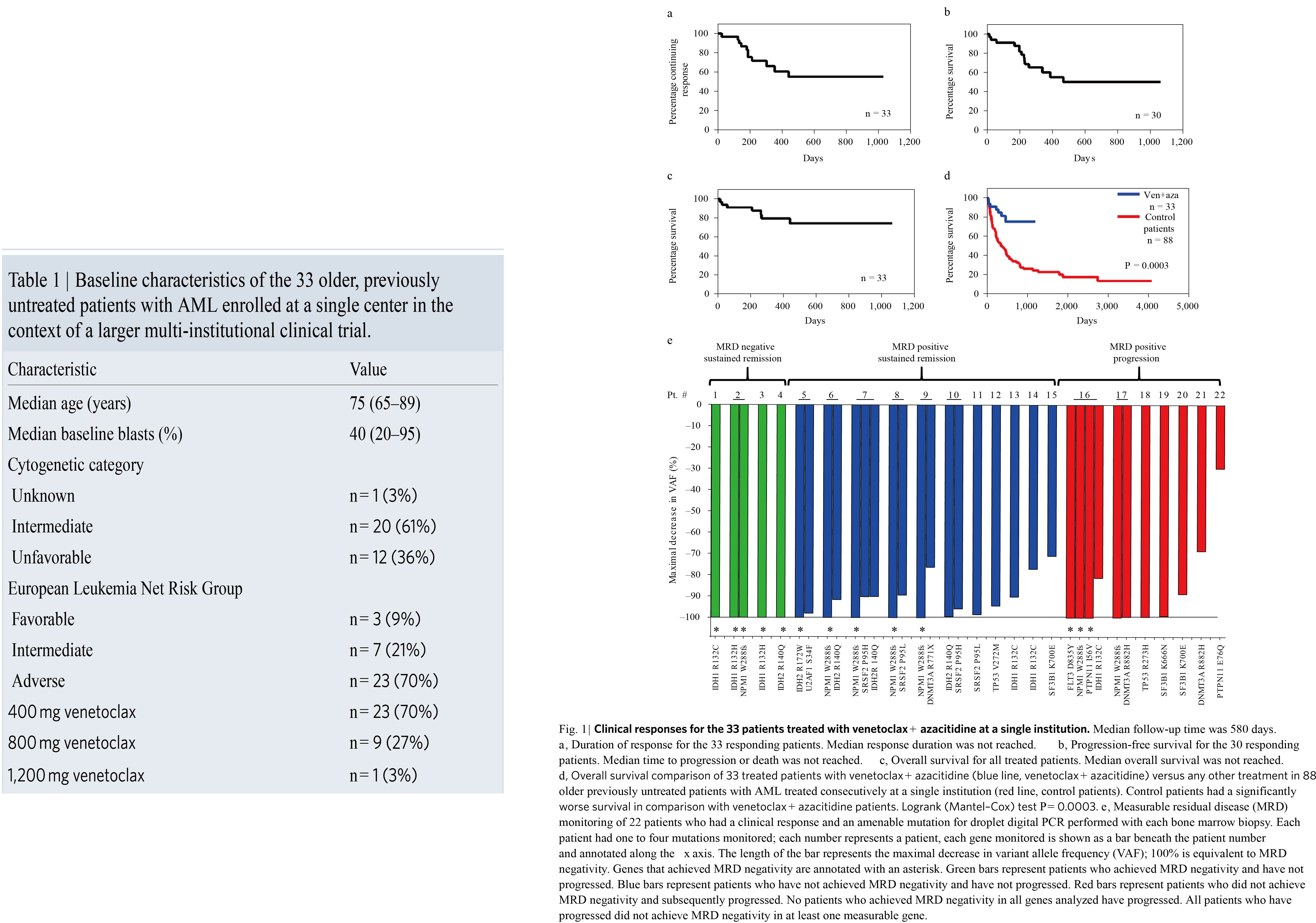
药物疗效评价
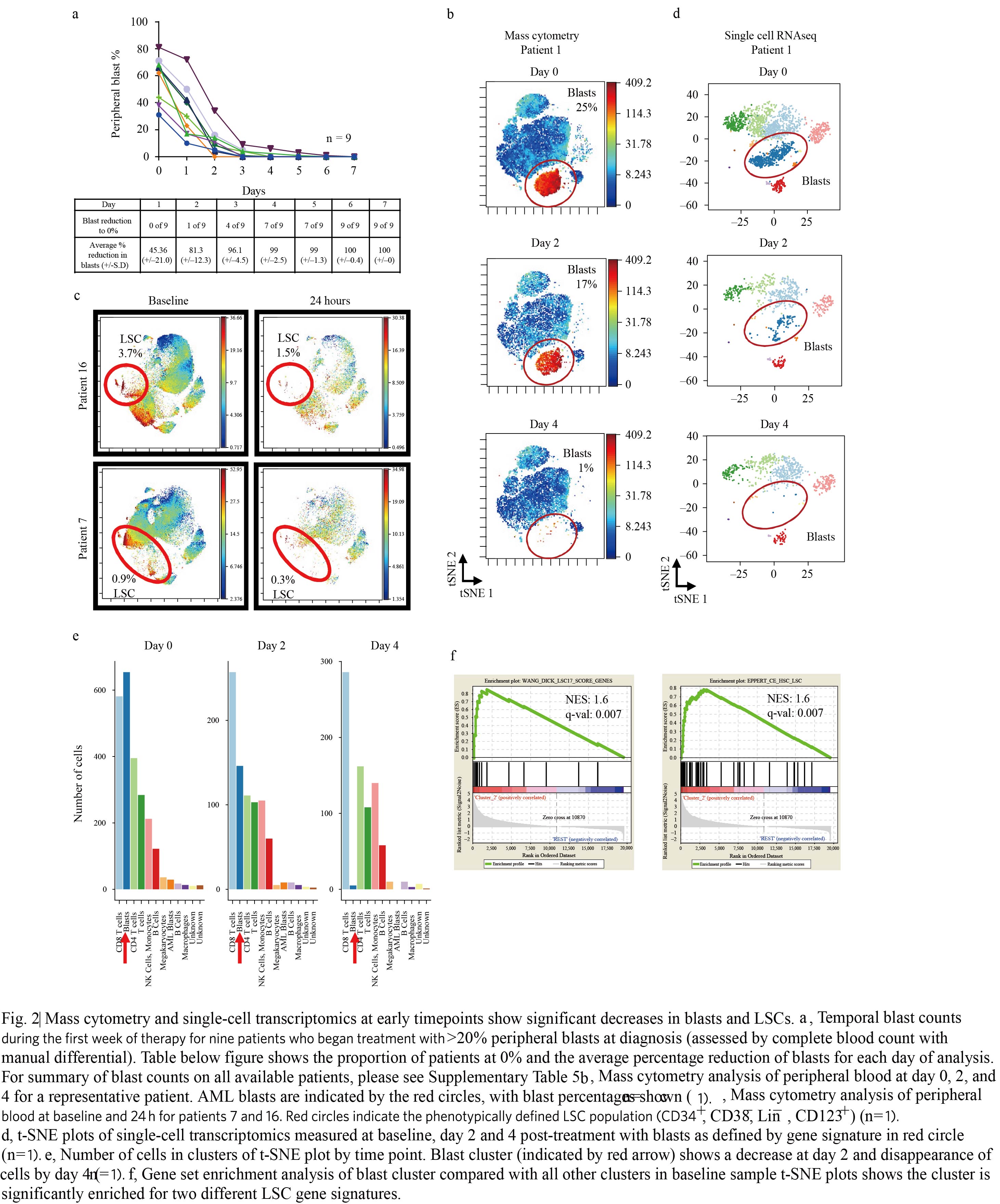
在本研究中,共纳入33例新诊断的AML患者进行联合用药治疗,另外从其他治疗方式的285例AML患者中筛选出年龄和细胞遗传学匹配的88例作为对照人群,对纳入样本进行相关检测及随访。基于完全缓解(CR)率和CR持续时间方面等临床结果,显示出联合用药疗效更佳。对照组中CR和不完全血液恢复(CRi)的比例为52%,而联合用药组的两者比例为85%。另外,联合用药组的中位总生存显著优于对照组(P=0.0003)。随后检测了患有循环疾病患者的外周血以研究与联合用药相关的细胞事件。研究发现伴有循环疾病患者外周血幼稚细胞数在24小时内显著减少,治疗6天内所有患者的外周血幼稚细胞数均完全消除(图2a)。对患者治疗前后样本进行质谱流式技术检测,治疗效果对表型明确的AML原始细胞群具有高度的选择性,肿瘤负荷显著地快速降低,与临床结果一致(图2b),更重要的是对表型明确的LSCs进行相关检测(CD34+, CD38, Lin–, CD123+)也显示肿瘤细胞快速消除(图2c)。而传统治疗方式治疗4天内则没有显著疗效。为了进一步研究治疗初始阶段靶向细胞的分子特征,在基线和治疗2、4天后进行了单细胞RNA-seq研究(图2d,e)。通过特异性转录本的表达可鉴定出各种细胞群。免疫表型分析发现正常造血细胞没有变化,而幼稚细胞则迅速耗尽。治疗前后白血病和正常细胞进行基因组富集分析发现,被联合用药消除的细胞群强烈表达出在人原代LSCs上鉴定出的分子特征(图2f)。结合表型结果(图2c),这些数据表明联合用药优先靶向作用于原始AML细胞。
药物疗效机制探讨
联合用药治疗后的6小时从样本中分离出低活性氧细胞(ROS-low)进行RNA-seq分析,发现氧化磷酸化通路(OXPHOS)出现显著下调,提示OXPHOS是LSC维持和存活的关键通路。临床前研究已经表明,BCL-2抑制剂降低了OXPHOS,导致LSCs死亡,但不会导致正常的造血干细胞死亡,因为正常造血干细胞会通过增加糖酵解来补偿OXPHOS的减少。基于联合用药后的临床发现,假设联合用药是通过降低OXPHOS靶向作用于患者LSCs,因此对联合用药前及治疗后24小时收集的患者肿瘤标本进行代谢组学分析。部分患者在治疗后基础OXPHOS显著降低或OXPHOS备用容量显著降低(图3a,3b),而常规治疗患者未出现OXPHOS减少。对从患者中分离的LSCs进行体外联合用药干预4小时后发现,从4个AML患者中分离的样本均出现OXPHOS减少(图3c)。值得注意的是,联合用药并没有显著降低ROS 高的AML幼稚细胞OXPHOS水平。样本中OXPHOS水平降低的同时ATP水平也降低,与临床前研究结果一致,证明联合用药可降低AML患者的OXPHOS水平和能量产生。
TCA循环中间体可直接通过电子传递链(ETC)复合体II为OXPHOS提供底物。因此采用非靶向代谢组学及靶向定量代谢组学技术,从3名患者分离的LSCs干预24小时后,α-酮戊二酸、苹果酸和富马酸水平显著降低,琥珀酸水平显著增加(图3e)。琥珀酸是ETC复合体II的代谢底物,其水平增加表明ETC复合体II活性出现缺陷。此外,3名患者的谷胱甘肽水平显着降低(图3f),与细胞ROS增加有关(图3g)。有趣的是,接受“7 + 3”治疗(阿糖胞苷加柔红霉素)的患者也出现ROS水平增加,说明单纯的ROS升高不足以说明治疗方式靶向作用于患者LSCs。 谷胱甘肽具有多种关键的细胞功能,包括调节ETC复合体II的组分琥珀酸脱氢酶A(SDHA)活性。 谷胱甘肽化是一种翻译后修饰方式,研究发现其可增加ETC复合体II活性。 因此,联合用药可能导致谷胱甘肽减少,从而减少SDHA谷胱甘肽化,这将导致ETC复合物II活性降低并抑制OXPHOS。为了验证这一假设,对原发性AML标本体外联合用药干预后直接测量ETC复合物II活性和SDHA谷胱甘肽化。体外实验结果首先证实体内观察,即联合用药在体外可降低谷胱甘肽水平(图4a)。同时,SDHA的谷胱甘肽化降低(图4b),而这与ETC复合物II活性降低相关(图4c)。此外,即使联合用药情况下,细胞渗透性谷胱甘肽预处理白血病细胞也增加了细胞内谷胱甘肽水平(图4d)。细胞内琥珀酸水平在联合用药后出现升高(图4e),与谷胱甘肽降低保持一致。细胞渗透性谷胱甘肽处理后,琥珀酸水平完全恢复至正常,表明联合用药处理的细胞中谷胱甘肽和琥珀酸盐存在相互关系。这些数据表明,联合用药引起的谷胱甘肽水平降低至少是造成ETC复合体II活性降低的部分原因。
谷胱甘肽具有多种关键的细胞功能,包括调节ETC复合体II的组分琥珀酸脱氢酶A(SDHA)活性。 谷胱甘肽化是一种翻译后修饰方式,研究发现其可增加ETC复合体II活性。 因此,联合用药可能导致谷胱甘肽减少,从而减少SDHA谷胱甘肽化,这将导致ETC复合物II活性降低并抑制OXPHOS。为了验证这一假设,对原发性AML标本体外联合用药干预后直接测量ETC复合物II活性和SDHA谷胱甘肽化。体外实验结果首先证实体内观察,即联合用药在体外可降低谷胱甘肽水平(图4a)。同时,SDHA的谷胱甘肽化降低(图4b),而这与ETC复合物II活性降低相关(图4c)。此外,即使联合用药情况下,细胞渗透性谷胱甘肽预处理白血病细胞也增加了细胞内谷胱甘肽水平(图4d)。细胞内琥珀酸水平在联合用药后出现升高(图4e),与谷胱甘肽降低保持一致。细胞渗透性谷胱甘肽处理后,琥珀酸水平完全恢复至正常,表明联合用药处理的细胞中谷胱甘肽和琥珀酸盐存在相互关系。这些数据表明,联合用药引起的谷胱甘肽水平降低至少是造成ETC复合体II活性降低的部分原因。
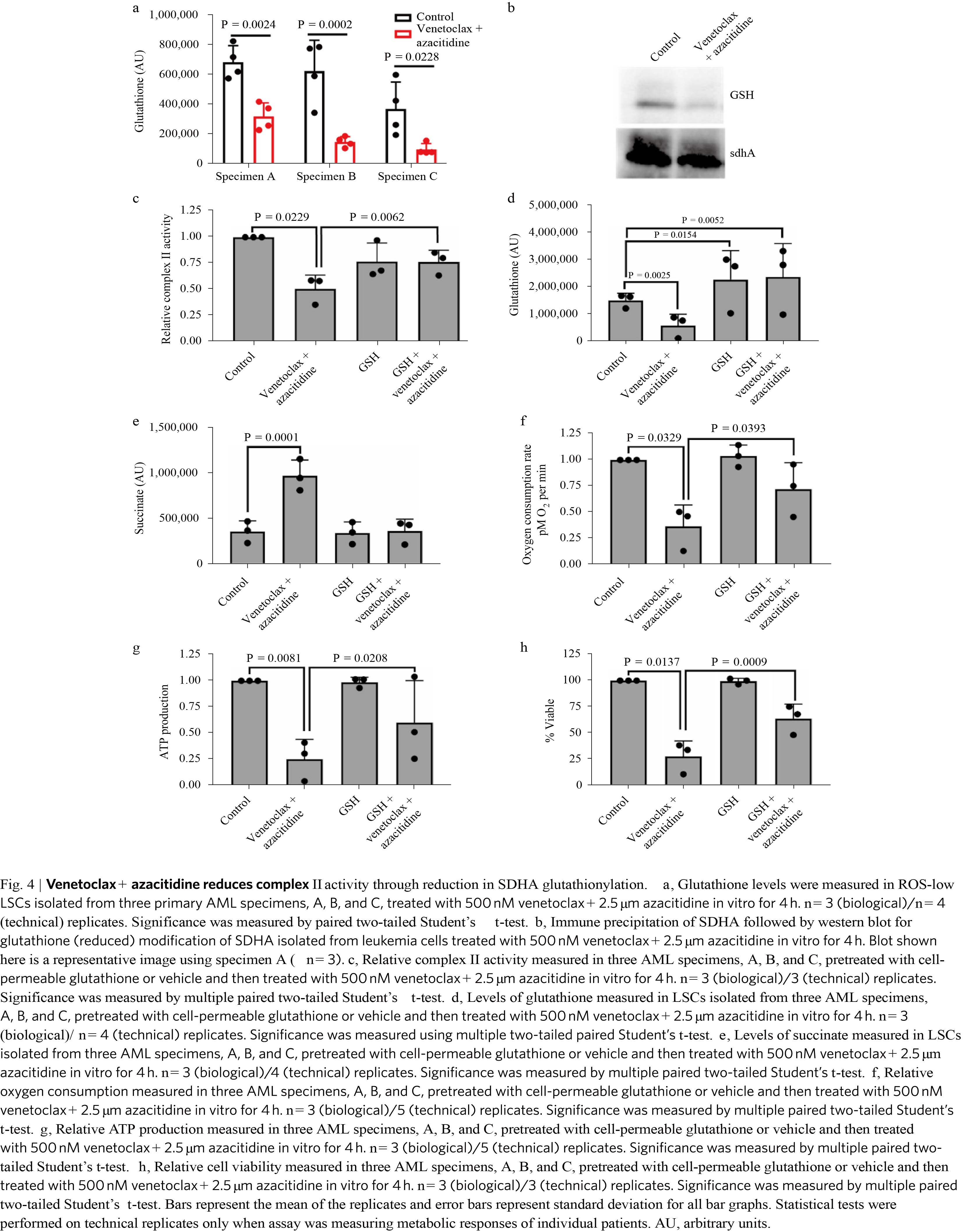
为了确定谷胱甘肽降低对OXPHOS的影响,研究中还针对细胞渗透性谷胱甘肽预处理后用再联合用药对低ROS的 LSCs中OXPHOS水平进行测定。如图4c所示,联合用药降低LSCs中的OXPHOS水平,而用细胞渗透性谷胱甘肽预处理则引起OXPHOS水平恢复(图4f)。此外,ATP水平也出现相似的恢复(图4g)。最后,确定了谷胱甘肽水平降低对LSC存活的功能作用,表现为谷胱甘肽预处理可部分修复联合用药所致的LSC存活降低(图4h)。有趣的是,SDHA谷胱甘肽化、ETC复合物II活性、OXPHOS和ATP水平的降低仅发生在联合用药,而不是单独使用任何一种药物。然而,单独venetoclax或azacitidine治疗也可以增加ROS水平,且与联合用药引起的ROS水平升高不存在差异性。总体而言,研究结果证实:联合用药通过以谷胱甘肽依赖性方式破坏ETC复合体II来降低OXPHOS,从而导致靶向作用于LSC。
小结
自从认识到一些癌细胞倾向于糖酵解过程而不是氧化过程(Warburg效应),通过扰乱代谢环境以靶向干预癌症一直是一个吸引人的治疗策略。不过,最近一些临床前研究报道在几种癌症干细胞亚型(包括LSCs)中观察到“逆Warburg”效应,包括依赖OXPHOS进行新陈代谢。该研究表明,破坏能量代谢可能是治疗AML的一种策略。联合用药降低ETC复合体II活性和 ROS水平,靶向作用于LSCs导致其OXPHOS水平降低。重要的是, venetoclax 联合azacitidine可用来降低谷胱甘肽水平,这表明未来venetoclax的治疗方案应继续联合azacitidine。不过,本研究结果与之前体外研究结果不一致,该研究的实验结果表明单纯venetoclax用药不足以引起体内OXPHOS水平抑制,而venetoclax联合azacitidine对于抑制OXPHOS水平是有必要的,这也部分解释了药物组合在患者中的良好功效。这些发现补充和扩展了最近的几项临床前研究,也说明了线粒体代谢在LSC生存中发挥重要作用。
参考文献
Pollyea D A , Stevens B M , Jones C L , et al. Venetoclax with azacitidine disrupts energy metabolism and targets leukemia stem cells in patients with acute myeloid leukemia. Nature Medicine, 2018.



