文献解读
Cell Metabolism | 肠道菌群相关代谢物–胆汁酸生物学功能
肠道微生物群被认为是一种代谢器官,产生大量的代谢物(短链脂肪酸、胆汁酸、吲哚衍生物等),这些代谢物通过其同源受体发出信号来调节宿主的代谢。胆固醇在肝脏中由酶氧化产生大量不同的胆汁酸,并由肠道微生物群在肠道中代谢,它既是促进消化和吸收膳食脂肪的洗涤剂,又是激活不同受体的激素。这些受体的激活改变了多个组织中的基因表达,改变了胆汁酸代谢、葡萄糖稳态、脂质和脂蛋白代谢、能量消耗、肠道运动和细菌生长、炎症、肝脏再生和肝癌的发生等。本文着重介绍胆汁酸在体内的代谢过程和涉及的信号通路及功能。
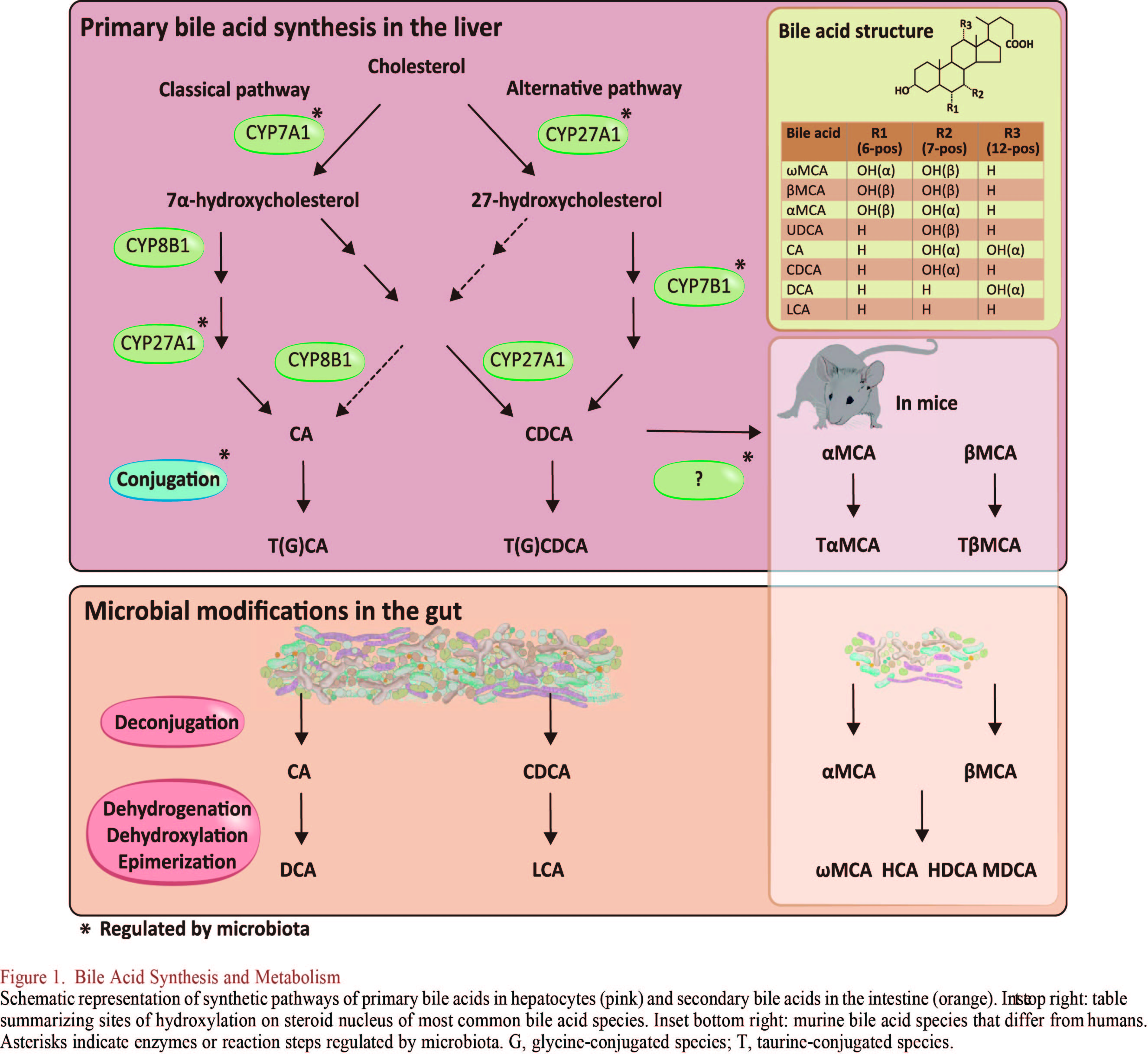
肝脏:胆固醇代谢生成胆汁酸
胆汁酸的形成比较复杂,涉及的催化反应包括了至少17种不同的酶。胆汁酸的合成发生在肝脏,可通过两种不同途径来完成。经典(或中性)途径是胆固醇经胆固醇-7α-羟化酶(CYP7A1)催化生成7α-羟基胆固醇,进一步催化生成胆酸(CA)和鹅去氧胆酸(CDCA),CYP7A1是整条途径的限速酶,决定胆汁酸生成量,在正常条件下至少75%的胆汁酸通过该途径产生。替代(或酸性)途径则由甾醇-27-羟化酶(CYP27A1)催化生成27-羟基胆固醇进一步被氧甾醇-7α-羟化酶(CYP7B1)催化生成CDCA,人和老鼠通过该途径分别产生总胆汁酸量的9%和25%。已有研究表明肠道微生物群可调节CYP7A1、CYP7B1和CYP27A1酶的表达。值得注意的是,替代途径主要产生CDCA,而经典途径产生CDCA和CA,两种初级胆汁酸的比例由合成CA所必需的甾醇-12α-羟化酶(CYP8B1)决定,该酶不受微生物调节。除CA和CDCA外,小鼠还产生初级胆汁酸MCAs(主要是β-MCA)和熊去氧胆酸(UDCA),而在人类中,UDCA是次级胆汁酸, MCAs通常检测不到。胆汁酸的化学结构既有疏水的甾环,又有亲水的羟基或者氨基酸侧链。这种两性结构使得胆汁酸具有洗涤剂性质便于形成胶束,促进小肠脂类和脂溶性维生素A、D、E和K的消化吸收,按亲脂性排序依次为:LCA > DCA >CDCA > CA > UDCA > MCA。在排泄到胆汁并进一步通向十二指肠之前,肝脏胆汁酸C-24位通过两步反应与甘氨酸或牛磺酸结合,这个过程降低了胆汁酸pKa,同时增加其溶解度。然而,与能扩散穿过细胞膜的非结合型胆汁酸不同,胆汁盐需要跨膜转运蛋白才可以穿过膜。结合型胆汁酸通过胆盐输出泵(BSEP)主动运输到胆汁中,并储存在胆囊内,直到进食后释放到十二指肠。人体中胆汁酸主要与甘氨酸结合,牛磺酸结合程度较小,而小鼠和大鼠中胆汁酸几乎完全与牛磺酸结合。大约95%的胆管分泌的胆汁酸从肠道重新吸收,主要是以结合型胆汁酸的形式在回肠末端通过钠依赖性胆汁酸转运蛋白(ASBT,也称为IBAT),经门静脉循环至肝脏,再由肝脏分泌,这个过程称为胆汁酸肠肝循环,在人体内每天大约发生六次。
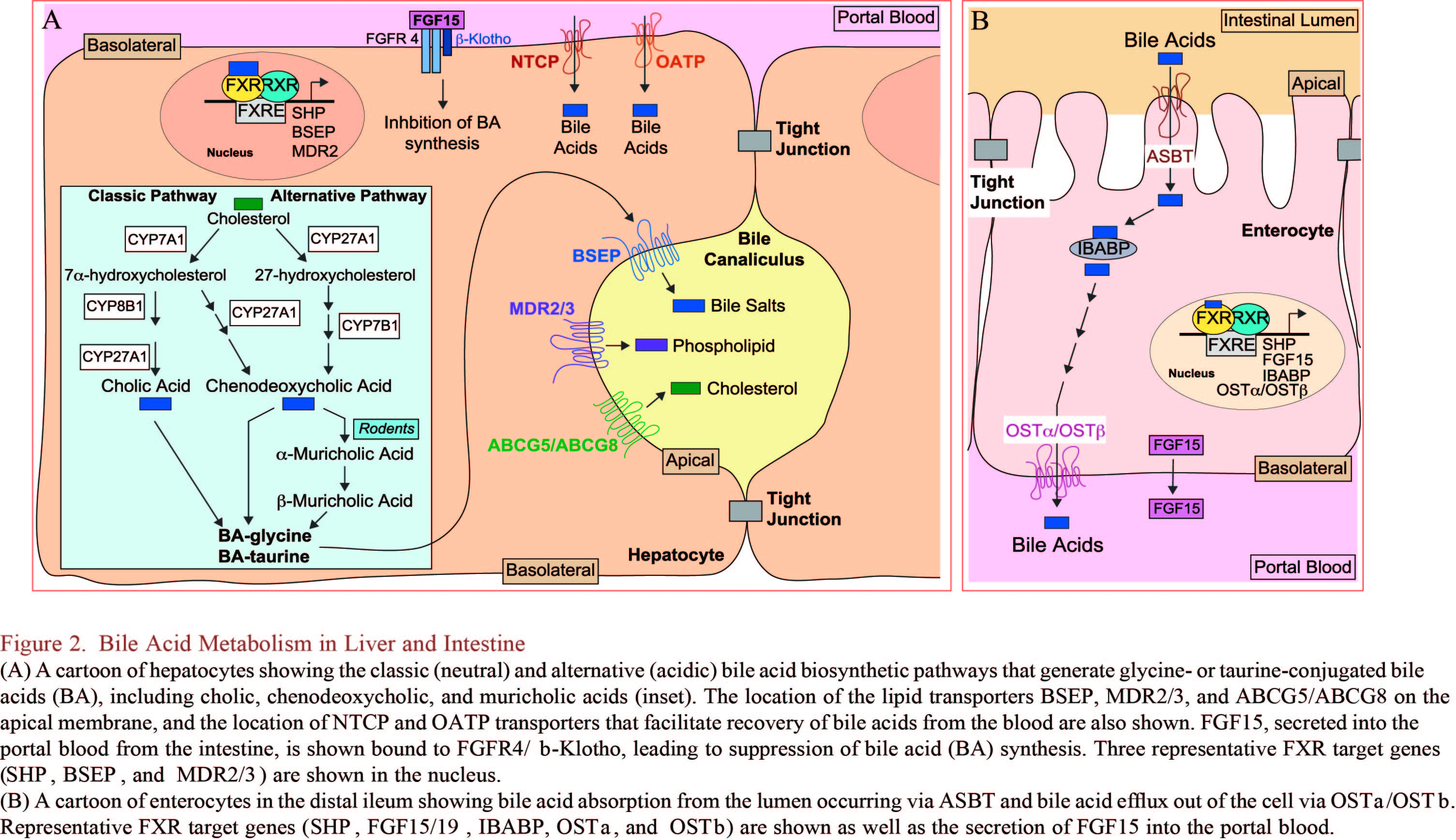
肠道:胆汁酸的微生物代谢
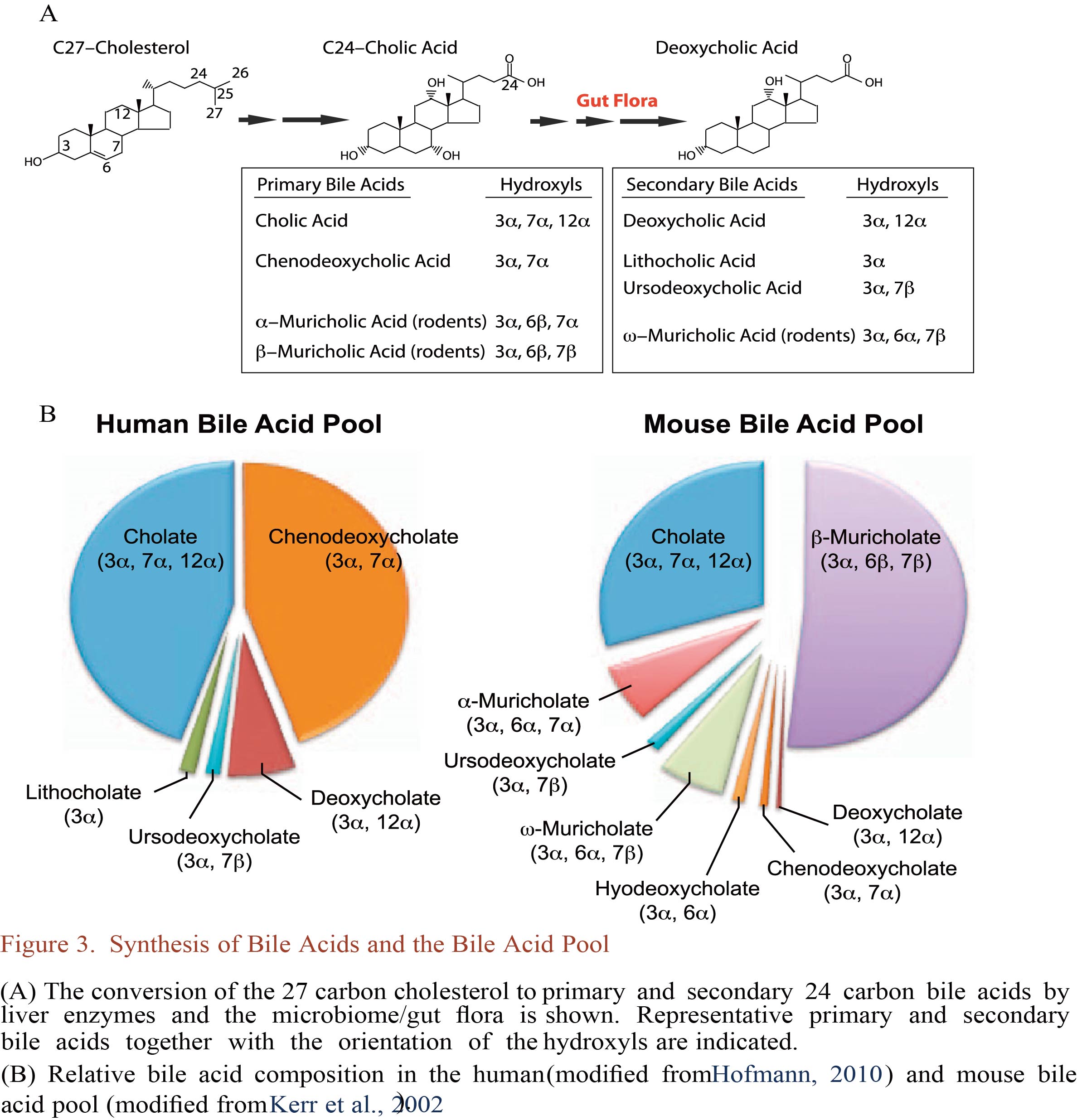
大多数(95%)胆汁酸通过肠细胞的顶膜钠依赖性胆盐转运体(ASBT)在回肠末端被重吸收。肠道胆汁酸结合蛋白(IBABP /脂肪酸结合蛋白亚类6 / FABP6)可以促进胆汁盐通过肠上皮细胞转运到基底外侧膜,并通过异二聚体转运蛋白OSTa / OSTb入血。微生物去结合(即去除甘氨酸或牛磺酸缀合物)防止胆汁酸通过ASBT从小肠中主动再摄取。胆汁酸去结合过程由具有胆汁盐水解酶(BSH)活性的细菌主导的。宏基因组学研究表明功能性BSH存在于人类肠道所有主要细菌和古菌种中,包括乳酸杆菌、双歧杆菌、梭菌和拟杆菌等。与其他微生物生态系统相比,BSH在肠道微生物中富集,并与胆汁毒性的抗性增加有关。未被ASBT重吸收的初级胆汁酸进入结肠,通过7-脱羟基代谢成次级胆汁酸:来自CDCA的石胆酸(LCA)和来自CA的脱氧胆酸(DCA)(Figure 1)。鼠α-MCA和β-MCA发生相同反应生成鼠去氧胆酸(MDCA)。Omega-MCA(ω-MCA)是β-MCA主要代谢产物,通过6β-差向异构化形成。β-MCA还可通过6β-差向异构化和额外的7β-脱羟基作用形成猪去氧胆酸(HDCA),以及通过6β-差向异构化和进一步的7β-差向异构化形成猪胆酸(HCA,也称为γMCA)。人体中的UDCA是由梭状芽胞杆菌将CDCA经过7α/β-异构化形成的。进一步经过3α/β-羟基和5-Hβ/α异构化分别生成异胆酸和别胆酸。7-脱羟基过程由细菌与胆汁酸诱导的基因进行多重反应。能够产生次级胆汁酸的细菌属于厚壁菌门,分别为梭菌属(XIVa和XI簇)和真杆菌属。另一种胆汁酸微生物转化是生成氧-(或酮-)胆汁酸,由含有羟基类固醇脱氢酶(HSDHs)的细菌将3,7或12环位的羟基氧化生成,含有羟基类固醇脱氢酶(HSDHs)的细菌属于放线菌门、变形菌门、厚壁菌门和拟杆菌门。这些氧化反应是可逆的,最终可导致差向异构化。
胆汁酸的微生物代谢增加了胆汁酸多样性及胆酸池的疏水性,有利于促进胆汁酸的粪便排泄,菌群产生的次级胆汁酸量约为胆汁酸总量的5%。其中一小部分去结合次级胆汁酸也可通过被动扩散作用从肠道重吸收,并在肠肝循环中富集并充当宿主中的信号分子。不同条件下的小鼠粪便ω-MCA,MDCA和HDCA水平有很大差异,这可能归因于肠道微生物群组成的差异改变了胆汁酸的微生物修饰,但人类肠道微生物群不能代谢β-MCA。小鼠和人类不同的胆汁酸谱通过胆汁酸受体改变信号传导,因此从小鼠研究结果转化到人类时需要谨慎对待。值得注意的是,异胆汁酸存在于人类血清和尿液中,特别是在结肠和粪便中,其中iso-LCA和iso-DCA是仅次于LCA和DCA的第二丰富的胆汁酸,在某些个体中浓度分别达到290和390 μM。产生异胆酸的细菌包括迟缓真杆菌和产气荚膜梭菌,iso-DCA不仅由迟缓真杆菌产生,产气荚膜梭菌也能产生。研究显示iso-DCA有利于拟杆菌属生长,提示微生物HSDH可作为肠道微生物组成和宿主代谢的潜在调节因子。由于有限的胆汁酸标准品和部分胆汁酸的含量微乎其微,常规和高级胆汁酸的分析中不可能检测到所有的胆汁酸形式。另外,由原始5β-H位置脱羟基作用/消除反应产生的5α-H(”allo”)胆汁酸的报道很少,有待进一步挖掘。
法尼酯X受体(FXR)与胆汁酸
胆汁酸的合成受到核受体FXR负反馈抑制调节,FXR是一种与启动子区域结合并启动多种靶基因表达的转录因子,在多种组织中均有表达。FXR高表达且研究最多的是肝脏和回肠。FXR在肾脏中也有相当高的表达水平,而在心脏、卵巢、胸腺、眼睛、脾脏和睾丸中表达水平较低。FXR在胆汁酸调节中的方式有两种,其一,胆汁酸激活肝脏FXR诱导小异二聚体伴侣(SHP)分子的表达,SHP与肝受体同源蛋白-1 (LRH-1)结合,从而抑制Cyp7a1基因的表达(Figure 4)。其二,除了肝脏局部作用外,远端回肠中FXR也可被胆汁酸激活,诱导FGF15(人类为FGF19)表达。FGF15 /19通过门静脉到达肝脏,与FGF受体4(FGFR4)/b-klotho异二聚体复合物结合,触发JNK1/2和ERK1/2信号级联反应抑制Cyp7a1的表达(Figure 4)。组织特异性FXR缺陷小鼠研究表明回肠FXR激活抑制Cyp7a1介导的胆汁酸合成比肝FXR激活更强,而肝脏FXR可能调控Cyp8b1改变CA合成。FXR最有效的配体是CDCA,其次是CA、DCA和LCA。UDCA不激活FXR,它反而抑制FXR活化。最近,小鼠牛磺酸结合的初级胆汁酸Tα-MCA和Tβ-MCA已被确定为天然存在的FXR拮抗剂。GF小鼠Tβ-MCA积累,FXR信号减弱,胆汁酸合成增加,Tβ-MCA在没有细菌的情况下不能代谢。研究发现微生物群以FXR依赖性方式调节胆汁酸的代谢和合成。微生物群不仅能代谢胆汁酸,还可调控FXR信号途径。微生物群通过将FXR的拮抗剂Tβ-MCA去结合,从而促进小鼠FXR信号传导,并产生作为TGR5配体的二级胆汁酸。此外,FXR激活还可以诱导其他转运体BSEP/ABCB11、 MDR3/MDR2/ABCB4、ABCG5/ABCG8的表达影响胆汁酸代谢。
微生物群和胆汁酸之间的相互作用并不是单向的。胆汁酸通过促进胆汁酸代谢细菌的生长和抑制其他胆汁敏感菌的生长来重塑肠道微生物群落。研究表明,阻止胆汁流入肠道引发的胆道阻塞会导致小肠内细菌过度生长和移位,这种表型可通过胆汁酸给药逆转。这也证明了胆汁酸不但能通过破坏细菌细胞膜发挥直接抗菌作用,而且还间接通过FXR诱导宿主免疫系统影响肠道微生物群的抗菌药物(如iNOS和IL-18)的转录。胆汁酸作为信号分子和FXR在肝脏、小肠等代谢活跃组织中表达的重要性已经引起了人们对FXR在代谢疾病中作用的极大兴趣。然而,FXR缺乏小鼠进行的实验有时会产生相互矛盾的结果,显然饮食以及动物饲养环境之间存在微生物群差异,可能会导致不同的表型。Fxr缺乏的小鼠喂养正常饲料容易发生高血糖和高胆固醇血症,而Ldlr-/-背景下的Fxr缺乏小鼠喂养高脂饮食可改善脂质代谢,并对饮食诱导的肥胖和动脉粥样硬化具有保护作用。相比之下,Apoe-/-基因背景下的Fxr缺陷小鼠更容易出现动脉粥样硬化。总体而言,与对照组小鼠相比,Fxr缺陷小鼠喂食高脂饮食或有肥胖遗传背景 (ob/ob)的小鼠似乎可以预防肥胖,并改善葡萄糖稳态。因此,FXR与特定营养素之间关系值得进一步研究。此外,FXR在肾脏近端和远端集合管细胞均有表达,所以其在胆汁酸代谢中的作用还需进一步研究。
综上所述,FXR在肝细胞和肠细胞中表达,其作用是监测细胞胆汁酸/盐水平,调节相关基因表达以维持胆汁酸/盐的肠肝循环,防止细胞内胆汁酸积累到毒性水平。FXR除了调节胆汁酸稳态外,还可以调节血浆脂蛋白、葡萄糖、脂肪变性、炎症、细菌生长和肝再生等过程。

G蛋白偶联受体TGR5与胆汁酸
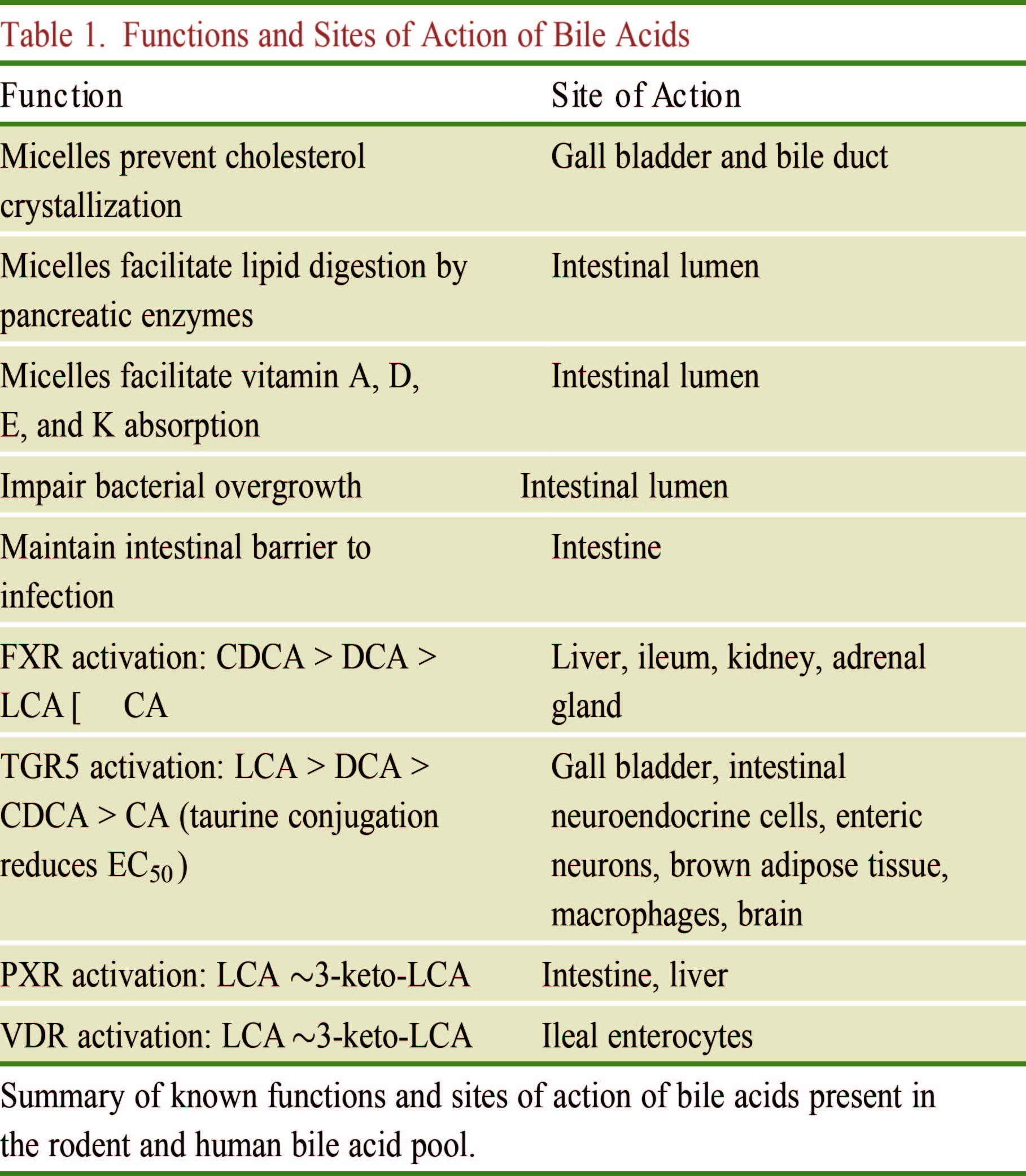
TGR5是另一种胆汁酸受体,是一种G蛋白偶联受体(GPCR),在肝非实质细胞(胆管细胞、窦内皮细胞、Küpffer 细胞及免疫细胞)表达,也在胎盘、肺、脾、肠、棕白色脂肪组织、骨骼肌、骨髓中表达。TGR5主要由疏水性次级胆汁酸LCA和DCA激活,是微生物与胆汁酸相互作用的另一个靶点(Figure 4)。TGR5的激活导致受体内化,环磷腺苷(cAMP)水平升高,蛋白激酶A活化,导致靶蛋白磷酸化水平增加,包括cAMP效应元件结合蛋白(CREBP)转录因子。这种活化引起的结果是广泛的且具有细胞特异性,包括巨噬细胞中抗炎作用,增加褐色脂肪组织能量消耗,改善葡萄糖代谢和胰岛素敏感性,胆囊松弛,增加肠道运动。TGR5缺陷小鼠没有明显的异常表型且具备生育能力,但其胆汁酸池减少,表明TGR5在胆汁酸稳态中具有一定作用,但尚不清楚是TGR5的直接影响还是通过FXR介导的。另外,目前尚不清楚FXR和TGR5是否通过微生物群和胆汁酸代谢的改变直接或间接产生其他受体激动剂或拮抗剂。
孕烷X受体与 维生素D受体
孕烷X受体(PXR/NR1I2)在肝脏和肠道中高度表达,在其他组织中水平较低。与激活FXR的胆汁酸不同,PXR由肝毒性胆汁酸LCA和3-keto-LCA (EC50 10 mM) 激活,对CDCA、DCA、CA无应答。激活的PXR诱导I-III期基因参与多种代谢物代谢、运输和排泄过程,包括外源性物质和有毒胆汁酸,如LCA。然而,LCA或3-keto-LCA激活肝脏和肠道PXR的重要性仍有待确定。最近的研究报告显示,由于NFkB的表达减弱和炎症细胞因子的表达减少,肠道PXR对炎症性肠病具有保护作用,但是胆汁酸是否能提供类似的PXR依赖性保护作用来对抗炎症性肠病仍需要进一步研究。
维生素D受体(VDR/NR1I1)在多个组织中表达包括肾、肠和巨噬细胞,调控许多生理和药理过程,这些过程不仅包括骨骼和钙代谢,还包括免疫、细胞生长和分化。VDR最有效的内源性激动剂是1,25-二羟维生素D3(1,25-diOHD3)。但具有肝毒性胆汁酸LCA和3-keto LCA被证明也可以激活VDR靶基因,包括CYP3A家族成员,这些基因参与了LCA和其他毒素代谢,生成毒性较低的生物非活性产物。
小结
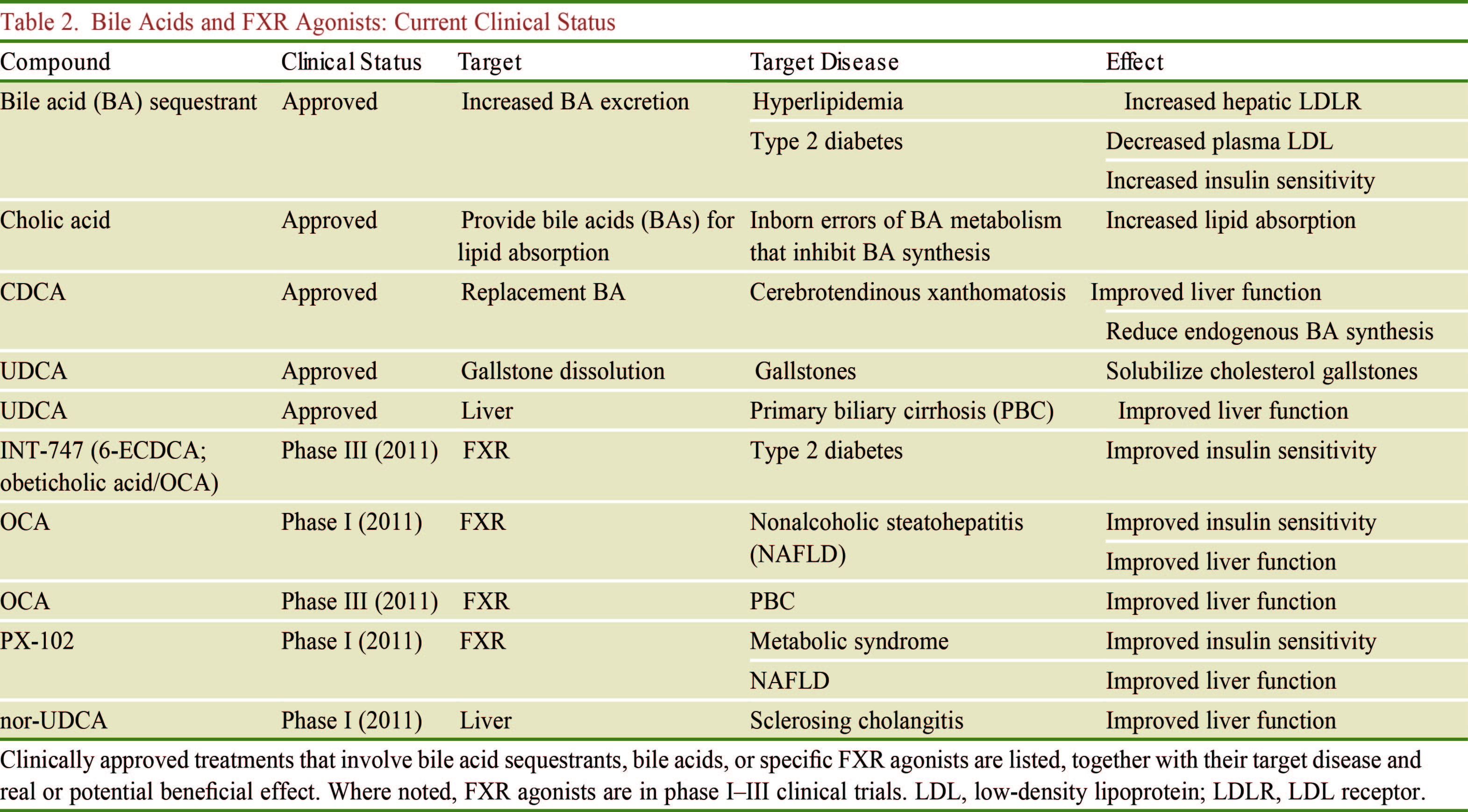
本文总结了胆汁酸与肠道菌群及宿主之间的相互作用,微生物群可直接或间接通过胆汁酸调节FXR和TGR5的信号传导。胆汁酸受体FXR和TGR5已成为代谢疾病的转化和介入研究的主要靶点。因此,了解肠道微生物群及其对胆汁酸代谢和信号传导的影响可能有助于解释临床前数据。然而,人和鼠胆汁酸具有显著不同的信号传导特性,并且缺乏丰富和/或表征的胆汁酸代谢物可能影响获得结论的正确性。微生物群的差异也可以解释个体对胆汁酸衍生药物的不同反应,对微生物群更深入的了解可以识别出对治疗有积极反应的个体和有不良反应的个体。针对微生物群、胆汁酸和FXR和/或TGR5信号之间的相互作用似乎发展成为治疗代谢疾病极具应用前景的途径,表2列举了目前已开展临床实验的胆汁酸相关制剂,但仍需要更多的研究。
参考文献
- Wahlström A, Sayin S I , Marschall H U , et al. Intestinal Crosstalk between Bile Acids and Microbiota and Its Impact on Host Metabolism. Cell Metabolism, 2016, 24(1):41-50.
- Q. de Aguiar Vallim T , Tarling E , Edwards P . Pleiotropic Roles of Bile Acids in Metabolism. Cell Metabolism, 2013, 17(5):657-669.



